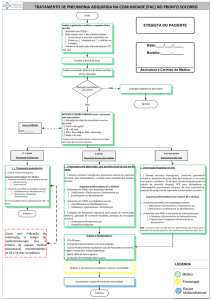
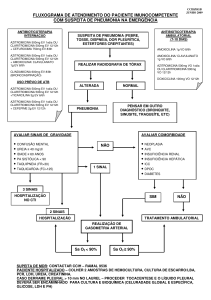
RESUMO DAS CARACTERISTICAS DO MEDICAMENTO
1 – DENOMINAÇÃO DO MEDICAMENTO
Claritromicina Azevedos 250 mg comprimidos
Claritromicina Azevedos 500 mg comprimidos
2 – COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Claritromicina Azevedos 250mg comprimidos:
Cada comprimido contém 250 mg de Claritromicina.
Claritromicina Azevedos 500mg comprimidos:
Cada comprimido contém 500 mg de Claritromicina.
Excipientes, ver 6.1.
3 – FORMA FARMACÊUTICA
Comprimidos revestidos por película.
4 – INFORMAÇÕES CLÍNICAS
4.1 - Indicações terapêuticas
- Infecções do tracto respiratório superior:
Faringite e amigdalite causadas por Streptococcus pyogenes.
A escolha habitual para o tratamento e prevenção das infecções pelo streptococcus e
para a profilaxia da febre reumática é a penicilina. Embora a claritromicina seja eficaz
na erradicação do streptococcus pyogenes da nasofaringe, a sua eficácia na subsequente
prevenção da febre reumática não está até ao momento estabelecida.
Sinusite maxilar aguda causada por Haemophilus influenzae, Moraxella catarrhalis ou
Streptococcus pneumoniae.
Otite média aguda causada por Haemophilus influenzae, Moraxella catarrhalis ou
Streptococcus pneumoniae.
- Infecções do tracto respiratório inferior:
Exacerbação bacterial aguda da bronquite crónica causada por Haemophilus influenzae,
Moraxella catarrhalis ou Streptococcus pneumoniae.
Pneumonia causada por Mycoplasma pneumoniae, Streptococcus pneumoniae ou
Chlamydia pneumoniae (TWAR).
- Infecções da pele e tecidos moles, causada por Staphylococcus aureus ou
Streptococcus pyogenes.
- Erradicação do H. pylori, desde que se obtenha supressão ácida e prevenção da
recorrência de úlcera duodenal.
- Profilaxia da infecção disseminada pelo Mycobacterium avium complexo
(MAC) que consiste nas estirpes de Mycobacterium avium e Mycobacterium
intracellulare, em doentes infectados pelo VIH, com contagens de linfócito CD4
inferiores ou iguais a 100/mm3.
- Tratamento de infecções por micobactérias localizadas ou disseminadas, devido
a Mycobacterium avium e Mycobacterium intracellulare.
4.2 - Posologia e modo de administração
Infecções do tracto respiratório e infecções da pele e tecidos moles:
A posologia recomendada é de um comprimido de 250 mg, duas vezes por dia. Nas
infecções mais severas, a posologia recomendada é de 500 mg, duas vezes por dia.
A duração média do tratamento é de 6 a 14 dias.
Erradicação do H. pylori e prevenção da recorrência de úlcera duodenal:
Tripla terapia:
A dose recomendada são 500 mg de Claritromicina, 2 x dia, Amoxicilina 1000 mg, 2 x
dia e Omeprazole 20 mg, 1 x dia, durante 7 a 10 dias.
Dupla terapia:
A dose recomendada são 500 mg de Claritromicina, 3 x dia e Omeprazole, 40 mg,
durante 14 dias, seguidos de Omeprazole, 20 mg ou 40 mg diários, por mais 14 dias.
Informação Adicional:
O Helicobacter pylori está fortemente ligado à úlcera péptica. Noventa a 100 % dos
doentes com úlceras duodenais estão infectados com este agente patogénico. A sua
erradicação revelou reduzir de forma importante a percentagem de recorrência de úlcera
duodenal, diminuindo assim a necessidade de manutenção da terapêutica antisecretória.
Tripla terapia:
Num estudo bem controlado, doentes infectados com H. pylori, com úlcera duodenal,
receberam tratamento de erradicação com Claritromicina, 500 mg duas vezes por dia,
Amoxicilina 1000 mg duas vezes por dia e Omeprazole 20 mg diários durante 10 dias,
ou Claritromicina 500 mg três vezes por dia com Omeprazole 40 mg diários durante 14
dias. O H. pylori foi erradicado em 90 % dos doentes recebendo tripla terapia com
Claritromicina e em 60 % dos doentes recebendo dupla terapia.
Dupla terapia:
Em 4 estudos bem controlados, doentes infectados com H. pylori, com úlcera duodenal,
receberam tratamento com Claritromicina, 500mg, 3 x dia, e Omeprazole, 40 mg
diários, durante 14 dias, seguidos de Omeprazole, 40 mg diários (Estudo A) ou
Omeprazole, 20 mg diários (Estudos B, C e D) durante mais 14 dias; os doentes em
cada grupo controlo receberam apenas Omeprazole durante 28 dias.
No Estudo A, o H. pylori foi erradicado em mais de 80 % dos doentes tratados com
Claritromicina e Omeprazole e em apenas 1 % dos doentes tratados apenas com
Omeprazole. Nos Estudos B, C e D, a erradicação foi superior a 70 % nos doentes
tratados com Claritromicina e Omeprazole e inferior a 1 % nos doentes tratados apenas
com Omeprazole. Em cada estudo, a percentagem de recorrência, seis meses depois, foi
estatisticamente mais baixa nos doentes tratados com Claritromicina e Omeprazole
relativamente aos doentes tratados apenas com Omeprazole.
A Claritromicina foi usada noutros tratamentos para erradicação do H. pylori. Estes
incluíram:
- Claritromicina + Tinidazole e Omeprazole ou Lansoprazole
- Claritromicina + Metronidazole e Omeprazole ou Lansoprazole
- Claritromicina + Tetraciclina, Subsalicilato de bismuto e Ranitidina
- Claritromicina + Amoxicilina e Lansoprazole
Infecções por micobactérias:
Tratamento:
A dose inicial para adultos deve ser de 500 mg, 2 x dia.
Nas infecções disseminadas ou localizadas (M. avium e M. intracellulare) em adultos,
recomenda-se 1000 mg/dia, repartidas por duas doses.
Profilaxia:
A dose recomendada de Claritromicina em adultos é de 500 mg, 2 x dia.
Os comprimidos de Claritromicina podem ser tomados independentemente das horas
das refeições.
Crianças:
Não se recomenda a administração da Claritromicina (comprimidos a 250 ou 500 mg)
em crianças com idade inferior a 12 anos.
Idosos:
A Claritromicina pode ser utilizada em doentes idosos, com função renal normal, nas
doses habitualmente recomendadas para o adulto e devidamente aconselhado pelo
médico assistente.
Insuficientes renais:
Nos doentes com insuficiência renal, com níveis de creatinina inferiores a 30 ml/min, a
dose de Claritromicina deve ser reduzida para metade, isto é, 250 mg, uma vez por dia
ou 250 mg duas vezes por dia nas infecções mais severas. Nestes doentes, o tratamento
não deve prosseguir para além dos 14 dias.
Nos doentes com insuficiência renal, recebendo tratamento concomitante com Ritonavir
deverão fazer-se os seguintes ajustes na posologia:
Níveis de creatinina 30-60 ml/min - reduzir a dose de Claritromicina para metade;
Níveis de creatinina inferiores a 30 ml/min - reduzir a dose de Claritromicina em 75 %;
Doses de Claritromicina superiores a 1 g/dia não devem ser co-administradas com
Ritonavir.
Insuficientes hepáticos:
A claritromicina pode ser administrada sem ajustes posológicos, na presença de
insuficiência hepática, se a função renal estiver normal.
4.3 - Contra-indicações:
A Claritromicina está contra-indicada em doentes com hipersensibilidade conhecida aos
Macrólidos.
É contra-indicada a administração concomitante de Claritromicina com astemizole,
cisapride, pimozide e terfenadina (Ver 4.5 - Interacções medicamentosas e outras
formas de interacção).
4.4 - Advertências e precauções especiais de utilização:
A Claritromicina é metabolizada sobretudo pelo fígado.
A claritromicina pode ser administrada sem ajustes posológicos, na presença de
insuficiência hepática, se a função renal estiver normal. Contudo, em presença de
qualquer alteração da função renal, com ou sem alteração da função hepática, terá
sempre que ser feito um ajuste posológico.
Deverá ser considerada a possibilidade de resistência cruzada entre a Claritromicina e
outros Macrólidos, assim como com a Lincomicina e Clindamicina.
Tem sido descrita colite pseudomembranosa com quase todos os fármacos
antibacterianos, incluindo os Macrólidos, que pode ser de gravidade ligeira até de
compromisso vital. Por conseguinte, é importante considerar-se este diagnóstico, em
presença de diarreia subsequente à administração de agentes antimicrobianos.
A claritromicina não deve ser administrada em associação com a ranitidina (citrato de
bismuto) em doentes com história de porfíria.
A administração concomitante de claritromicina e ranitidina (citrato de bismuto) resulta
num aumento das concentrações plasmáticas de ranitidina, num aumento das
concentrações plasmáticas de bismuto e no aumento das concentrações plasmáticas do
14-hidroxi-claritromicina.
4.5 - Interacções medicamentosas e outras formas de interacção
Dados disponíveis indicam que a Claritromicina é essencialmente metabolizada pela
isoenzima 3A (CYP3A) do citocrómio P450. O metabolismo de outros fármacos por este
sistema pode ser inibido pelo uso concomitante de Claritromicina e pode estar associado
a aumento nos níveis séricos desses fármacos.
Sabe-se ou suspeita-se que os fármacos ou classes seguintes são metabolizadas pela
isoenzima CYP3A: alprazolam, astemizole, carbamazepina, cilostazol, cisaprida,
ciclosporina, disopiramida, alcalóides de cravagem de centeio, lovastatina,
metilprednisolona, midazolam, omeprazole, anticoagulantes orais (por ex. warfarina),
pimozide, quinidina, rifabutina, sildenafil, simvastatina, tacrolimus, terfenadina,
triazolam e vimblastina. Fármacos com interacção por mecanismos semelhantes através
de outras isoenzimas no sistema do citocrómio P450 incluem a fenitoína, teofilina e
valproato.
Como acontece com outros antibióticos macrólidos, o uso da Claritromicina em doentes
que estejam a receber tratamento com fármacos metabolizados pelo sistema do
citocrómio P450 pode estar associado a aumento nos níveis séricos desses fármacos.
Raramente foi descrita rabdomiólise com a co-administração de Claritromicina e
inibidores da redutase HMG-CoA, como por exemplo a lovastatina e simvastatina.
Foram descritos níveis elevados de cisapride e de pimozide quando estes fármacos
foram administrados concomitantemente com Claritromicina, que podem resultar em
prolongamento do intervalo QT e arritmias cardíacas, incluindo taquicardia ventricular,
fibrilhação ventricular e “Torsades de Pointes”.
Resultados semelhantes foram descritos com a utilização concomitante de Macrólidos
com terfenadina e astemizole.
Foram descritos casos de Torsades de Pointes que ocorreram com o uso concomitante
de Claritromicina e quinidina ou disopiramida. Os níveis séricos destes medicamentos
devem ser monitorizados durante o tratamento com a Claritromicina.
Com a administração de Claritromicina e digoxina foram descritas concentrações
séricas elevadas de digoxina. Deverá ser considerada a monitorização dos níveis séricos
de digoxina.
A administração concomitante de Claritromicina com a zidovudina em adultos pode
resultar na redução dos níveis plasmáticos desta. Para evitar esta interacção aconselhase espaçar as doses de Claritromicina e zidovudina.
Com a administração de Claritromicina e Ritonavir poderá ser necessário reduzir a dose
de Claritromicina (Ver 4.2 - Posologia e modo de administração).
4.6 - Gravidez e aleitamento
A Claritromicina não deve ser usada em mulheres grávidas, excepto se não for possível
qualquer terapêutica alternativa. Se ocorrer uma gravidez durante a exposição a este
medicamento, a doente deve ser informada do risco potencial para o feto. Foram
demonstrados efeitos adversos no decurso da gravidez e/ou alterações no
desenvolvimento embrio-fetal de macacos, ratos, murganhos e coelhos, expostos à
Claritromicina, com níveis plasmáticos 2 a 17 vezes a dose terapêutica usada em
humanos.
A segurança da utilização da Claritromicina durante a lactação ainda não foi
estabelecida. A Claritromicina é excretada no leite materno.
4.7 - Efeitos sobre a capacidade de conduzir e utilizar máquinas
Não foram estudados os efeitos sobre a capacidade de conduzir e utilizar máquinas.
4.8 - Efeitos indesejáveis
Nos estudos clínicos realizados com a Claritromicina as reacções mais frequentemente
descritas foram de tipo gastrointestinal, nomeadamente náuseas, dispepsia, dor
abdominal, vómitos e diarreia.
Outros efeitos incluíram cefaleias, alteração no paladar e aumento transitório das
enzimas hepáticas.
Experiência pós-comercialização
Disfunção hepática, incluindo aumento nas enzimas hepáticas e hepatite colestática e/ou
hepatocelular, com ou sem icterícia, foi raramente descrita com Claritromicina. Esta
disfunção hepática pode ser grave, sendo geralmente reversível. Muito raramente foi
descrita insuficiência hepática fatal, geralmente associada a doenças subjacentes e/ou a
outros tratamentos concomitantes.
Foram descritas reacções alérgicas, desde urticária e ligeiras erupções cutâneas até
anafilaxia e Síndroma de Stevens-Johnson/necrólise tóxica epidérmica.
Foram descritos efeitos ao nível do sistema nervoso central incluindo tonturas,
vertigens, ansiedade, insónias, pesadelos, zumbidos, confusão, desorientação,
alucinações, psicose e despersonalização; no entanto, não foi estabelecida qualquer
relação de causa e efeito com o produto.
Foram descritos casos de diminuição na capacidade de audição, que geralmente é
reversível após a suspensão do tratamento. Foram também descritos casos de alteração
no sentido do olfacto, geralmente associados a alteração no paladar.
Com o tratamento com Claritromicina foram descritas glossite, estomatite, monilia oral,
alteração na cor da língua e alteração na cor dos dentes (geralmente reversível com
limpeza profissional).
Foram descritos raros casos de hipoglicemia, tendo alguns ocorrido em doentes a
receber tratamento concomitante com hipoglicémicos orais ou insulina.
Foram descritos casos isolados de trombocitopenia.
Como referido para outros macrólidos, prolongamento do intervalo QT, taquicardia
ventricular e “Torsades de Pointes” foram raramente descritos com Claritromicina.
Foram descritos casos raros de pancreatite e convulsões.
Doentes Imunocomprometidos:
Nestes doentes tratados com doses mais elevadas de Claritromicina, durante longos
períodos de tempo, é difícil distinguir entre as reacções associadas à administração do
produto e os sinais da doença por VIH ou doenças subjacentes.
Em doentes adultos nos quais se administraram doses diárias de 1000 mg de
Claritromicina foram descritas com mais frequência náuseas, vómitos, alteração no
paladar, dor abdominal, diarreia, erupções, flatulência, cefaleias, obstipação, problemas
auditivos e aumentos nas SGOT e SGPT.
Verificou-se com menor frequência o aparecimento de dispneia, insónias e secura da
boca.
4.9 - Sobredosagem:
Foi referido que a ingestão de grandes quantidades de Claritromicina pode provocar
sintomas gastrointestinais.
Caso se verifique sobredosagem, esta deve ser tratada com a eliminação do produto não
absorvido e com medidas de suporte.
Um doente com antecedentes de doença bipolar ingeriu 8 gramas de Claritromicina,
tendo apresentado estado mental alterado, comportamento paranóico, hipocalemia e
hipoxemia.
A exemplo do que acontece com outros Macrólidos, não se prevê que os níveis séricos
da Claritromicina sejam grandemente afectados pela hemodiálise ou diálise peritoneal.
5 – PROPRIEDADES FARMACOLÓGICAS
5.1 - Propriedades farmacodinâmicas
Grupo farmacoterapêutico: I-1-h) – Medicamentos anti-infecciosos. Antibacterianos.
Macrólidos.
Código ATC: J01F A09.
A Claritromicina é um antibiótico Macrólido semi-sintético obtido a partir da
substituição do grupo hidroxilo na posição 6 por um grupo CH3O no anel lactónico da
eritromicina.
Quimicamente, a Claritromicina é a 6-O-metil eritromicina A.
A Claritromicina exerce a sua acção antibacteriana pela ligação às subunidades
ribosómicas 50S das bactérias sensíveis com supressão subsequente da síntese proteica.
A Claritromicina demonstrou excelente actividade in vitro contra estirpes padrão de
bactérias e isolados clínicos. É altamente potente contra uma grande variedade de
microrganismos aeróbios e anaeróbios Gram-positivos e Gram-negativos. As
concentrações inibitórias mínimas da Claritromicina são geralmente mais potentes do
que as da eritromicina.
Os dados in vitro também indicam que a Claritromicina possui excelente actividade
contra a Legionella pneumophila, Mycoplasma pneumoniae e Helicobacter
(Campylobacter) pylori.
Os dados in vitro e in vivo revelam que este antibiótico possui actividade contra
micobactérias clinicamente importantes.
O espectro antibacteriano in vitro da Claritromicina é o seguinte:
Bactérias habitualmente sensíveis
Streptococcus agalactiae
Streptococcus pyogenes
Streptococcus viridans
Streptococcus pneumoniae
Haemohpilus influenzae
Haemophilus parainfluenzae
Neisseria gonorrheae
Listeria monocytogenes
Legionella pneumophila
Pasteurella multocida
Mycoplasma pneumoniae
Helicobacter (Campylobacter) pylori
Campylobacter jejuni
Chlamydia pneumoniae (TWAR)
Chlamydia trachomatis
Moraxella (Branhamella) catarrhalis
Bordetella pertussis
Borelia burgdorferi
Staphylococcus aureus
Clostridium perfringens
Peptococcus niger
Propionibacterium acnes
Bacteroides melaninogenicus
Mycobacterium avium
Mycobacterium leprae
Mycobacterium kansasii
Mycobacterium chelonae
Mycobacterium fortuitum
Mycobacterium intracellulare
Bactérias não-sensíveis
Enterobacteriaceae
Pseudomonas species
Um metabolito encontrado no homem, 14-hidroxi-claritromicina, possui uma
importante actividade antibacteriana. Este metabolito é igualmente activo ou 1 a 2 vezes
menos activo do que o fármaco original para a maioria dos microrganismos, excepto
para o H. influenzae, contra o qual é 2 vezes mais activo. O fármaco original e o
metabolito 14-OH exercem um efeito aditivo ou sinergístico no H. influenzae, in vitro e
in vivo, dependendo das estirpes bacterianas.
A Claritromicina revelou ser 2 a 10 vezes mais activa que a eritromicina em vários
modelos experimentais de infecção em animais. Revelou, por exemplo, ser mais eficaz
do que a eritromicina em infecções sistémicas no ratinho, abcessos subcutâneos no
ratinho e infecções do tracto respiratório no ratinho, causados S. pneumoniae, S. aureus,
S. pyogenes e H. influenzae. Em cobaias com infecção por Legionella este efeito foi
mais pronunciado; uma dose intraperitoneal de 1,6 mg/Kg/dia de Claritromicina foi
mais eficaz do que 50 mg/Kg/dia de eritromicina.
5.2 - Propriedades farmacocinéticas
A Claritromicina é rapidamente absorvida. A biodisponibilidade absoluta dos
comprimidos é de aproximadamente 50 %. Não existem indícios de acumulação e o
metabolismo não se altera após a administração de doses múltiplas. A presença de
alimentos no tracto digestivo não afecta a biodisponibilidade global do fármaco, pelo
que a Claritromicina pode ser administrada independentemente das horas das refeições.
Distribui-se adequadamente em todos os tecidos, excepto no SNC, com concentrações
tecidulares várias vezes superiores aos níveis plasmáticos. As concentrações mais
elevadas foram encontradas no pulmão e fígado nos quais a relação tecido/plasma foi de
10 a 20.
Em doses terapêuticas, a ligação às proteínas plasmáticas foi de cerca de 70 %.
As concentrações plasmáticas máximas atingem-se 2 horas após a administração da
dose.
Administrando uma dose de 250 mg cada 12 horas as concentrações plasmáticas
máximas em estado de equilíbrio obtêm-se ao 2º-3º dia e são aproximadamente 1
mcg/ml para a Claritromicina e 0,6 mcg/ml para a 14-hidroxi-Claritromicina. A semivida oscila entre 3 a 4 horas para a Claritromicina e 5 a 6 horas para o metabolito.
Metaboliza-se fundamentalmente no fígado. Após a administração de uma dose única de
250 mg, aproximadamente 38 % da dose é excretada pela via urinária e 40 % pelas
fezes.
Os estudos de farmacocinética efectuados em idosos demonstraram que qualquer efeito
observado com a administração da Claritromicina, está relacionado com a função renal
e não com a idade.
5.3 - Dados de segurança pré-clínica
Em estudos realizados em ratos e ratinhos, a dose letal média foi superior à dose
máxima administrada (5 g/kg).
Em estudos de doses repetidas, a toxicidade da Claritromicina estava relacionada com a
dose, com a duração do tratamento e com a espécie. Os principais sinais clínicos a doses
tóxicas incluem: emese, fraqueza, reduzido consumo de alimentos e ganho de peso,
salivação, desidratação e hiperactividade. Em todas as espécies, o principal órgão alvo a
doses tóxicas foi o fígado. A hepatotoxicidade foi detectável por aumentos rápidos nos
testes da função hepática. A descontinuação da terapêutica resulta geralmente no retorno
ou na aproximação aos resultados normais. Outros tecidos menos afectados incluem o
estômago, o timo, outros tecidos linfoides e os rins. A doses próximas das terapêuticas,
apenas ocorreu lacrimação em cães. Á dose massiva de 400 mg/kg/dia, alguns cães e
macacos desenvolveram opacidade corneal e/ou edema.
Não se observou qualquer evidência de potencial mutagénico da Claritromicina durante
uma série de estudos in vitro e in vivo.
Os estudos de fertilidade e reprodução em ratos não revelaram quaisquer efeitos
adversos. Os estudos de teratogenicidade em ratos Wistar (p.o.) e Sprague-Dawley (p.o.
e i.v.), coelhos brancos New Zealand e macacos cinomolgos não demonstraram
qualquer teratogenicidade pela Claritromicina. No entanto, um estudo posterior
semelhante em ratos Sprague-Dawley revelou uma incidência baixa de anomalias
cardiovasculares (6 %) que pareciam ser devido a expressão espontânea das alterações
genéticas. Dois estudos efectuados em ratinhos revelaram uma incidência variável (3-30
%) de fenda palatina e em macacos observou-se perda de embriões, mas apenas em
níveis de dose que eram nitidamente tóxicos para as mães.
Não foram descritos resultados toxicológicos considerados relevantes para o nível de
dose recomendado para tratamento no homem.
6 – INFORMAÇÕES FARMACÊUTICAS
6.1 - Lista de excipientes
Excipientes do núcleo:
Amido pré-gelatinizado;
Celulose microcristalina;
Croscarmelose sódica;
Estearato de magnésio;
Povidona 25;
Sílica coloidal anidra.
Excipientes do revestimento:
Dióxido de titânio (E-171);
Hidroxipropilmetilcelulose;
Propilenoglicol;
Talco.
6.2 - Incompatibilidades
Não aplicável.
6.3 - Prazo de Validade
2 anos.
6.4 - Precauções especiais de conservação
Conservar os comprimidos a temperaturas inferiores a 30ºC, em local seco e ao abrigo
da luz.
6.5 - Natureza e conteúdo do recipiente
CLARITROMICINA AZEVEDOS 250 mg comprimidos:
Embalagens contendo 10, 12, 20 e 30 comprimidos revestidos por película
acondicionados em blisters de PVC/Alumínio.
CLARITROMICINA AZEVEDOS 500 mg comprimidos:
Embalagens contendo 10, 12, 20 e 30 comprimidos revestidos por película
acondicionados em blisters de PVC/Alumínio.
6.6 - Instruções de utilização e de manipulação
Não existem requisitos especiais.
7 – TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
Laboratórios Azevedos-Indústria Farmacêutica, S.A.
Estrada Nacional 117-2
Alfragide
2614-503 AMADORA
8 – NÚMEROS DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
CLARITROMICINA AZEVEDOS 250 mg comprimidos:
4805396 – Embalagem de 10 comprimidos
4805495 – Embalagem de 12 comprimidos
5538392 – Embalagem de 16 comprimidos
4805594 – Embalagem de 20 comprimidos
4805693 – Embalagem de 30 comprimidos
CLARITROMICINA AZEVEDOS 500 mg comprimidos:
4805792 – Embalagem de 10 comprimidos
4805891 – Embalagem de 12 comprimidos
5538491 – Embalagem de 16 comprimidos
4805990 – Embalagem de 20 comprimidos
4806097 – Embalagem de 30 comprimidos
9
–
DATA
DA
PRIMEIRA
AUTORIZAÇÃO/RENOVAÇÃO
AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
03/10/2003
10 – DATA DA REVISÃO DO TEXTO
Maio 2009
DA