Universidade Federal de Ouro Preto
Compostos Carbonílicos I
(Ácidos carboxílicos e seus derivados)
Aula 2
Flaviane Francisco Hilário
1
1 – Haletos de acila
1.1 - Preparação
2
• O objetivo é converter o grupo OH em um bom grupo
abandonador para que o nucleófilo (cloreto ou brometo) seja
capaz de deslocá-lo.
3
1.2 - Reatividade
• Cloretos de acila são mais estáveis que brometos e iodetos.
• Cloretos de ácidos são facilmente convertidos em compostos
menos reativos.
4
5
Cloreto de propanoíla
Propanoato de fenila
H3O+
Cloreto de butanoíla
Cloreto de feniletanoíla
Ácido butanóico
N-metilfeniletanamida
6
Mecanismo para conversão de cloreto de acila em anidrido
7
Mecanismo de conversão de cloreto de acila em éster
HOCH3
8
Formação de amidas a partir de haletos de acila
• Aminas terciárias não podem formar amidas.
9
Discussão:
• Duas amidas podem ser obtidas a partir da reação do
cloreto de acetila com uma mistura de etilamina e
propilamina.
N-etilacetamida
N-propilacetamida
• Somente uma amida é obtida da reação do cloreto de acetila
com uma mistura de etilamina e piridina. Por que?
10
• Por que aminas terciárias não formam amidas?
11
Piridina
12
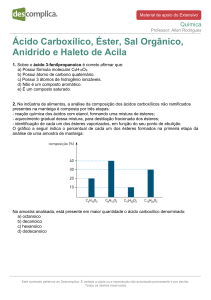
Exercício
Prediga qual produto é formado na reação do cloreto de
benzoíla com:
a)
b)
c)
d)
e)
f)
Ácido acético (em presença de piridina)
Ácido benzóico (em presença de piridina)
Etanol
Metilamina
Dimetilamina
Água
13
Explique porque a hidrólise do cloreto de benzoíla é cerca de
mil vezes mais rápida que a do cloreto de benzila:
O
Cl
cloreto de benzoíla
Cl
cloreto de benzilat
14
2 – Anidridos
2.1 - Preparação
• Pode-se preparar anidridos mistos ou simétricos.
15
• Anidridos cíclicos (anel de 5 ou 6 membros) a partir do
simples aquecimento de ácidos dicarboxílicos.
ácido ftálico
anidrido ftálico
16
2.2 - Reatividade
• Anidridos são muito reativos e podem ser usados para
preparar ésteres e amidas.
17
18
Não reage
19
Mecanismo para a conversão de anidrido em éster (e ácido
carboxílico)
CH3OH2+
20
3 – Ésteres
3.1 - Preparação
Cloreto de propanoíla
Propanoato de fenila
21
Esterificação de Fischer
22
Mecanismo da esterificação de Fischer
23
Preparação de Lactonas
24
3.2 - Reatividade
3.2.1 - Hidrólise:
1. Catalisada por ácido
2. Promovida por base
H3O+
Acetato de metila
Ácido acético
25
1. Hidrólise de ésteres catalisada por ácido
H3O+
H2O
26
Como o ácido catalisa a hidrólise?
• Protonação
no
oxigênio
carbonílico
aumenta
suceptibilidade do carbono ao ataque nucleofílico.
Mais suceptível
a
Menos suceptível
• Intermediário tetraédrico
27
Mecanismo para hidrólise de éster catalisada por ácido
+H3O+
- H3O+
Intermediário tetraédrico I
+H3O+
- H3O+
- H3O+
+H3O+
- H3O+
+H3O+
Intermediário tetraédrico II
28
• Ésteres com grupos alquila terciários sofrem hidrólise mais
rapidamente que outros.
29
2. Hidrólise de ésteres promovida pelo íon hidróxido
• O íon hidróxido aumenta a velocidade de formação do
intermediário tetraédrico.
Esta reação não é reversível
Como o íon hidróxido promove a hidrólise?
30
Evidências do mecanismo de reação
Mecanismo de reação (Bender)
Evidência da formação do
intermediário tetraédrico
31
Mecanismo de reação (Kursanov)
32
Triésteres de glicerol
sabões
O
O
(CH2)16CH3
O
(CH2)14CH3
O
O
Na+ -O
O
(CH2)18CH3
H2O
NaOH
D
OH
OH
Na+ -O
OH
(CH2)14CH3
O
+-
Na O
O
Graxa
(CH2)16CH3
Glicerol
(CH2)18CH3
O
Sais de ácidos graxos
33
Triésteres de glicerol
sabões
Parte lipofílica
Parte
hidrofílica
Contra-íon
Sabões mais comuns
34
3.2.2 - Transesterificação
1. Catalisada por ácido
2. Promovida por base (RO-)
Acetato de metila
Álcool propílico
Acetato de propila
Álcool metílico
em excesso
H3O+
Benzoato de metila
Benzoato de etila
35
3.2.3 - Aminólise
Propanoato de etila
N-metil propanamida
3.2.4 - Tioésteres - Mecanismo semelhante ao dos ésteres.
36
Discussão:
De acordo com os dados apresentados abaixo, explique
porque o acetato de fenila é mais reativo que o acetato de
metila em uma reação de SN à carbonila.
É mais reativo que
Acetato de metila
Acetato de fenila
37
4 - Ácidos carboxílicos
4.1 – Preparação
- Oxidação de alcenos com permanganato de potássio em
meio básico
38
39
- Oxidação de alquilbenzenos
potássio em meio básico
com permanganato de
40
- Oxidação de aldeídos e álcoois primários
41
álcool
aldeído
ácido carboxílico
42
- A partir de reagentes organometálicos, via carbonatação
Reagente de
Grignard
43
4.2 - Reatividade
•
Ver métodos de obtenção de cloretos de acila, anidridos e ésteres.
•
Ácidos carboxílicos não sofrem substituição nucleofílica com aminas.
Carboxilato de
amônio
Carboxilato de amônio
44
•
Reação com amônia
45
5 - Amidas
5.1 – Preparação
- Ver reatividade de cloretos de acila, anidridos, ésteres e ácidos
carboxílicos.
46
5.2 – Reatividade
- O derivado menos reativo dos ácidos carboxílicos.
Não reage
Não reage
Não reage
Não reage
47
H3O+
N-etiletanamida
N-metilbenzamida
48
Mecanismo da hidrólise ácida de amida
Intermediário tetraédrico I
Intermediário tetraédrico II
Intermediário tetraédrico III
49
• Uma amida não sofre hidrólise sem catálise.
• Uma catálise
abandonador.
ácida
pode
Intermediário tetraédrico com
catálise ácida
tornar
um
grupo
melhor
Intermediário tetraédrico sem
catálise ácida
50
6 - Bibliografia
SOLOMONS, G.; FRYHLE, C. Química Orgânica, vol. 2, 7.ed. Rio de Janeiro: LTC,
2001. 474p.
BRUICE, P. Química Orgânica, vol. 2, 4.ed. São Paulo: Pearson, 2006. 641p.
51