Cinética Química
Professora (Estagiária): Magda Vieira
Professora Supervisora: Kátia Aquino
Profa. Kátia Aquino
1
As reações também possuem
suas velocidades próprias
Muito rápida: combustão
http://www.franciscoevangelista.com/2012/07/incendio-residencial-com-vitima-fatal.html
Muito lenta: Petróleo
http://maisquecuriosidade.blogspot.com.br/2010/05/coisas-que-voce-nao-sabia-sobre-o.html
2
Cinética Química
É a área da química que estuda a velocidade
das reações e os fatores que a influencia,
tais como:
•• CONCENTRAÇÃO
CONCENTRAÇÃODOS
DOSREAGENTES;
REAGENTES;
••SUPERFÍCIE
SUPERFÍCIEDE
DECONTATO;
CONTATO;
••TEMPERATURA;
TEMPERATURA;
••CATALISADORES/INIBIDORES;
CATALISADORES/INIBIDORES;
3
Observe:
http://www.alunosonline.com.br/quimica/cinetica-quimica.html
4
Exemplo de reação
Br2(aq) + HCOOH (aq) → 2Br-(aq) + 2H+(aq) + CO2 (g)
tempo
A cor avermelhada do primeiro becker é por conta do
bromo. Com o passar do tempo a concentração de bromo
diminui e é observada a perda de cor do sistema.
http://quimica2univia.files.wordpress.com/2012/04/clase17.jpg?w=640
5
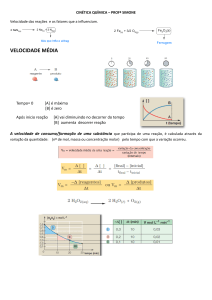
Velocidade média de um
componente da reação (Vm)
Variação da quantidade de um reagente
ou produto em uma reação química num
intervalo de tempo.
Δm
Δn
ΔV
ΔC
v m=
ou
ou
ou
Δt
Δt
Δt
Δt
m = massa, n = no mols, V = volume, C = concentração
molar
Para a reação:
A→ B
Δ[ A] Δ[ B ]
Velocidade média =−
=
Δt
Δt
6
Velocidade média
da reação (Vm)
Uma reação apresenta uma reação média que pode ser
obtida pela divisão da velocidade de cada componente da
reação química pelo respectivo coeficiente estequiométrico.
Exemplo geral:
aA + bB → cC + dD
∆[B] = ∆[C] = ∆[D]
Vm = -∆[A] = --∆[B]
a∆t
b∆t
c∆t
d∆t
7
Comportamento
gráfico
C4H9Cl(aq) + OH- (aq) C4H9OH (aq) + Cl- (aq)
Tempo
(s)
[C4H9Cl]
(M)
0
0,1000
50
0,0905
100
0,0820
150
0,0741
8
Velocidade
instantânea (Vi)
ÉÉ aa variação
variação na
na quantidade
quantidade de
de um
um
reagente
reagente ou
ou produto
produto num
num instante,
instante, ou
ou
seja,
seja, no
no menor
menor intervalo
intervalo de
de tempo
tempo que
que
se
se possa
possa imaginar.
imaginar.
9
Como calcular Vi?
A velocidade instantânea (Vi) pode
ser obtida através da declividade da
reta tangente à curva do gráfico
concentração vs. tempo em um
determinado instante..
Não esqueça que a declividade
da reta (m) pode ser obtida
No gráfico por:
m=(y-yo)/(x-xo )
Escolha seus pontos!
Exemplo t=0s:
C4H9Cl(aq) + OH- (aq) C4H9OH (aq) + Cl- (aq)
Velocidade
instantânea em t=0s
Vi = - (0,060 – 0,100) M
(200 – 0)
Vi = 2,0 x 10- 4 M/s
11
Exemplo em t=600s:
C4H9Cl(aq) + OH- (aq) C4H9OH (aq) + Cl- (aq)
Velocidade instantânea em
t=600s
Vi = - (0,017- 0,042) M
(800 – 400) s
Vi = 6,2 x 10- 5 M/s
12
NATUREZA DOS REAGENTES
Condições para que
uma reação ocorra
COLISÃO ENTRE AS MOLÉCULAS
ORIENTAÇÃO FAVORÁVEL
ENERGIA MÍNIMA
importante
REAÇÃO QUÍMICA
13
COLISÃO ENTRE AS MOLÉCULAS
Teoria da Colisões
SE BASEIA NO MODELO CINÉTICO DOS GASES
UMA REAÇÃO É UM FENÔMENO PROBABILÍSTICO
1- OS REAGENTES SE ENCONTRAM;
2- O ENCONTRO DE DUAS MOLÉCULAS
CORRESPONDE A UMA COLISÃO;
3- AS MOLÉCULAS PODEM ( DEPENDENDO DA ENERGIA):
• COLIDIR E SEPARAR
• COLIDIR, ROMPER LIGAÇÕES E FORMAR NOVAS LIGAÇÕES
4- FREQUÊNCIA COM QUE AS MOLÉCULAS COLIDEM
5- FRAÇÃO DAS COLISÕES QUE APRESENTAM UMA ENERGIA
MÍNIMA
14
ORIENTAÇÃO FAVORÁVEL
Para que uma reação aconteça é necessário que as
moléculas dos reagentes colidam com a orientação correta.
http://www.brasilescola.com/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm
15
ENERGIA MÍNIMA
Em 1888, o químico sueco Svante Arrhenius
sugeriu que as moléculas deviam possuir uma
energia mínima para que pudessem reagir.
No modelo da colisão, a energia na colisão provém
da energia cinética das moléculas colidentes.
Em cada colisão, esta energia pode provocar:
• ESTIRAMENTO
• FLEXÃO
• TORÇÃO
• ROMPIMENTO
Fonte:
http://www.magnet.fsu.edu/education/t
utorials/pioneers/arrhenius.html
Para que a reação aconteça, as moléculas devem apresentar uma
energia cinética superior ou igual a um certo mínimo. Essa energia
mínima é denominada de Energia de Ativação.
16
Energia de ativação
e os gráficos
Reação endotérmica
Fonte: http://www.agracadaquimica.com.br/index.php?
&ds=1&acao=quimica/ms2&i=22&id=587
Reação exotérmica
Ea = Ecomplexo ativado – E Reagentes
17
Fatores que influenciam
na velocidade de uma reação
TEMPERATURA
ESTADO FÍSICO DOS REAGENTES
SUPERFÍCIE DE CONTATO
CATALISADORES/ INIBIDORES
CONCENTRAÇÃO DOS
REAGENTES
18
TEMPERATURA
TEMPERATURA
Para
Para aa maioria
maioria das
das reações
reações aa
velocidade
velocidade aumenta
aumenta com
com um
um
ENERGIA
CINÉTICA
aumento
aumentoda
datemperatura.
temperatura.
CHOQUES
VELOCIDADE
19
Regra de Van't Hoff
Um
Um aumento
aumento de
de 10ºC
10ºC faz
faz com
com que
que aa
velocidade
velocidade da
da reação
reação dobre.
dobre.
Cuidado, pois
esta regra possui
limitações, ou
seja, não é
sempre válida.
Temperatura
5ºC
15ºC
25ºC
Velocidade
V
2V
4V
20
ESTADO FÍSICO DOS REAGENTES
Quanto maior o estado entrópico dos reagentes,
mais rápida será a reação.
Substâncias que estão no estado líquido tende a reagir mais
rapidamente se as mesmas estiverem no estado sólido.
Por estarem mais livres, há maior probabilidade de choques
entre as moléculas.
SUPERFÍCIE DE CONTATO
http://educacao.uol.com.br/quimica/cinetica-quimica-1-fatores-que-interferem-na-velocidade-das-reacoes.jhtm
22
Quem oxidaria
mais
rapidamente?
http://www.roboticasimples.com/artigos.php?acao=10
23
CATALISADORES/ INIBIDORES
São
São substâncias
substâncias que,
que, quando
quando presentes,
presentes,
aumentam
aumentam (catalisador)
(catalisador) ou
ou diminuem
diminuem
(inibidor)
(inibidor) aa velocidade
velocidade das
das reações
reações
químicas,
químicas, sem
sem serem
serem consumidos.
consumidos.
Os
Os catalisadores/inibidores
catalisadores/inibidores encontram
encontram “caminhos
“caminhos
alternativos”
alternativos” ou
ou seja,
seja, outra
outra rota
rota reacional
reacional que
que
apresenta
apresenta uma
uma menor
menor energia
energia de
de ativação
ativação
(catalisador)
(catalisador) ou
ou maior
maior energia
energia de
de ativação
ativação
(inibidor).
(inibidor).
Catalisador e a Energia
de ativação
Fonte: Química Geral – Fundamentos/ Daltamir Justino Maia e J.C. Bianchi. – São Paulo: Pearson
Prentice Hall, 2007)
• Atuam propiciando uma rota alternativa ;
• A variação de entalpia é a mesma, independente do caminho;
• O catalisador não elimina o caminho A da reação, mas possibilita um caminho B;
• Como o novo caminho envolve energias menores, praticamente toda reação ocorre por
este caminho.
Catálise homogênea
• O catalisador se encontra na mesma fase dos reagentes.
Exemplo: Decomposição da água oxigenada H2O2
(aq)
pelo I- (aq) :
H2O2 + I- H2O + IOH2O2 + IO- H2O + O2 + I2H2O2
I-
2H2O + O2
Água oxigenada+sabão+catalisador
http://www.emdialogo.uff.br/node/3234
Catálise heterogênea
os catalisadores automotivos
• O catalisador não está na mesma fase que os reagentes.
http://www.mundoeducacao.com.br/quimica/catalise-heterogenea.htm
Catálise enzimática
• Enzimas são proteínas com um ou mais sítios ativos tipo cavidade,
onde a reação ocorre;
• São catalisadores biológicos que funcionam modificando moléculas
de substrato para promover reações.
http://www.mundoeducacao.com.br/biologia/enzimas.htm
Autocatálise
• É uma reação onde os produtos da reação agem como catalisador
da própria reação;
• A reação é cada vez mais rápida à medida que esta vai progredindo;
3 Cu(s) + 8 HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l)
catalisador
http://www.mundoeducacao.com.br/quimica/autocatalise.htm
CONCENTRAÇÃO DOS
REAGENTES
http://www.marco.eng.br/cinetica/trabalhodealunos/CineticaBasica/influencia.html
30
Concentração x velocidade
AA velocidade
velocidade da
da reação
reação diminui
diminui com
com oo
passar
passar do
do tempo.
tempo.
AA velocidade
velocidade da
da reação
reação diminui
diminui quando
quando as
as
concentrações
concentrações dos
dos reagentes
reagentes diminuem.
diminuem.
Os
Os dados
dados cinéticos
cinéticos são
são geralmente
geralmente obtidos
obtidos aa partir
partir
da
da velocidade
velocidade inicial
inicial da
da reação.
reação.
Lei da velocidade
reação elementar
Dado a REAÇÃO ELEMENTAR abaixo:
aA
+ bB
cC +
dD
A lei de velocidade será dada por::
V = K[A]a. [B]b
a e b são os expoentes de A e B,
que correspondem aos coeficientes
estequiométricos da reação.
Fonte:
http://en.wikipedia.org/wiki/Cato_Maximilian_Guldberg
A lei de velocidade das reações (ou lei de
Guldberg –Waage) foi proposta em 1867
pelos cientistas noruegueses Cato
Maximilian Guldberg (1836-1902) e Peter
Waage (1833-1900)
“ “AAvelocidade
velocidadede
deuma
umareação
reaçãoquímica
química
elementar,
elementar,aauma
umadada
dadatemperatura,
temperatura,éé
diretamente
diretamenteproporcional
proporcionalao
aoproduto
produtodas
das
concentrações
dos
reagentes,
em
mol/L,
concentrações dos reagentes, em mol/L,
elevadas
elevadasaos
aosseus
seusrespectivos
respectivos
coeficientes
coeficientesestequiométricos.”
estequiométricos.”
Reação
Reaçãoelementar:
elementar:
Ocorre
Ocorreem
emuma
umaúnica
únicaetapa;
etapa;
Não
Nãohá
háformação
formaçãode
deintermediários;
intermediários;
Os
Osprodutos
produtosse
seformam
formamdiretamente
diretamenteda
dacolisão
colisãodos
dosreagentes;
reagentes;
AA lei
lei de
de velocidade
velocidade apresenta
apresenta os
os expoentes
expoentes iguais
iguais aos
aos coeficientes
coeficientes da
da
reação.
reação.
REAÇÕES ELEMENTARES GERAIS
Exemplos
Molecularidade
Lei de Velocidade
A produtos
Unimolecular
V=K[A]
2A produtos
Bimolecular
V=K[A]2
A + B
produtos
Bimolecular
V=K[A] [B]
Reação não elementar
Reação
Reaçãonão
nãoelementar:
elementar:
Ocorrem
Ocorrem em
em um
um conjunto
conjunto de
de etapas,
etapas, chamado
chamado mecanismo
mecanismo de
de
reação.
reação.
Mecanismo
Mecanismode
dereação:
reação:
Cada
Cadaetapa
etapaééuma
umareação
reaçãoelementar;
elementar;
Na
Na soma
soma algébrica
algébrica das
das etapas,
etapas, os
os compostos
compostos
intermediários
intermediáriosdesaparecem
desaparecemna
nareação
reaçãoglobal;
global;
A velocidade da reação não elementar depende
apenas da etapa lenta
Lei das velocidades
Reação não elementar
Reação genérica:
2A
2A ++ 3B
3B ++ CC
Produtos
Produtos
Experimento
[A]0(mol/L)
Velocidade inicial da
reação (mol/L.min)
I
1
0,02
II
2
0,04
III
4
0,08
Reação genérica:
Experimento
2A
2A ++ 3B
3B ++ CC
Produtos
Produtos
[B]0(mol/L)
Velocidade inicial da
reação (mol/L.min)
I
1
0,02
II
2
0,08
III
4
0,32
Reação genérica:
2A
2A ++ 3B
3B ++ CC
Produtos
Produtos
Experimento
[C]0(mol/L)
Velocidade inicial da
reação (mol/L.min)
I
1
0,02
II
2
0,02
III
4
0,02
Concluindo...
Reação genérica anterior
2A
2A ++ 3B
3B ++ CC
Produtos
Produtos
QUAL A LEI DE VELOCIDADE QUE PODEMOS PROPOR?
V
V == K[A]
K[A] [B]
[B] 22
Vamos
exercitar!
Qual a lei de velocidade da reação que ocorre segundo o
mecanismo a seguir?
Etapa 1: NO2 (g) + NO2(g) NO3(g) + NO(g)
(lenta)
Etapa 2: NO3(g) + CO (g) NO2(g) + CO2(g)
(rápida)
Global: NO2(g) + CO (g) NO(g) + CO2(g)
Ordem de uma reação
Ordem
Ordem de
de reação
reação (ordem
(ordem global)
global) éé aa soma
soma dos
dos valores
valores das
das
potências
potências aa que
que as
as concentrações
concentrações de
de reagentes
reagentes se
se encontram
encontram
elevadas
elevadasna
naequação
equaçãocinética
cinéticada
dareação
reação(lei
(leide
develocidade).
velocidade).
Consideremos a reação geral:
aA + bB → cC + dD
A equação da velocidade assume a forma:
Velocidade = k[A]α [B]β
α, β,k – determinados experimentalmente
α e β– ordem de uma reação; α é a ordem de A e β é a ordem de B.
A reação tem ordem global α + β
Uma reação é de:
Ordem zero em relação a um reagente: se a alteração da
concentração desse reagente não causa alteração na velocidade;
Primeira ordem em relação a um reagente: se duplicar a
concentração, duplica a velocidade da reação também;
Ordem n em relação a um reagente: se duplicar a concentração
aumenta de 2n a velocidade da reação.
Reação de ordem zero
Reações de ordem zero são raras;
(A)
A equação cinética é:
velocidade = k[A]0
ou
(B)
v=k
A velocidade de uma reação de ordem zero é
constante e independente das concentrações de
reagentes.
= N2O
22NN2O(g)
2N22(g)
(em platina aquecida)
(g)++OO2(g)
2O(g) 2N
2(g) (em platina aquecida)
Obs.:
Obs.:AAconcentração
concentraçãomolar
molaréémaior
maiorem
emB,
B,mas
masisso
issonão
nãoafeta
afeta
aavelocidade
velocidadeda
dareação,
reação,pois
poisaasuperfície
superfícieda
daplatina
platinapode
pode
adsorver
adsorverum
umdeterminado
determinadonúmero
númerode
demoléculas.
moléculas.
A equação concentração x tempo
É obtida da integração (cálculo integral, que é visto no
ensino superior) da equação da lei de velocidade.
Matemáticamente temos:
[A] = [A]0 – k t
Graficamente:
k=declividade
da reta
Reação de ordem 1
Numa reação de primeira ordem a velocidade depende da
concentração de reagente elevada à potência unitária.
AA
Produtos
Produtos
v=k[A]
a) Diminuição da concentração do reagente com o
tempo.
45
AA
Produtos
Produtos
Δ[ A]
velocidade=−
Δt
velocidade=k [ A ]
⇔ ln [ A ] =ln [ A ]0 −kt
(equação da reta)
b) Utilização da representação
gráfica da relação linear de ln[A] em
função do tempo
para calcular a
constante de velocidade.
46
Tempo de meia vida (T1/2): Reação
de primeira ordem
Tempo de de meia-vida (t1/2): é o tempo necessário para que a concentração
de uma reagente diminua para metade do seu valor inicial.
Variação da concentração
de um reagente com o número
de tempos de meia vida (t1/2)
para uma reação de primeira
ordem.
t=t1/2
[A] = [A]0/2
[ A ]0
1
1
0,693
t 1/ 2 = ln
⇔t 1/ 2 = ln2 ⇔ t 1/ 2 =
k [ A ]0/ 2
k
k
47
Reação de ordem 2
É a reação cuja velocidade depende da concentração de
reagente elevada ao quadrado ou de concentrações de dois
reagentes diferentes, cada um deles elevada à unidade.
A → produto
Δ [ A]
velocidade=−
Δt
2
velocidade=k [ A ]
1
1
⇔
=
+kt
[ A ] [ A0 ]
(equação da reta)
48
Tempo de meia vida (T1/2): Reação
de segunda ordem
Podemos obter uma equação para
o tempo de meia-vida da reação
de 2ª ordem, se fizermos
[A] = [A]0/2 na equação:
1
1
=
+kt
[ A ] [ A ]0
1
[ A ] 0 /2
=
1
1
+kt 1/2 ⇔t 1/2 =
k [ A ]0
[ A ]0
Resumindo...
Ordem
0
1
Equação Cinética
Equação
Concentração x
Tempo
Velocidade =k
Velocidade = k [A]
[A] = [A]0 - kt
ln[A] = ln[A]0 - kt
1
2
Velocidade = k [A]2
[A]
=
1
[A]0
+ kt
Tempo de Meia
Vida
t½ =
t½ =
t½ =
[A]0
2k
ln2
k
1
k[A]0
Aprofunde
seus
conhecimentos
Equação de Arrhenius
Como
Comoaatemperatura
temperaturaeeaavelocidade
velocidadede
dereação
reaçãoestão
estãodiretamente
diretamenteligadas,
ligadas,
elas
elaspodem
podemestar
estarrelacionadas
relacionadaspela
pelaequação
equaçãode
deArrhenius.
Arrhenius.
kk == Ae
Ae
-Ea/RT
-Ea/RT
Onde:
• k é a constante da velocidade
• Ea é a energia de ativação
• R é a constante dos gases (8,314 J/mol.K)
• A é uma “constante” relacionada com a frequência das colisões
• T é a temperatura em Kelvin
51
Cálculo da Energia Energia de ativação
com a utilização gráfica
Ea
k=Ae
⇔ ln k= −
R
E a ( kJ/mol )
R = 8,314 J/K . mol
− Ea/ RT
(
)( )
1
+ln A
T
52
Questão 1
Vamos
exercitar!
Em uma dada temperatura, a decomposição do N2O3 em
NO2 e NO é de primeira ordem, com K = 3,2x10-4 s-1.
Considerando que a concentração inicial de N2O3 é de 10 M,
quanto tempo levará para que essa concentração seja
reduzida para 2 M? Qual o tempo de meia vida dessa
reação?
Questão 2
Vamos
exercitar!
A sacarose (C12H22O11) se decompõe em glicose e frutose em
solução ácida. A velocidade da reação é dada por:
V = k[sacarose].
Sabendo que K = 0,208 h-1 a 25ºC, qual o tempo necessário para
que 87,5% da concentração inicial de sacarose reaja nessa
temperatura?
Bons estudos!!!