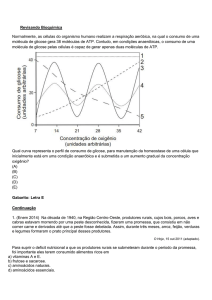
VIA DAS PENTOSES-FOSFATO:
A via das pentoses-fosfato, ou mais simplesmente via das pentoses, é
uma via alternativa de oxidação de glicose-6-fosfato, que leva à produção de 3
compostos, a ribulose-5-fosfato, CO2 e o NADPH.
Para realizar o seu anabolismo, a célula não precisa apenas de energia (ATP):
também precisa de poder redutor, sob a forma de NADPH. O NADPH é
produzido durante a oxidação da glucose-6-P por uma via distinta da glicólise,
a via das pentoses-fosfato. Esta via é muito activa em tecidos envolvidos na
biossíntese de colesterol e de ácidos gordos (fígado, tecido adiposo, cortex
adrenal, glândulas mamárias). Esta via também produz ribose-5-P, o açúcar
constituinte dos ácidos nucleicos.
A ribose-5-fosfato é a pentose constituinte dos nucleotídeos, que vão
compor os ácidos nucleicos, e de muitas coenzimas, como o ATP,
NADH, FADH2 e coenzima A.
Na via das pentoses são produzidos vários açúcares fosforilados, com um
número variável de átomos de carbono. A energia vinda da oxidação da glicose
é armazenada sob a forma de NADPH e não de ATP, como na glicólise.A via
das pentoses fosfato compreende uma etapa inicial que é oxidativa, na qual a
glicose-6-fosfato é convertida a ribose-5-fosfato e gás carbónico por duas
oxidações intercaladas por uma reação de hidrólise.
A etapa oxidativa ocorre no sentido da conversão de NADP a NADPH. A
etapa seguinte, que não é oxidativa, vai transformar a ribulose-5-fosfato em
ribose-5-fosfato pela ação de uma isomerase. Esta pentose sofre em seguida
conversões e gera açúcares fosforilados com números variados de átomos de
carbono. Todas as etapas não-oxidativas são reversíveis, o que permite que
haja interconversão entre os diferentes açúcares.
Assim como a glicólise a via das pentoses ocorre no citosol; e elas estão
relacionadas por intermediários comuns que são a glicose-6-fosfato, frutose-6fosfato e o gliceraldeído-3-fosfato. Esse compartilhamento de intermediários e
a interconversibilidade permite que esta seja uma via de integração entre várias
linhas metabólicas.
Regulação da via das pentoses
A atividade da via das pentoses vai variar de acordo com tecido, sendo mais
intensa em tecidos que ativam ácidos graxos ativamente, como é o caso do
fígado e do tecido adiposo. As duas desidrogenases que participam da via
convertem NADP a NADPH e vão ser inibidas competitivamente por NADPH.
A utilização da glicose-6-fosfato pela via das pentoses ou pela glicólise vai
depender das relações ATP/ADP e NADPH/NADP existentes nas células.
Quando a relação ATP/ADP é baixa, a glicose vai ser degradada pela
via glicolítica, produzindo ATP; não vai ocorrer a síntese de ácidos
gordos e a relação NADPH/NADP é alta, inibindo a via das pentoses.
Mas se a relação ATP/ADP é alta, a via glicolítica fica inibida e a síntese
de ácidos gordos é favorecida, consumindo NADPH e eliminando a
inibição das desidrogenases.
Portanto quando a carga energética das células é alta, o consumo de glicose-6fosfato pela via das pentoses é favorecida.
A via das pentoses é ativa quando as taxas glicémicas são altas; os níveis altos
de insulina resultantes acarretam, no tecido adiposo, aumento da
permeabilidade à glicose e, no fígado, intensa síntese de glicocinase. Essas
duas condições propiciam a síntese de ácidos gordos, que também é
estimulada pela insulina.
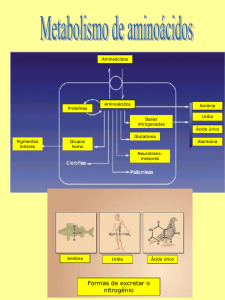
Metabolismo de aminoácidos:
No ser humano a maioria dos aminoácidos são obtidos da dieta. A
relação entre a quantidade de nitrogênio ingerida diariamente e a quantidade
que é excretada expressa o balanço diário de nitrogênio. Quando a quantidade
de nitrogênio excretada é maior do que a quantidade ingerida diz-se que o
balanço é negativo. O balanço positivo de nitrogênio ocorre com mais
freqüência na criança em crescimento, mas pode ocorrer na senescência ou
em indivíduos com uma dieta deficiente em um aminoácido essencial. O ser
humano pode sintetizar apenas 11 dos 20 aminoácidos necessários para a
síntese de proteínas. Aqueles aminoácidos que não podem ser sintetizados
são
considerados
aminoácidos
essenciais(Histidina,Isoleucina,
Leucina,Metionina, Fenilalanina, Treonina; são exemplos de aminoácidos
essenciais). Dependendo do destino destes aminoácidos, eles podem ser
classificados como aminoácidos glicogênicos (quando participam da
gliconeogênese), cetogênicos (quando geram corpos cetônicos) e glicocetogênicos (quando a rota metabólica leva à formação de glicose e de corpos
cetônicos).
Aminotransferases:
Quando necessário, pode ocorrer a transferência do grupo amino de um
aminoácido para um alfa-cetoácido gerando um outro aminoácido e o alfacetoácido correspondente. Essa reação é catalisada pelas aminotransferases,
também conhecidas como transaminases. Para cada aminoácido existe uma
aminotransferase correspondente. A determinação dos níveis séricos das
transaminases glutâmico pirúvica (TGP) e glutâmico oxaloacética (TGO) é um
dado diagnóstico utilizado rotineiramente na confirmação de problemas
cardíacos ou hepáticos. A concentração dessas enzimas no plasma é baixo.
No entanto, quando ocorre rompimento de tecido - no enfarto do miocárdio, p.e.
- a concentração plasmática aumenta, denunciando a lesão.
Estas enzimas têm como coenzima o piridoxal fosfato e transferem o
grupamento amino de um aminoácido (alanina, na figura) para o alfacetoglutarato gerando glutamato e o alfa-cetoácido (piruvato, na figura)
derivado do aminoácido que perdeu o grupamento amino. Essa reação é
necessária uma vez que a amônia não pode participar do ciclo da uréia
diretamente a partir de qualquer aminoácido, mas pode ser doada pelo
glutamato. A reação inversa ocorre quando há necessidade de um determinado
aminoácido para a síntese de proteina.
O piridoxal fosfato liga-se às transaminases através de uma ligação aldimina
com um resíduo de lisina da cadeia polipeptídica da enzima. Glutamato
desidrogenase: No fígado, essa enzima está localizada na mitocôndria, onde
têm início as reações do ciclo da uréia. A enzima catalisa a incorporação de
amônia, como grupo amino, no alfa-cetoglutarato gerando glutamato e utiliza
NADPH como coenzima, envolvendo consumo de ATP. A reação reversa é
catalisada pela mesma enzima utilizando NAD como coenzima. Amônia livre é
tóxica e é, preferencialmente, transportada no sangue, na forma de grupos
amino ou amida, incorporados em aminoácidos. Glutamina representa
cinqüenta por cento desses aminoácidos circulantes.A produção de glutamina é
catalisada pela glutamina sintetase utiliza glutamato e amônia como substrato.
A remoção da amônia - na reação reversa - é feita pela glutaminase.
Ciclo da Uréia
A uréia é a forma de excreção de amônia em mamíferos terrestres. A enzima
carbamoilfosfato sintetase I (presente na micotôndria e sua atividade
depende de N-acetil glutamato) catalisa a condensação da amônia com
bicarbonato, para formar carbamoilfosfato. O ciclo da uréia tem início, na
mitocôndria, com a condensação da ornitina e do carbamoilfosfato gerando
citrulina, que sai da mitocôndria e reage com aspartato gerando
argininosuccinato e fumarato. A formação da citrulina é catalisada pela
transcarbamoilase, enquanto a argininosuccinato sintetase gera
argininosuccinato, que sofre a ação da argininosuccinato liase e produz
arginina. Finalmente a arginase transforma arginina em uréia e ornitina. Este
último composto volta para a mitocôndria, dando continuidade ao ciclo. Este
ciclo requer 4 ATP para excretar duas moléculas de amônia na forma de uréia,
através dos rins.
O ciclo da uréia é o principal mecanismo de eliminação de amônia. Defeito na
atividade de enzimas do ciclo causam aumento nos níveis de amônia circulante
(hiperamonemia), que gera coma e morte. Deficiência parcial dessas enzimas
causam retardamento mental, letargia e vômitos episódicos. Uma explicação
para esses distúrbios talvez seja porque níveis altos de amônia favorecem a
transformação de alfa-cetoglutarato em glutamato. Isso deve comprometer as
reações do ciclo do ácido cítrico gerando uma redução na produção de ATP. Já
foram identificados pacientes com deficiência de cada uma das enzimas do
ciclo da uréia. O tratamento pode ser feito pela redução na ingestão de
aminoácidos, substituindo-os, se necessário, pelos alfa-cetoácidos
equivalentes; ou pela remoção do excesso de amônia, através da
administração de fármacos que se ligam covalentemente aos aminoácidos e
que são excretados através da urina.