Universidade Federal do Rio de Janeiro
Instituto de Química
Antônio Luís dos Santos Lima, Maria Helena G. Pereira, Luiz Henrique P.
Ângelo da Cunha Pinto
CORANTES SINTÉTICOS – A QUÍMICA DAS CORES
As cores sempre exerceram fascínio sobre a
humanidade. Sabe-se que os caçadores do Período
Glacial pintavam, com fuligem e ocre, as paredes das
cavernas reservadas ao culto, criando obras que
existem há milênios. Muitos dos velhos tecidos
encontrados em múmias egípcias eram coloridos. Em
toda a história, corantes e pigmentos tiveram um
papel importante nas atividades comerciais. Até o
século XIX, a maioria dos materiais corantes eram
obtidos a partir de fontes naturais, com especial
relevância para os corantes vegetais que apresentavam
sérias limitações devido à falta de brilho, fraca
fixação e escassas graduações de cor.
As cores são resultado da absorção de radiação
eletromagnética na faixa da luz visível e estão relacionadas
com comprimentos de onda particulares. O vermelho, por
exemplo, corresponde à faixa entre 480 a 530 nm, e o azul, de
600 a 700 nm. Os compostos orgânicos podem absorver
radiação eletromagnética. Porém, a absorção de radiação na
faixa da luz visível se deve à presença de grupos cromóforos –
ligações duplas conjugadas - na estrutura dos compostos.
Estruturalmente, um dos únicos aspectos comuns a
praticamente todos os corantes é a presença de um ou mais
anéis benzênicos.Com essa propriedade os químicos podem criar substâncias ou misturas de
substâncias com as mais variadas cores e com os mais variados empregos.
Em 1856, o químico inglês William Henry Perkin obteve, acidentalmente, o primeiro
corante sintético, a mauveína, dando início à produção de novas matérias-primas.
Imediatamente, Perkin patenteou sua descoberta, formou uma indústria e logo começou a
produção de novos corantes artificiais.
mauveína
Atualmente, são comercializados mais de oito mil compostos corantes, dos quais 90%
são sintéticos. Até o corante índigo, um dos mais utilizados, foi obtido sinteticamente em
1880, por Karl Heumann.
índigo
No fim do século XIX,
fabricantes de corantes sintéticos
estabeleceram-se na Alemanha,
Inglaterra, França e Suíça suprindo as
necessidades das indústrias que
fabricavam tecidos, couro e papel
sendo absorvido também pelas
indústrias alimentícias, de cosméticos,
tintas e plásticos.
Shopping de tecidos em Marrocos
Como a demanda é grande e variada, os químicos são desafiados a produzir compostos
com propriedades particulares. Idealmente, devem ser estáveis a luz e aos processos de
lavagem. Também devem apresentar fixação uniforme.
Atualmente, metade do volume total de corantes sintéticos produzidos no mundo é
usado em tintas de impressão, um quarto usado em tintas para a construção civil e o resto para
colorir plásticos, cerâmicos, cimentos, tecidos, papéis, velas, alimentos, cosméticos,
farmacêuticos, entre outros. Os corantes sintéticos representam uma boa alternativa e são
viáveis comercialmente. Contudo, necessitam de mais estudos abordando suas desvantagens e
efeitos tóxicos para a saúde humana.
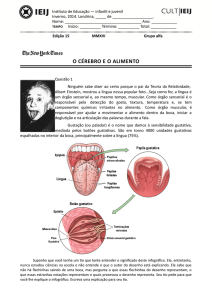
TIPO
APLICAÇÕES
EFEITOS ADVERSOS
Amarelo Crepúsculo
Cereais, balas, coberturas, A tinta azóica, em algumas
xaropes, laticínios, gomas de pessoas, causa alergia, urticária e
mascar
problemas gástricos
Azul Brilhante
Laticínios, balas, cereais, Pode causar hiperatividades,
queijos, recheios, gelatinas, eczema e asma.
licores, refrescos
Amaranto
Bordeaux)
(Vermelho Cereais, balas, geléias, Deve ser evitado por pessoas
sorvetes, xaropes, coberturas sensíveis à aspirina, Foi proibido
em vários países
Vermelho eritrosina
Gelatinas, laticínios, geléias, Tóxico, Contém 557 mg de iodo/g
refrescos
de produto, Pode causar
hipertireoidismo
Indigotina (azul escuro)
Gomas de masar, bebidas, Pode cauar náuseas, vômitos,
balas, iogurtes, etc.
problemas respiratórios e
hipertensão
Vermelho Ponceau 4R
Frutas em calda, refrescos, Evitado por pessoas sensíveis à
polpas artificiais, cereais, aspirina e asmáticas. Pode causar
refrigerantes
anemia e doenças renais
Amarelo Tartrazina
Laticínios, cereais, iogurtes, Pode causar reações alérgicas e
fermentados
insônia, nocivo para a flora
intestinal
Vermelho 40
Xaropes para bebidas, Problemas respiratórios, eczema
refrigerantes, geléias
Por que a maioria dos corantes sintéticos atuais são compostos orgânicos?
A chave está na flexibilidade dos átomos de carbono,
que podem se combinar e criar uma grande variedade de
estruturas – anéis, cadeias e ramificações. Desse universo,
surge um grupo de moléculas com atributos intensos
relacionados à cor e, dentre elas, as menos tóxicas e de
fabricação mais barata são comercializadas como corantes.
A maioria dos corantes é solúvel em água. Então como
podem ser usados em tintas e na indústria têxtil?
Comumente, utiliza-se uma substância chamada mordente
para fixação. São formados por metais de transição que
possuem a capacidade de se complexar com grupos
característicos presentes nas estruturas das fibras, facilitando
a fixação dos corantes. Exemplos são os sulfatos de cobre, ferro, alumínio e estanho.
Geralmente, os corantes são aplicados com um banho no tecido em uma solução aquosa
do corante. Este deve migrar para a fase sólida (tecido) e não sair com adição de água,
evitando assim a perda da cor. A retenção das partículas do corante pelas fibras do tecido
envolve várias forças atrativas, incluindo interação iônica, forças de Van der Waals e ligação
hidrogênio. As interações iônicas ocorrem no caso de corantes aniônicos (ácidos) ou
catiônicos (básicos). As interações intermoleculares também estão presentes. Tanto as fibras
como os corantes possuem grupos com átomos de oxigênio, nitrogênio ou enxofre, altamente
polares. Grupos –OH são capazes de fazer ligações hidrogênio; grupos fenólicos além dessas
ligações ainda atuam como auxócromos – deslocam o comprimento de onda de absorção
característico do grupamento cromóforo.
Esquema de interação fibra-corante
Foram desenvolvidos em 1956 os corantes reativos que apresentam ligações covalentes.
Neste processo, um grupo reativo é introduzido no corante, que liga-se covalentemente às
moléculas do tecido. Os primeiros corantes possuíam um grupo diclorotriazina. Os átomos de
cloro podem facilmente ser substituídos por grupos –OH ou –NH2, existentes nas fibras algodão e lã, por exemplo. Outro tipo de corante foi desenvolvido pela Hoescht, que são
ligados a um grupo reativo eletrofílico de vinilsulfona (VS) que reage com a fibra: coranteSO2-CH=CH2 + HO-celulose → corante-SO2-CH2-CH2-O-celulose.
Corante reativo de diclorotriazina
Os corantes azóicos formam o maior grupo de corantes sintéticos. São produzidos pelo
processo de diazotação descoberto por Peter Gries em 1862: uma amina aromática é
dissolvida em ácido resfriado e misturada com uma solução de nitrito de sódio. Formam-se
sais de diazônio Ar-N=N+ _ Ar-N+_ N, que rapidamente reagem com outros compostos
aromáticos que têm tendência a ceder elétrons, formando compostos Ar-N=N-Ar’ numa
reação chamada acoplamento. A coloração observada nos compostos azóicos deve-se pelo
fato da ligação azo -N=N- provocar a conjugação dos anéis aromáticos que possibilita a
absorção de radiação na faixa da luz visível.
Os corantes azóicos apresentam uma grande vantagem de poderem ser aplicados
diretamente nos tecidos. O primeiro corante desenvolvido foi o Congo Red. Neste processo, o
tecido primeiramente é tratado com a molécula de acoplamento, e então, imerso em uma
solução do respectivo sal de diazônio formando o corante diretamente no tecido. Este método
foi patenteado em 1880.
Congo Red
Os primeiros corantes sintéticos eram derivados do trifenilmetano, que em geral era
obtido a partir da anilina ou da toluidina. Logo após, vários químicos começaram a trabalhar
com derivados da antraquinona para a preparação de corantes. Hoje, este é o segundo maior
grupo de corantes utilizados. Em 1901, Bohn produziu um substituto para o índigo, a partir da
2-aminoantraquinona. A BASF, empresa onde Bohn trabalhava, logo começou uma longa
série de corantes análogos, e muitos são vendidos até hoje. Em torno da mesma época, o
químico alemão Adolph von Baeyer descobriu que o aquecimento do anidrido ftálico com
resorcinol (1,3-dihidroxibenzeno) em solução aquosa produzia um novo composto, capaz de
tornar a solução muito fluorescente; por isso foi chamado fluoresceína. Até hoje este
composto é empregado nas placas de sinalização em rodovias brasileiras. Vários derivados da
fluoresceína são hoje utilizados como corantes, tal como a eosina (tetrabromofluoresceína),
que é largamente empregado como corante vermelho em cosméticos, tintas e papéis. Seu
análogo eritrosina (tetraiodofluoresceína) é usado como corante vermelho em alimentos. A
fluoresceína é um xanteno, uma classe de compostos também largamente empregados como
corantes.
Alguns corantes chamados corantes Dispersos foram especialmente desenvolvidos para
tingir o acetato de celulose e algumas fibras sintéticas novas. Contêm usualmente a
etanolamina (– NHCH2CH2OH), ou um radical semelhante, que contribui para torná-los mais
dispersíveis em água e mais facilmente absorvidos.
Os corantes azóicos ácidos são usados para tingir fibras de poliamida, com grupos
–NO2, -SO3H e -COOH. Possuem uma resistência insuficiente frente aos álcalis e sabões,
embora sejam resistentes à luz. Os corantes básicos são, na sua maioria, derivados amino
sendo empregados principalmente nas tintas para impressão.
Uma nova moda entra a cada estação: novos tecidos, novos cortes,
novos cosméticos, alimentos para todos os tipos de gostos... enfim, novas
cores. É por isso que o trabalho do Químico não pára, e esta é uma área de
pesquisa crescente na química moderna. Como importamos, ainda, quase
que todos os corantes utilizados em nossas indústrias, é natural se esperar
que ocorram mais incentivos financeiros para trabalhos neste campo.
Bibliografia
BARUFFALDI, R. & OLIVEIRA, M.N. Fundamentos de Tecnologia de Alimentos. V.3. Rio
de Janeiro: ATHENEU, p. 179-181, 1998.
MARCH, J. Advanced Organic Chemistry. 4a ed. New York: John Wiley & Sons, Inc., 1992.
1495p.
MORRISON, R.T. & BOYD, R.N. Química Orgânica. 5a ed. Lisboa: Fundação Calouste
Gulbenkian, 1972. 1394 p.
SHREVE, R.N. & BRINK Jr., J.A. Indústrias de Processos Químicos. 4a ed. Rio de Janeiro:
Guanabara, 1977.
SIMÃO, A.M. Aditivos para Alimentos sob o Aspecto Toxicológico. 2a ed. São Paulo: Nobel,
p.37-55, 1989.
SOLOMONS, T.W.G. Química Orgânica 1. 6a ed. Rio de Janeiro: LTC Editora SA, 1996.
777p.
http://www.quimica.com.br/revista/qd421/corantes1.htm
http://www.univates.br/modules/univates/ files/files/eventos/corantes.pdf
http://www.quimicacomcores.ubbi.com.br/
http://www.unb.br/iq/labpesq/lpeq/curios10.htm
http://www.qmc.ufsc.br/qmcweb/artigos/dye/corantes.html