BEXIGA HIPERATIVA IDIOPÁTICA REFRATÁRIA:
TRATAMENTO
AUTORIA: SBU
PARTICIPANTES: Jose Carlos Truzzi, Ricardo Simões, Antonio Silvinato,
Wanderley Bernardo
BEXIGA HIPERATIVA IDIOPÁTICA REFRATÁRIA: TRATAMENTO.
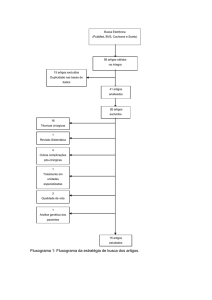
Descrição do método de coleta da evidência: A revisão bibliográfica de
artigos científicos dessa diretriz foi realizada na base de dados MEDLINE,
Cochrane e SciELO. A busca de evidências partiu de cenários clínicos reais, e
utilizou palavras-chaves (MeSH terms) agrupadas nas seguintes sintaxes:
(Overactive Detrusor OR Overactive Urinary Bladder OR Urinary Bladder,
Overactive OR Urinary Incontinence) AND (Botulinum Toxins, Type A OR
Clostridium botulinum A Toxin OR Clostridium Botulinum Toxin Type A OR
Botulinum A Toxin OR Electric Stimulation Therapy OR Therapeutic
Electrical Stimulation OR Prostheses and Implants OR Sacrococcygeal
Region). Os artigos foram selecionados após avaliação crítica da força de
evidência científica, sendo utilizadas para as recomendações as publicações
de maior força. As recomendações foram elaboradas a partir de discussão no
grupo. Toda a diretriz foi revisada por grupo especializado independente em
diretrizes clínicas baseadas em evidências.
Grau de recomendação e força da evidência:
A: Estudos experimentais ou observacionais de melhor consistência.
B: Estudos experimentais ou observacionais de menor consistência.
C: Relatos de casos (estudos nao controlados).
D: Opiniao desprovida de avaliaçao critica, baseada em consensos, estudos
fisiologicos ou modelos animais.
Objetivo: Descrever as principais recomendaçoes no manejo da bexiga
hiperativa idiopática refratária a terapia comportamental e/ou farmacológica.
Conflito de interesse: Nenhum conflito de interesse declarado.
INTRODUÇÃO
Bexiga hiperativa é termo que descreve síndrome clínica caracterizada pela
disfunção do trato urinário inferior que compreende, sobretudo, sintomas de
urgência miccional, associados ou não à queixa de Incontinência urinária por
urgência usualmente acompanhada de polaciúria e noctúria, na ausência de
fatores infecciosos ou outras doenças associadas 1 (D).
Atualmente, a principal estratégia empregada no tratamento da síndrome da
bexiga hiperativa alicerça-se sobre a utilização dos fármacos anticolinergicos,
com base no seu efeito antimuscarinico sobre os receptores do músculo
detrusor, suprimindo as contraçoes involuntárias, e também através de
mecanismos aferentes. Embora a maioria dos pacientes apresentem benefícios
com o tratamento farmacológico, outros permanecem refratários a esta
abordagem
apresentando
sintomatologia
persistente.
Desta
forma,
alternativas de tratamento mais invasivas surgem representadas pela
utilização da toxina botulínica intravesical, estimulação percutânea do nervo
tibial e neuromodulação sacral.
QUAL O PAPEL DA TOXINA BOTULÍNICA NO TRATAMENTO DA
BEXIGA HIPERATIVA IDIOPÁTICA REFRATÁRIA?
A toxina botulínica (BTX) é neurotoxina derivada da bactéria anaeróbica
Clostridium Botulinum. Existem sete sorotipos denominadas BTX Tipo A a G,
sendo apenas disponibilizadas comercialmente as do Tipo A e B. A toxina
botulínica Tipo A (BTX-A) é a mais comumente utilizada, considerada a mais
potente. Ao ser injetada no musculo, atua de maneira seletiva no final do
nervo periférico colinérgico inibindo a liberação da acetilcolina (ACh) nas
junçoes colinergicas pre-sinapticas da placa motora, provocando bloqueio
neuromuscular de longa duração
2
(D). Diversas preparações de toxina
botulínica encontram-se disponíveis comercialmente. Apesar de pertenceram
ao mesmo sorotipo, diferem quanto à variedade da cepa bacteriana utilizada e
método de fabricação, demonstrando por conseguinte, perfil de segurança,
eficácia e tempo de duração diferentes, não devendo ser utilizadas de forma
equivalente.
Pacientes portadores de bexiga hiperativa idiopática refratários ao tratamento
com fármacos anticolinérgicos, apresentam boa resposta as injeçoes
intravesicais de BTX-A, expressa tanto pelo aumento da capacidade vesical
quanto pela melhora nos sintomas relacionados à bexiga hiperativa, como
observado em ensaios clínicos randomizados que demonstraram, em períodos
de seguimento variáveis de seis semanas a 24 meses, a superioridade da
toxina botulinica em relaçao ao placebo
3,4,5,6,7
(A). A eficacia demonstrada
nestes estudos varia de 60 a 90%, com durabilidade do efeito entre três a doze
meses. Além disso, indicadores analisando a qualidade de vida também
demonstraram a superioridade da BTX-A em comparação aos fármacos
antimuscarínicos 8 (A).
Todavia, duvidas persistem sobre a melhor dose a ser utilizada. Baixas doses
de BTX parecem determinar efeitos beneficos, já doses superiores (200 a 300
UI), utilizadas nos casos de bexiga hiperativa neurogênica, apesar de serem
mais eficazes e duradouras, encontram-se relacionadas a maior ocorrência de
efeitos colaterais, como risco de retenção miccional 9 (A).
Ensaio clinico randomizado comparando o uso de diferentes doses de BTX-A
(50, 100, 150, 200 e 300 UI), identificou que pacientes submetidos a dose igual
ou superior a 100 UI apresentaram melhora significante nos sintomas
relacionadas à bexiga hiperativa, entretanto, na análise de curva doseresposta, doses superiores a 150 UI contribuíram com mínima melhora
adicional dos sintomas 10 (A).
A utilização da BTX-A parece ser opção terapêutica segura, no tratamento dos
sintomas relacionados à bexiga hiperativa de pacientes refratários ao
tratamento conservador e/ou fármacos antimuscarínicos, com mínimos
efeitos colaterais. A grande maioria dos estudos utilizando a toxina no
sistema urinario nao apresentam relatos de efeitos adversos graves, sendo
apenas relatado episódios de fraqueza generalizada transitoria, borramento
da visao, dermatomiosite e neuropatia braquial
11
(C). Disfunção miccional,
ocasionando retenção urinária com necessidade de cateterismo intermitente e
resíduo pós-miccional elevado determinando, por conseguinte, maior risco de
infecção do trato urinário são eventos adversos também apresentados 3,4,(A) 12
(B).
Recomendação:
Dos dois tipos da toxina disponiveis para uso clinico, a BTX-A e a mais
estudada, mostrando-se segura e eficaz no tratamento da bexiga hiperativa de
pacientes não respondedores ou intolerantes a terapia comportamental e/ou
farmacológica com antimuscarínicos. Embora haja eficacia, a dose ideal ainda
nao foi estabelecida, de forma tal que potencialize os beneficios sem aumentar
os riscos. Não são conhecidos fatores preditores que nos indiquem sobre o
risco de retenção miccional após instituição do tratamento.
As contraindicaçoes ao uso da toxina botulínica incluem pacientes que
estejam em uso de aminoglicosideos, portadores de neuropatia motora
periferica (esclerose lateral amiotrófica) e doenças neuromusculares como a
miastenia gravis, síndrome de Lambert-Eaton.
QUAL O PAPEL DA ESTIMULAÇÃO PERCUTÂNEA DO NERVO TIBIAL
POSTERIOR
NO
TRATAMENTO
IDIOPÁTICA REFRATÁRIA?
DA
BEXIGA
HIPERATIVA
A neuromodulaçao e a estimulaçao nervosa perfazem modalidades de
estimulaçao eletrica que objetivam a inibiçao reflexa do músculo detrusor,
tendo como alvo a estimulaçao de fibras aferentes e eferentes do nervo
pudendo. A eletroestimulação transcutânea do nervo tibial (PTNS) consiste
na estimulação elétrica de fibras aferentes do nervo tibial, nervo misto cujas
raízes nervosas, originando-se em L4 e L5, S1 a S3, apresentam inervações
comuns às da bexiga, possibilitando desta maneira, inibição dos ramos
aferentes S2-S4 suprimindo, por conseguinte, a atividade vesical.
Inicialmente proposto por Mcguire et al., é considerada forma periférica de
estimulação sacral, mais simples, de fácil aplicação externa, gerando menos
desconforto e normalmente bem tolerada pelas pacientes
13
(C). Estudos
analisando o seu emprego no tratamento dos sintomas relacionados à bexiga
hiperativa indicam melhora significante na sintomatologia analisada de
maneira objetiva e subjetiva, tanto nos parâmetros urodinâmicos quanto
qualidade de vida, contudo, em detrimento ao tratamento farmacológico com
o uso de agentes anticolinérgicos, considerado padrão ouro nesta condição, os
resultados mostram-se semelhantes
14
(B)
15,16,17
(A). Revisão sistemática
incluindo 16 estudos, sendo seis ensaios clínicos randomizados e 10 estudos
prospectivos, incluindo um total de 710 mulheres, identificou taxas variáveis
de sucesso com valores entre 37 a 82%, não sendo reportados eventos
adversos. Metanálise dos ensaios clínicos randomizados foi conduzida,
identificando-se melhora significante nos sintomas relacionados à bexiga
hiperativa em detrimento às pacientes submetidas ao estímulo-placebo
(grupo Sham com dispositivo não funcionante)
18
(A). Ao se comparar o
tratamento farmacológico e a eletroestimulação transcutânea, não se
identificou diferença significante nos parâmetros obtidos por meio do diário
miccional 18 (A).
Desvantagem da PTNS no tratamento de condição crônica como a bexiga
hiperativa recai sobre a necessidade de estimulações repetidas, uma vez que
os sintomas retornam após seis a 12 semanas
19
(C). Existem poucos estudos
na literatura avaliando o sucesso do tratamento no longo prazo, entretanto
ensaio clínico randomizado com tempo de seguimento de 36 meses
demonstra segurança e persistência da melhora subjetiva e objetiva sobre os
sintomas de urgência miccional entre pacientes que mostraram resposta
positiva nas primeiras 12 semanas após instituição do tratamento 20 (B).
Recomendação:
Pacientes portadoras de bexiga hiperativa não respondedoras ou intolerantes
a terapia comportamental e/ou farmacológica com agentes antimuscarínicos,
representam grupo com opções terapêuticas limitadas, para as quais a PTNS
apresenta-se como alternativa viável.
QUAL O PAPEL
DESEMPENHADO
PELA NEUROMODULAÇÃO
SACRAL NO TRATAMENTO DA BEXIGA HIPERATIVA IDIOPÁTICA
REFRATÁRIA?
Desenvolvida no início da década de 80, a neuromodulação sacral apresenta
como mecanismo teorico de açao a correçao, por meio de pulsos eletricos, da
atividade colinergica/adrenergica e das vias motoras reflexas que iniciam o
armazenamento e a micçao
21
(C). E realizada por meio de um dispositivo,
cuja implantaçao e feita geralmente em dois estágios. O primeiro consiste no
implante de um eletrodo no forame S3, ligado a um estimulador externo, com
objetivo de avaliar a integridade dos nervos perifericos, a viabilidade da
estimulaçao e identificar o local ideal para posicionamento do eletrodo
definitivo, permitindo teste terapêutico antes da implantaça o definitiva. O
dispositivo de teste (estimulador externo) permanece em geral por três a sete
dias, mas a fase de teste pode se estender até 3 ou 4 semanas32. Nessa ocasiao,
o paciente e reavaliado; havendo melhora maior ou igual a 50% nos sintomas,
procede-se ao implante do estimulador definitivo no subcutâneo. O modo de
açao da neuroestimulaçao sacral ainda nao esta plenamente esclarecido.
O principal trabalho que levou a maior utilização da neuromodulação sacral
foi estudo multicêntrico, prospectivo e randomizado conduzido em 16 centros
na América do Norte e Europa
22
(A). Neste estudo 155 pacientes refratários
ao tratamento farmacológico, foram recrutados para implante ou não do
dispositivo neuromodulador. Com seguimento de seis meses, foi observada
melhora significante nos episodios de incontinência urinária, numero de
absorventes utilizados e severidade das perdas. Com seguimento de 18 meses,
observou-se que a eficacia da estimulaçao foi mantida, nao se observando
melhora no grupo controle 22 (A).
Estudo multicêntrico prospectivo randomizado, desenhado com o intuito de
avaliar a eficácia e segurança da neuromodulação sacral identificou melhora
significativa, em detrimento ao grupo controle, na qualidade de vida e em
parâmetros cistométricos do diário vesical, como frequência urinária, volume
miccional e grau de urgência, com eficácia mantida após 12 e 24 meses do
início do tratamento
23
(A). Estudos subsequentes incluindo pacientes com
queixa de incontinência por urgência miccional ou urgeincontinência e
acompanhamento por períodos tão longos quanto cinco anos, relataram taxas
de sucesso do tratamento, definidos como melhora nos sintomas miccionais,
com variação de 60 a 77% todavia, podendo estas declinar de acordo com o
período de acompanhamento 24,25,26,27,28 (B) 29,30 (C).
Mais recentemente, um ensaio clínico randomizado demonstrou que a
neuromodulação sacral foi superior ao tratamento medicamentoso padrão
com anticolinérgicos. Este estudo incluiu 147 indivíduos com bexiga
hiperativa refratária (70 randomizados para o grupo de neuromodulação e 77
para o grupo de tratamento medicamentoso) e avaliou o sucesso dos
tratamentos após período de acompanhamento de 6 meses. Considerou-se
como critério de inclusão a falha do tratamento com um ou mais
anticolinérgicos, contudo a existência de pelo menos um esquema de
tratamento com anticolinérgico não utilizado previamente. O sucesso
terapêutico foi de 76% para o grupo de neuromodulação versus 49% para o
grupo de tratamento medicamentoso (P = 0.002) 33(A).
Embora haja clara evidência da eficácia clínica, problemas e limitações da
neuromodulação sacral não são desprezíveis, sendo os principais eventos
adversos relacionados à implantação dor no local do gerador, dor no local da
implantação do eletrodo e deslocamento do mesmo
31
(A)
27
(B). Remoção do
dispositivo em virtude de infecção, apesar de representar complicação
infrequente, também deve ser considerada ao se ponderar sobre a indicação
da neuromodulação sacral.
Recomendação:
A neuromodulação sacral em pacientes portadores de bexiga hiperativa
idiopática refratária ao tratamento conservador e/ou farmacológico tem sido
utilizada com sucesso, sendo demonstrado alívio nos sintomas e melhora na
qualidade de vida. Fatores preditores clínicos que indiquem quais pacientes
responderão ao tratamento são desconhecidos. Desta forma, a fase de teste é
imprescindível para a seleção dos pacientes que serão responsivos à esta
modalidade de tratamento.
Referências:
1. Haylen BT, de Ridder D, Freeman RM, Swift SE, Berghmans B, Lee J,
Monga A, Petri E, Rizk DE, Sand PK, Schaer GN; International
Urogynecological
Association;
International
Continence
Society.
An
International Urogynecological Association (IUGA)/International Continence
Society (ICS) joint report on the terminology for female pelvic floor
dysfunction. Neurourol Urodyn. 2010;29(1):4-20. PubMed PMID: 19941278.
2. Dolly O. Synaptic transmission: inhibition of neurotransmitter release by
botulinum toxins. Headache. 2003;43 Suppl 1:S16-24. Review. PubMed PMID:
12887390.
3. Sahai A, Khan MS, Dasgupta P. Efficacy of botulinum toxin-A for treating
idiopathic detrusor overactivity: results from a single center, randomized,
double-blind, placebo controlled trial. J Urol. 2007;177(6):2231-6. PubMed
PMID: 17509328.
4. Flynn MK, Amundsen CL, Perevich M, Liu F, Webster GD. Outcome of a
randomized, double-blind, placebo controlled trial of botulinum A toxin for
refractory overactive bladder. J Urol. 2009;181(6):2608-15. PubMed PMID:
19375091.
5. Sahai A, Dowson C, Khan MS, Dasgupta P. Improvement in quality of life
after botulinum toxin-A injections for idiopathic detrusor overactivity: results
from
a
randomized
double-blind
placebo-controlled
2009;103(11):1509-15. PubMed PMID: 19389019.
trial.
BJU
Int.
6. Brubaker L, Richter HE, Visco A, Mahajan S, Nygaard I, Braun TM, Barber
MD, Menefee S, Schaffer J, Weber AM, Wei J; Pelvic Floor Disorders Network.
Refractory idiopathic urge urinary incontinence and botulinum A injection. J
Urol. 2008;180(1):217-22. PubMed PMID: 18499184.
7. Tincello DG, Kenyon S, Abrams KR, Mayne C, Toozs-Hobson P, Taylor D,
Slack M. Botulinum toxin a versus placebo for refractory detrusor overactivity
in women: a randomised blinded placebo-controlled trial of 240 women (the
RELAX study). Eur Urol. 2012;62(3):507-14. PubMed PMID: 22236796.
8. Visco AG, Brubaker L, Richter HE, Nygaard I, Paraiso MF, Menefee SA,
Schaffer J, Lowder J, Khandwala S, Sirls L, Spino C, Nolen TL, Wallace D,
Meikle SF; Pelvic Floor Disorders Network. Anticholinergic therapy vs.
Onabotulinumtoxina for urgency urinary incontinence. N Engl J Med.
2012;367(19):1803-13. PubMed PMID: 23036134.
9. Duthie JB, Vincent M, Herbison GP, Wilson DI, Wilson D. Botulinum toxin
injections for adults with overactive bladder syndrome. Cochrane Database
Syst Rev. 2011;(12):CD005493. PubMed PMID: 22161392.
10. Dmochowski R, Chapple C, Nitti VW, Chancellor M, Everaert K,
Thompson C, Daniell G, Zhou J, Haag-Molkenteller C. Efficacy and safety of
onabotulinumtoxinA for idiopathic overactive bladder: a double-blind,
placebo controlled, randomized, dose ranging trial. J Urol. 2010;184(6):241622. PubMed PMID: 20952013.
11. Wyndaele JJ, Van Dromme SA. Muscular weakness as side effect of
botulinum toxin injection for neurogenic detrusor overactivity. Spinal Cord.
2002;40(11):599-600. PubMed PMID: 12411968.
12. Jeffery S, Fynes M, Lee F, Wang K, Williams L, Morley R. Efficacy and
complications of intradetrusor injection with botulinum toxin A in patients
with refractory idiopathic detrusor overactivity. BJU Int. 2007;100(6):1302-6.
PubMed PMID: 17979928.
13. McGuire EJ, Zhang SC, Horwinski ER, Lytton B. Treatment of motor and
sensory detrusor instability by electrical stimulation. J Urol. 1983;129(1):78-9.
PubMed PMID: 6600794.
14. Vandoninck V, van Balken MR, Finazzi Agrò E, Petta F, Micali F,
Heesakkers JP, Debruyne FM, Kiemeney LA, Bemelmans BL. Percutaneous
tibial nerve stimulation in the treatment of overactive bladder: urodynamic
data. Neurourol Urodyn. 2003;22(3):227-32. PubMed PMID: 12707873.
15. Peters KM, Carrico DJ, Perez-Marrero RA, Khan AU, Wooldridge LS,
Davis GL, Macdiarmid SA. Randomized trial of percutaneous tibial nerve
stimulation versus Sham efficacy in the treatment of overactive bladder
syndrome: results from the SUmiT trial. J Urol. 2010;183(4):1438-43. PubMed
PMID: 20171677.
16. Finazzi-Agrò E, Petta F, Sciobica F, Pasqualetti P, Musco S, Bove P.
Percutaneous tibial nerve stimulation effects on detrusor overactivity
incontinence are not due to a placebo effect: a randomized, double-blind,
placebo controlled trial. J Urol. 2010;184(5):2001-6. PubMed PMID: 20850833.
17. Peters KM, Macdiarmid SA, Wooldridge LS, Leong FC, Shobeiri SA,
Rovner ES, Siegel SW, Tate SB, Jarnagin BK, Rosenblatt PL, Feagins BA.
Randomized trial of percutaneous tibial nerve stimulation versus extendedrelease tolterodine: results from the overactive bladder innovative therapy
trial. J Urol. 2009;182(3):1055-61. PubMed PMID: 19616802.
18. Burton C, Sajja A, Latthe PM. Effectiveness of percutaneous posterior tibial
nerve stimulation for overactive bladder: a systematic review and metaanalysis. Neurourol Urodyn. 2012;31(8):1206-16. PubMed PMID: 22581511.
19. van der Pal F, van Balken MR, Heesakkers JP, Debruyne FM, Bemelmans
BL. Percutaneous tibial nerve stimulation in the treatment of refractory
overactive bladder syndrome: is maintenance treatment necessary? BJU Int.
2006;97(3):547-50. PubMed PMID: 16469023.
20. Peters KM, Carrico DJ, Wooldridge LS, Miller CJ, MacDiarmid SA.
Percutaneous tibial nerve stimulation for the long-term treatment of
overactive bladder: 3-year results of the STEP study. J Urol. 2013;189(6):2194201. PubMed PMID: 23219541.
21. Tanagho EA, Schmidt RA, Orvis BR. Neural stimulation for control of
voiding dysfunction: a preliminary report in 22 patients with serious
neuropathic voiding disorders. J Urol. 1989;142(2 Pt 1):340-5. PubMed PMID:
2787411.
22. Schmidt RA, Jonas U, Oleson KA, Janknegt RA, Hassouna MM, Siegel SW,
van Kerrebroeck PE. Sacral nerve stimulation for treatment of refractory
urinary urge incontinence. Sacral Nerve Stimulation Study Group. J Urol.
1999;162(2):352-7. PubMed PMID: 10411037.
23. Hassouna MM, Siegel SW, Nÿeholt AA, Elhilali MM, van Kerrebroeck PE,
Das AK, Gajewski JB, Janknegt RA, Rivas DA, Dijkema H, Milam DF, Oleson
KA, Schmidt RA. Sacral neuromodulation in the treatment of urgencyfrequency symptoms: a multicenter study on efficacy and safety. J Urol.
2000;163(6):1849-54. PubMed PMID: 10799197.
24. Siegel SW, Catanzaro F, Dijkema HE, Elhilali MM, Fowler CJ, Gajewski JB,
Hassouna MM, Janknegt RA, Jonas U, van Kerrebroeck PE, Lycklama a
Nijeholt AA, Oleson KA, Schmidt RA. Long-term results of a multicenter
study on sacral nerve stimulation for treatment of urinary urge incontinence,
urgency-frequency, and retention. Urology. 2000;56(6 Suppl 1):87-91. PubMed
PMID: 11114569.
25. Bosch JL, Groen J. Sacral nerve neuromodulation in the treatment of
patients with refractory motor urge incontinence: long-term results of a
prospective longitudinal study. J Urol. 2000;163(4):1219-22. PubMed PMID:
10737501.
26. Sutherland SE, Lavers A, Carlson A, Holtz C, Kesha J, Siegel SW. Sacral
nerve stimulation for voiding dysfunction: One institution's 11-year
experience. Neurourol Urodyn. 2007;26(1):19-28; discussion 36. PubMed
PMID: 17078071.
27. van Kerrebroeck PE, van Voskuilen AC, Heesakkers JP, Lycklama á
Nijholt AA, Siegel S, Jonas U, Fowler CJ, Fall M, Gajewski JB, Hassouna MM,
Cappellano F, Elhilali MM, Milam DF, Das AK, Dijkema HE, van den
Hombergh U. Results of sacral neuromodulation therapy for urinary voiding
dysfunction: outcomes of a prospective, worldwide clinical study. J Urol.
2007;178(5):2029-34. PubMed PMID: 17869298.
28. Weil EH, Ruiz-Cerdá JL, Eerdmans PH, Janknegt RA, Bemelmans BL, van
Kerrebroeck PE. Sacral root neuromodulation in the treatment of refractory
urinary urge incontinence: a prospective randomized clinical trial. Eur Urol.
2000;37(2):161-71. PubMed PMID: 10705194.
29. Dasgupta R, Wiseman OJ, Kitchen N, Fowler CJ. Long-term results of
sacral neuromodulation for women with urinary retention. BJU Int.
2004;94(3):335-7. PubMed PMID: 15291863.
30. Groen J, Blok BF, Bosch JL. Sacral neuromodulation as treatment for
refractory idiopathic urge urinary incontinence: 5-year results of a
longitudinal study in 60 women. J Urol. 2011;186(3):954-9. PubMed PMID:
21791355.
31. Monga AK, Tracey MR, Subbaroyan J. A systematic review of clinical
studies of electrical stimulation for treatment of lower urinary tract
dysfunction. Int Urogynecol J. 2012;23(8):993-1005. PubMed PMID: 22426872.
32. Kessler TM, Madersbacher H, Kiss G. Prolonged sacral neuromodulation
testing using permanent leads: a more reliable patient selection method? Eur
Urol. 2005 May;47(5):660-5.
33. Siegel S, Noblett K, Mangel J, Griebling TL, Sutherland SE, Bird ET, et al.
Results of a prospective, randomized, multicenter study evaluating sacral
neuromodulation with InterStim therapy compared to standard medical
therapy at 6-months in subjects with mild symptoms of overactive bladder.
Neurourol Urodyn. 2014 Jan 10.