pH E TAMPÕES
ÍON HIDROGÊNIO
O íon hidrogênio (H+) é o íon mais importante nos
sistemas biológicos
A [H+] nas células e líquidos biológicos influencia a
velocidade das reações químicas, a forma e função das
enzimas assim como de outras proteínas celulares e a
integridade das células
A [H+] nas células e líquidos biológicos deve estar em
torno de 0,4nM (0,4x10-7)
80mM de íons hidrogênio são ingeridos ou produzidos
pelo metabolismo por dia.
ÁCIDOS
Conceito de Arrhenius:
Ácido é toda substância que
em solução aquosa libera como cátion o íon
hidrogênio (H+).
Ex.: HCl + H2O H3O+ + ClConceito de Brönsted e Lowry:
Ácido é um doador de
prótons, um substância que pode transferir
um próton para outra.
BASES
Conceito de Arrhenius:
Base é toda substância que
em solução aquosa se dissocia liberando
ânion oxidrila (OH-).
Ex.: NaOH + H2O Na+ + OHConceito de Brönsted e Lowry:
Base é um receptor de
prótons.
Um ácido pode transferir um próton para
uma base.
Ex.: NH3 + H2O NH4+ + OH-
Ácidos e Bases
ácido acético
íon acetato
CH3-COOH + H2O
(ácido)
(base)
íon hidrônio
CH3-COO - + H3O+
(base)
(ácido)
O íon acetato é a base conjugada do ácido acético
O ácido acético é o ácido conjugado do íon acetato
O íon hidrônio é o ácido conjugado da água
A água é a base conjugada do íon hidrônio
Ácidos aumentam a [H+] de uma solução aquosa e
bases a diminuem
Dissociação da água e seus
produtos iônicos
H2O + H2O
OH - + H3O+
A água funciona tanto como ácido quanto como base
[ H3O+] [OH -] [ H3O+] [OH -]
Lei da ação das massas: K =
=
[H2O] [H2O]
[H2O]2
K.[H2O]2 = Kw = [ H3O+] [OH -] = 10-14
Na água pura a [H+] é igual a [OH-] que é igual a 10-7
MOLÉCULA POLAR
ACETONA
ÁGUA
CAMADA DE SOLVATAÇÃO
MAIS PRÓXIMA
MOLÉCULA APOLAR
METIL PROPANO
ÁGUA
CAMADA DE SOLVATAÇÃO MAIS
AFASTADA
DIFUSÃO FACILITADA
As proteínas
transportadoras aumentam
a eficiência do transporte de
pequenas moléculas
hidrofílicas através da
membrana plasmática
Mudanças na concentração de íons Hidrônio
(H3O+) ou ions Oxidrila (OH-) alteram a solubilidade
das substancias e compostos hidrossolúveis
QUANDO HÁ ALTERAÇÃO NA CONCENTRAÇÃO DOS
PRODUTOS IÔNICOS DA ÁGUA, TAMBÉM HÁ ALTERAÇÃO NA
FORÇA IÔNICA DA SOLUÇÃO
SOLUÇÕES ACIDAS
ALTA FORÇA
IÔNICA
SOLUÇÕES BÁSICAS
SOLUÇÃO NEUTRA
BAIXA FORÇA
IÔNICA
ALTA FORÇA
IÔNICA
Potencial hidrogeniônico (pH)
A [H+] de uma solução é quantificada em unidades de pH
O pH é definido como o logarítmo negativo da [H+]
pH = -log [H+]
A escala de pH varia de 1 até 14, uma vez que qualquer
[H+] está compreendida na faixa de 100 a 10-14.
ESCALA DE pH
ACIDEZ
pH
H3 O+
(mols/L)
OH(mols/L)
0
100 = 1
10-14=0,000 000 000 000 01
3
10-3 = 0,001
7
10-7 = 0,000 000 1
10
10-10 = 0,000 000 000 1
14
10-14 =0, 000 000 000 000 01
10-11=0,000 000 000 01
10-7=0,000 000 1
10-4=0,000 1
10 -0=1
ALCALINIDADE
pH x homeostasia
Homeostasia é a constância do meio interno
equilíbrio entre a entrada ou produção de íons
hidrogênio e a livre remoção desses íons do
organismo.
o organismo dispõe de mecanismos para manter
a [H+] e, conseqüentemente o pH sangüineo, dentro
da normalidade, ou seja manter a homeostasia .
pH do Sangue Arterial
pH normal
Acidose
Alcalose
7,0
7,4
7,8
Faixa de sobrevida
Alterações no pH
Perda de bases
Acúmulo de ácidos
Aumento da [H+]
Acidose
Queda do pH
7,4
Escala de pH
Aumento do pH
Alcalose
Diminuição da [H+]
Perda de ácidos
Acúmulo de bases
SINALIZAÇÃO QUÍMICA INTRACELULAR
PROTEÍNAS
ESPECIFICIDADE
AMPLIFICAÇÃO
SINA
LIZA
ÇÃO
CEL
ULA
R
ADAPTAÇÃO
INTEGRAÇÃO
PROTEÍNAS
DIVERSAS VIAS DE SINALIZAÇÃO QUÍMICA
SINALIZADOR EXTRACELULAR
PROTEÍNAS RECEPTORAS
PROTEÍNAS SINALIZADORAS
PROTEÍNAS ALVOS
ENZIMAS
METABÓLICAS
ALTERAÇÕES
NO
METABOLISMO
PROTEÍNAS REGULADORAS
DE GENES
ALTERAÇÕES
NA
EXPRESSÃO
DE GENES
PROTEÍNAS DO
CITOESQUELETO
ALTERAÇÕES NA
FORMA E NO
MOVIMENTO DAS
CÉLULAS
TENDE A ALTERAR A FORMA E,
CONSEQUENTEMENTE, A FUNÇÃO DAS PROTEÍNAS
H
+
H
+
H
H
- pH: Idem à temperatura; existe um pH ótimo,
onde a distribuição de cargas elétricas da molécula da
enzima e, em especial do sítio catalítico, é ideal para a
catálise.
+
+
Íons Hidrogênio
podem interferir
na catalise
COMPARTIMENTOS biológicos
COM pH diferenciado
Ativação de enzimas específicas
Tabela 1: pH Ótimo de algumas enzimas
Enzyme
pH Optimum
Lipase (pancreas)
8.0
Lipase (stomach)
4.0 - 5.0
Lipase (castor oil)
4.7
Pepsin
1.5 - 1.6
Trypsin
7.8 - 8.7
Urease
7.0
Invertase
4.5
Maltase
6.1 - 6.8
Amylase (pancreas)
6.7 - 7.0
Amylase (malt)
4.6 - 5.2
Catalase
7.0
Garantem a homeostase
Tanto da células quanto do organismo
fonte: http://www.worthington-biochem.com/introBiochem/effectspH.html
Sangue
(pH 7,4)
Canalículos
secretórios
(pH < 2,0)
Citosol
(pH 7,3)
K+ K+
K+
_
Cl
K+ K +
_
Cl
_
Cl
Cl Cl
H+
_ Cl
H+
H+
H + K + K+
K+ K +
ATPase
Omeprazol
irreversível
_
_
K+
K+
K+
ATP
Célula parietal
ADP
H+
HCl
HCl HCl
HCl
PEPSINA
REGULAÇÃO DE RECEPTORES INDUZIDA POR AGONISTAS
GRKs = quinases
dependentes de
receptores acoplados a
proteína G
1- DESSENSIBILIZAÇÃO
A
A
A
A
R
R
A
GRKs
R
Arr
Ptn G
(quinases)
P
R
R
AC
Arr
2 - SEQUESTRO
3- RECICLAGEM
P
P
FOSFATASES
H+
4 - DEGRADAÇÃO
H+
FUNCIONAM EM Ph
mais ácido < 7
bomba
De protóns
PROTEASES
H+
ATP
ADP
Ph mais
ácido < 6
Alterações bruscas de pH podem levar as proteínas a desnaturação
Fontes de H+ decorrentes dos processos
metabólicos
Metabolismo
aeróbico da glicose
Metabolismo
anaeróbico da glicose
Ácido Carbônico
H+
Ácido Sulfúrico
Oxidação de Amino ácidos
Sulfurados
Ácido Fosfórico
Hidrólise das fosfoproteínas e
nucleoproteínas
Powers,S.K. e Howley, E.T., Fisiologia do Exercício, (2000), pg207 Fig11.3
Ácido Lático
Corpos Cetônicos Ácidos
Oxidação incompleta de
ácidos graxos
Corpos Cetônicos
O
O
CH3
C
CH3
CH3
C
Acetona
C
H
O
CH2
CH2
C
O
Acetoacetato
OH
CH3
O
-
Doador de Hidrogênio
3 Hidroxibutirato
C
O
-
• São produzidos em resposta a níveis elevados de Ácidos
Graxos no fígado.
• Quando Acetil CoA excede capacidade oxidativa do
fígadoMitocôndrias hepáticas Corpos cetônicos
Corpos Cetônicos
• Funções:
– Importantes fontes de energia para tecidos
periféricos;
– São solúveis em solução aquosa (Não precisam
de transportadores no sangue);
– Usados nos tecidos extra-hepáticos (inclusive
cérebro);
– Em jejum muito prolongado 75% das
necessidades energéticas do cérebro são
atendidas pelo acetoacetato;
* A acetona não é utilizada pelo corpo como um
combustível, ela é volátil e pode ser eliminada pela
respiração (Hálito Cetônico).
Corpos Cetônicos
• Cetose:aumento da concentração de Corpos
Cetônicos nos Tecidos Líquidos e Corporais.
• Velocidade de formação de Corpos Cetônicos
é maior que sua utilização.
Cetonemia
(aumento de
níveis no Sangue).
Cetonúria
(Urina).
Corpos Cetônicos
• Condições Típicas que se observa a Cetose:
jejum, Diabetes mellitus, Dietas ricas em
Gorduras e pobres em Glicídios,
• Secreções contínuas em maior quantidade
acarretam a perda de cátion tampão (OH-) à
medida que circula no sangue diminuição do
pH corporal cetoacidose.
EXOCITOSE
EXTERNALIZAÇÃO DE TRANSPORTADORES DE
GLICOSE INDUZIDA POR INSULINA
Células não
estimulada
Receptor de insulina
Células estimulada
Transportador
de glicose
reserva intracelular de
transportadores de glicose
presente nos endossomas
Mais
Transportadores
de glicose
Insulina
Mobilização da
reserva intracelular de
transportadores de
glicose
para a membrana
plasmática
Diabetes Mellitus (DM)
DM do tipo 1 resulta primariamente da destruição das células
beta pancreáticas e tem tendência à cetoacidose;
Inclui casos decorrentes de doença auto-imune e aqueles nos
quais a causa da destruição das células beta não é conhecida;
A forma rapidamente progressiva é comumente observada em
crianças e adolescentes, porém pode ocorrer também em
adultos;
A forma lentamente progressiva ocorre geralmente em adultos
e é referida como diabetes latente auto-imune do adulto.
SBD, 2002
Diabetes Mellitus (DM)
DM do tipo 2: graus variáveis de resistência à insulina e
deficiência relativa de secreção de insulina;
A maioria dos pacientes tem excesso de peso e a cetoacidose
ocorre apenas em situações especiais, como durante
infecções graves;
O diagnóstico, na maioria dos casos, é feito a partir dos 40
anos de idade, embora possa ocorrer mais cedo, mais
raramente em adolescentes.
Nos últimos anos, a incidência de diabetes do tipo 2 vem
crescendo entre crianças e jovens nos Estados Unidos, em
associação ao aumento da obesidade
SBD, 2002
SBD, 2002
pH dos Líquidos Corporais
Concentração de H+ em mEq/l
Líquido Extracelular
Sangue arterial
Sangue venoso
Líquido Intersticial
4.0 x 10 -5
4.5 x 10 -5
4.5 x 10-5
pH
7.40
7.35
7.35
Líquido Intracelular
1 x 10-3 a 4 x 10-5
6.0 a 7.4
Urina
3 x 10 -2 a 1 x 10-5
4.5 a 8.0
HCl gástrico
160
0.80
Medidas de pH
Eletrométrico
Lavar o eletrodo e secar com
papel absorvente Padronização
feita com soluções de pH
abaixo e acima do que vai ser
medido
pHmetro
Potenciômetro mede [H+]
diferença de potencial elétrico
entre duas soluções
Medidas de pH
Colorimétrico
Indicador-H
(Cor A)
indicadores
H+
+
Indicador
(Cor B)
Indicadores de pH
Indicadores de pH são substâncias (corantes)
utilizadas para determinar o valor do pH
pH
0
2
4
6
8 10 12
Exemplos
Metil-violeta
Tornassol
Fenolftaleína
Amarelo
Violeta
Amarelo
incolor
Azul
Vermelho
Violeta
Os Sistemas Tampões
COMPOSIÇÃO E AÇÃO DAS SOLUÇÕES-TAMPÃO
Um tampão resiste ás variações no pH porque
ele contém tanto espécies ácidas para neutralizar
os íons OH- quanto espécies básicas para
neutralizar os íons H+.
Exigência preenchida por um par
ÁCIDO-BASE CONJUGADO
ácido
base- conjugada
CH3COOH / CH3COO- ou
Acido acético
Ácido- conjugado
base
NH4+ / NH3
acetato
Íon Amônio
Amônia
COMPOSIÇÃO E AÇÃO DAS SOLUÇÕES-TAMPÃO
Íons OH- são adicionados à solução-tampão:
OH- (aq) + HX (aq)
H2O (l)
X- (aq)
[X-]
[HX]
base conjugada
Acido fraco
Adição de hidroxilas
(tende a consumir o ácido)
+
Concentração do ácido fraco
diminui
Concentração da base
conjugada aumenta
Mudanças estreitas nos valores de pH
Quantidades de HX e X- no tampão são grandes comparadas com a
quantidade de OH- adicionada, por isso a razão [HX] / [X-] não varia
muito, tornando a variação no pH pequena.
COMPOSIÇÃO E AÇÃO DAS SOLUÇÕES-TAMPÃO
Íons H+ são adicionados à solução-tampão:
H
+
(aq)
+ X
-
HX (aq)
(aq)
[HX]
[X-]
Concentração da base fraca
diminui
Adição de ácido
(tende a consumir a base)
Concentração do ácido
conjugado aumenta
Mudanças estreitas nos valores de pH
Quantidades de HX e X- no tampão são grandes comparadas com a
quantidade de H+ adicionada, por isso a razão [HX] / [X-] não varia
muito, tornando a variação no pH pequena.
COMO SÃO FORMADAS AS
SOLUÇÕES TAMPÕES?
PORQUE SEMPRE TEMOS ACIDOS
FRACOS OU BASES FRACAS
FORMANDO OS TAMPÕES?
CONSIDERANDO-SE UM ÁCIDO FORTE
CONSTANTE DE DISSOCIAÇÃO
Ka =
[H+] [X-]
[HX]
Denominador ñ pode ser
zero
Produto da dissociação do ácido
Reagente (ácido)
DISSOCIAÇÃO DO ÁCIDO FORTE EM
SOLUÇÃO AQUOSA É TOTAL
DENOMINADOR É CONSIDERADO ZERO
Não É POSSIVEL CALCULAR O VALOR DO Ka
_
+
HCl
(Ácido forte)
H
+
Cl
(base-conjugada)
Base muito fraca
Considerando-se um ácido fraco:
Ka =
Produto da dissociação do ácido
[H+] [X-]
[HX]
Reagente (ácido)
Denominador É MAIOR
DE ZERO
DISSOCIAÇÃO DO ÁCIDO FRACO EM
SOLUÇÃO AQUOSA É PARCIAL
DENOMINADOR É MAIOR QUE ZERO
É POSSIVEL CALCULAR O VALOR DO Ka
CH3COOH(aq)
ÁCIDO ACÉTICO
ÁCIDO FRACO
Ka
CH3COO (aq)
(base-conjugada)
BASE FRACA
+
+
H (aq)
QUAL É A COMPOSIÇÃO E AÇÃO
DAS SOLUÇÕES-TAMPÃO?
COMPOSIÇÃO E AÇÃO DAS SOLUÇÕES-TAMPÃO
Preparação
Mistura de um ácido fraco ou uma base fraca
com um sal do ácido ou da base.
ácido carbônico
bicarbonato
4.45 x 10-7
5,35 -7,35
EQUAÇÃO DE HENDERSEN-HASSELBALCH
[HX]
+
[H ] = Ka
[X-]
+
- log [H ] = - log
Ka
[HX]
[X-]
= - log Ka - log
[HX]
[X-]
Onde, - log [H+] = pH e – log Ka = pKa, temos:
pH = pKa - log
[HX]
[X-]
= pKa + log
pH = pKa + log
[X-]
[HX]
[X-]
[HX]
ÁCIDO FRACO
BASE FRACA
CH3COO-(aq) +
Ka
CH3COOH(aq)
H+(aq)
acetato (base-conjugada)
ÁCIDO ACÉTICO
Ka da reação = 1.8 x 10-5
pKa = – log Ka
pH = pKa = 4,74
Se a relação de entre os produtos e o reagente
for de 1/10
ESPÉCIE BÁSICA
C H
(4,74)
pH = pKa + log
3
C O O -
(a q )
(1 mM)
[X-]
pH = 4,74 - 1
pH = 3,7
[HX]
Mais ácido
(10 mM)
C H
3
C O O H
ESPÉCIE ÁCIDA
(a q )
ÁCIDO FRACO
BASE FRACA
CH3COO-(aq) +
Ka
CH3COOH(aq)
H+(aq)
(base-conjugada)
ÁCIDO ACÉTICO
Ka da reação = 1.8 x 10-5
pKa = – log Ka
Se a relação entre produtos e
reagentes for de 10/1
pH = pKa = 4,74
ESPÉCIE BÁSICA
C H
(4,74)
pH = pKa + log
3
C O O -
(a q )
(10 mM)
[X-]
pH = 4,74 + 1
pH = 5,74
[HX]
(1 mM)
C H
Mais básico
3
C O O H
ESPÉCIE ÁCIDA
(a q )
COMPOSIÇÃO E AÇÃO DAS SOLUÇÕES-TAMPÃO
Os tampões resistem mais eficazmente à variação de pH em qualquer
sentido quando as concentrações de ácido fraco e base conjugada são
aproximadamente as mesmas.
+
[H
] = Ka
A partir da equação:
[HX]
[X-]
Valores iguais
=1
Quando as concentrações de ácido fraco e base
conjugada são iguais, [H+] = Ka.
Geralmente tentamos selecionar um tampão cuja forma
ácida tem pKa próximo do pH desejado.
Valor do pKa = 4,74
(ácido acético/acetato)
Valor do pH será
próximo de 4,74
Poder Tamponante
pH do tampão
Concentrações do sal e do ácido
Relação Sal/Ácido = 0,1 (1/10) pH = pKa + log 0,1
pH = pKa -1
Relação Sal/Ácido = 10/1
pH = pKa +1
(ácido acético/acetato)
pH = 3,7
pH = pKa + log 10
(ácido acético/acetato)
pH = 5,74
Poder tamponante de um sistema tampão pode ser definido pela quantidade
de ácido forte que é necessário adicionar para fazer variar o pH de uma
unidade
CAPACIDADE DE TAMPÃO
É a quantidade de ácido ou base que um
tampão pode neutralizar antes que o pH
comece a variar a um grau apreciável.
Depende da quantidade de ácido e base
da qual o tampão é feito.
Se um tampão apresentar mais espécies
básicas (tampão básico) – ele irá suportar
maior adição de ácidos
Se um tampão apresentar mais espécies
ácidas (tampão ácido) – ele irá suportar
maior adição de bases
Exemplos de Tampões
Acetato
CH3-COOH + CH3-COONa
Bicarbonato
H2CO3 + NaHCO3
Fosfato
H2PO-4 + NaHPO4
Amônia
NH4OH + NH4Cl
COMPOSIÇÃO E AÇÃO DAS SOLUÇÕES-TAMPÃO
Preparação
Mistura de um ácido fraco ou uma base
fraca com um sal do ácido ou da base.
ácido carbônico
bicarbonato
4.45 x 10-7
5,35 -7,35
Sistemas Primários
Reguladores do pH
Os sistemas químicos de tampões ácido-base dos
líquidos corporais;
O centro respiratório, que regula a remoção de CO2
do líquido extracelular;
Os rins, que agem reabsorvendo o bicarbonato
filtrado ou eliminando o H+ pelo sistema tampão
fosfato ou na forma de NH4+.
Os Sistemas Tampões do
Organismo
Os principais sistemas tampões presentes no
organismo, que permitem a manutenção da homeostasia,
são:
SISTEMA BICARBONATO
SISTEMA FOSFATO
PROTEÍNAS
SISTEMA DA AMÔNIA
SISTEMA
BICARBONATO
principal sistema tampão do organismo
responsável principal pelo tamponamento do
meio extracelular
É predominante no sangue (plasma),
no filtrado renal e fluído extracelular
Depende muito da função
integrada dos rins e pulmões
SISTEMA FOSFATO
PROTEÍNAS
SISTEMA DA AMÔNIA
PRESENÇA RELEVANTE NO
FILTRADO RENAL
Tem ação adjuvante com o
Sistema Bicarbonato
Funcionam como sistema tampão
principalmente no meio intracelular e têm
ação adjuvante com os sistema
bicarbonato no plasma sanguíneo
(proteínas plasmáticas)
PRESENÇA RELEVANTE NO FILTRADO RENAL
Favorece eliminação de íons hidrogênio pela
desaminação da glutamina
SANGUE COMO UMA SOLUÇÃO-TAMPÃO
Sistema tampão usado para controlar o
pH no sangue.
SISTEMA TAMPÃO ÁCIDO
CARBÔNICO-BICARBONATO
H2CO3 / HCO3- : são um par ácido base conjugado.
SANGUE COMO UMA SOLUÇÃO-TAMPÃO
Equilíbrios importantes no sistema tampão
ácido carbônico-bicarbonato:
H+(aq) + HCO3-(aq)
H2CO3(aq)
rim
H2O(l) + CO2(g)
pulmão
CO2: um gás que fornece um mecanismo para o
corpo se ajustar aos equilíbrios.
A remoção de CO2 por exalação desloca o
equilíbrio para a direita, consumindo íons H+.
SANGUE COMO UMA SOLUÇÃO-TAMPÃO
Para que o tampão tenha pH de 7,4, a razão
[base] / [ácido] deve ser igual a um valor de 20.
20 espécies básicas para 1 espécie ácida
No plasma sangüíneo normal as concentrações
de HCO3- e H2CO3 são aproximadamente de
0,024 mol / L e 0,0012 mol /L, respectivamente.
20 espécies básicas para 1 espécie ácida
SANGUE COMO UMA SOLUÇÃO-TAMPÃO
TAMPÃO ÁCIDO CARBÔNICO-BICARBONATO
O tampão tem alta capacidade para neutralizar
ácido adicional, mas apenas uma baixa
capacidade para neutralizar base adicional.
Se um tampão apresentar mais espécies básicas (tampão básico) – ele
irá suportar maior adição de ácidos
Fontes de H+ decorrentes dos processos
metabólicos
Metabolismo
aeróbico da glicose
Metabolismo
anaeróbico da glicose
Ácido Carbônico
H+
Ácido Sulfúrico
Oxidação de Amino ácidos
Sulfurados
Ácido Fosfórico
Hidrólise das fosfoproteínas e
nucleoproteínas
Powers,S.K. e Howley, E.T., Fisiologia do Exercício, (2000), pg207 Fig11.3
Ácido Lático
Corpos Cetônicos Ácidos
Oxidação incompleta de
ácidos graxos
APLICAÇÕES DOS CONCEITOS
de pH e Tampão na Fisiologia, na
Farmacologia e na Clínica
médica.
pH em condições normais é de 7,4
pH abaixo de 7,35 indica acidose, devido a alta de H+
pH acima de 7,45 indica alcalose, como resultado da diminuição de H
pH abaixo de 6,8 ou acima de 7,8 é, praticamente, fatal.
O pH do plasma
[H+] (mEq/l)
pH
Status
ÁcidoBásico
0,00006
7,22
acidose
0,00004
7,40
normal
0,0002
7,70
alcalose
Sistema de tamponamento dióxido de carbonobicarbonato é o principal tampão extracelular
Sua capacidade tamponante pode ser
regulada
Limites confiáveis:
PCO2
37 mmHg e 45 mmHg
Bicarbonato
É um tampão dinâmico
22meq/l e 26 meq/l
Controle SNC e pulmão
Controle renal
Tamponamento intracelular :
Hemoglobina
Tampões fixos ( ñ permitem grandes
Proteínas
variações em seus componentes básicos e
Fosfato dibásico
ácidos )
Carbonato osseo
HOMEOSTASIA E DISTÚRBIOS ÁCIDO-BASE
Os principais órgãos que regulam o pH do sistema
tampão ácido carbônico-bicarbonato são pulmões e rins.
SISTEMA RENAL
Os rins absorvem ou liberam H+ e HCO3-; muito do
excesso de ácido deixa o corpo na urina, que normalmente
tem pH de 5,0 a 7,0.
HOMEOSTASIA E DISTÚRBIOS ÁCIDO-BASE
Alguns dos receptores no cérebro são sensíveis às concentrações de
H+ e CO2 nos fluídos corpóreos.
Quando a concentração de CO2 aumenta, os equilíbrios
deslocam-se para a esquerda, o que leva à formação de mais H+.
Os receptores disparam um reflexo para respirar mais rápido e
mais profundamente, aumentando a velocidade de eliminação de
CO2 dos pulmões e deslocando o equilíbrio de volta para a direita.
CONTROLE NEURAL
FISIOLOGIA RESPIRATÓRIA
CONTROLE NEURAL DA
RESPIRAÇÃO
Os mecanismos que controlam a respiração são complexos. Há um
grupo de centros respiratórios localizados no tronco cerebral
produzindo atividade respiratória automática.
Eles são regulados principalmente pela aferência de
quimiorreceptores.
Este controle pode ser cancelado por uma ação voluntária (comando
cortical).
Segurar o fôlego, HIPERVENTILAR VOLUNTARIAMENTE, ou suspirar
são exemplos do que podemos fazer com nosso controle voluntário
sobre a respiração.
O principal centro respiratório está no assoalho do 4o
Ventrículo, com um grupo de neurônios inspiratórios
(dorsais) e outro grupo expiratório (ventral) .
Os neurônios inspiratórios disparam automaticamente, enquanto que os
expiratórios são utilizados somente durante a expiração forçada.
Os dois outros principais centros são o CENTRO APNÊUSTICO, que
estimula a inspiração e o CENTRO PNEUMOTÁXICO, que termina a
inspiração pela inibição do grupo de neurônios dorsais descritos acima.
Os QUIMIORRECEPTORES que regulam a respiração são
localizados centralmente e perifericamente.
Normalmente o controle é exercido por
receptores centrais localizados na medula, que
respondem à
concentração do íon hidrogênio [H+] no líquido cerebroespinhal
(CSF),
DETERMINADO PELO pressão de CO2 ARTERIAL, que se
difunde livremente através da barreira hemato-encefálica.
Mecanismos pulmonares na regulação ácido-básica
TECIDO NERVOSO
TECIDO NERVOSO
Barreira hematoencefálica
LCR
Barreira hematoencefálica
Líquido
cefaloraquidiano
Sangue venoso
CO2 produzido
pelo
metabolismo
quimioceptores
Sangue arterial
LCR
Proteínas plasmáticas
Poucas proteínas
O LCR tem baixa
capacidade
tamponante
A resposta é rápida e sensível a pequenas mudanças no CO2 arterial
(PaCO2).
Além disso, há quimiorreceptores periféricos localizados nos corpos
aórticos e carotídeos, a maioria dos quais sensíveis à queda da
PaO2, e uma pequena minoria que respondem à elevação da
PaCO2.
O grau de hipoxemia necessário para produzir ativação significativa
nesses receptores de O2 é tal que eles praticamente não fazem parte
da regulação neural da respiração em condições normais.
Caso profunda hipoxemia (PO2 abaixo de 60 mm Hg) se
desenvolva, passarão a ter alguma importância. Isto também
acontece nos casos onde a PaCO2 está cronicamente elevada,
levando a uma diminuição da sensibilidade dos receptores
centrais.Nestes casos, o bicarbonato plasmático está também
normalmente elevado (acidose respiratória compensada).
QUIMIORRECEPTORES
LOCALIZADOS NOS CORPOS
CAROTÍDEOS E AÓRTICOS
SENSÍVEIS AO
VARIAÇÕES DA PaO2
MUDANÇAS NA
CONCENTRAÇÃO
INTERNA DE CÁLCIO
LIBERAÇÃO DE DOPAMINA
POR EXOCITOSE
ATIVAÇÃO DE FIBRAS
AFERENTES VAGAIS
ATIVAÇÃO DE UM
CONJUNTO DE RESPOSTAS
QUE LEVAM A UM
AUMENTO DA PaO2
CONTROLE NEURAL DA
RESPIRAÇÃO
Reflexo quimiorreceptor
Centro respiratório bulbar
Quimiorreceptores centrais :
Bulbo e hipotálamo
Corpos carotídeos e aórticos
Quimiorreceptores periféricos
FISIOLOGIA RENAL
Papel do Rim no controle do pH plasmático
FUNÇÃO E
ESTRUTURA RENAL
ANATOMIA RENAL – O RIM
Cada rim tem a forma
de um grande grão de
feijão e as seguintes
dimensões em um
adulto
Altura = 10 - 13 cm
Largura = 5 - 7 cm
Profundidade = 2,5 - 3 cm
Peso = 120 - 180 gramas
FILTRAÇÃO
dos capilares
glomerulares para a
cápsula de Bowman
A – filtração
glomerular
B – reabsorção
tubular
C – secreção
tubular
Princípios de Formação da urina
A REABSORÇÃO TUBULAR é o movimento de água e solutos
do lúmen tubular para o sangue (independentemente do
mecanismo).
É um processo altamente seletivo e fundamental para algumas
substâncias como o Na+, Cl-, HCO3-, PO4²-, Ca2+, Mg2+, glicose, a.a.,
água, entre outras.
A SECREÇÃO pode ser definida como a movimentação de
solutos do sangue para o lúmen tubular ou, de substâncias
produzidas nas células tubulares, do interior destas para o lúmen
tubular.
É um processo importante para algumas substâncias entre as
quais o H+, K+, NH4+.
filtração
Capilar
periglomerular
secreção
Células tubulares
Via
transcelular
Fluxo de
massa
sangue
lúmen
ativo
passivo
Via
paracelular
solutos
água
reabsorção
Excreção
BALANÇO RENAL DO
BICARBONATO
TÚBULO PROXIMAL
Lúmen
Liquido
intersticial
FILTRADO TUBULAR
+
K
HCO3
Cl
HCO3
H+
H+
H+
Na+
Anidrase
carbônica
H2CO3
CO2
Anidrase
carbônica
CO2
ATP
_
Cl
HCO3
H2CO3
CO2
H2O
H2O
APICAL
URINA
BASAL
CÉLULA TUBULAR
PROXIMAL
Na+
_
HCO3
S
A
N
G
U
E
BALANÇO RENAL DA AMÔNIA
Lúmen
TÚBULO PROXIMAL
Liquido
intersticial
FILTRADO TUBULAR
K
H+ + H+
H
H+
H+
Na+
+
ATP
+
H+ H
H
H+
Está Induzido
em acidose
crônica
NH3 base
GLUTAMINA
desaminação
Neutraliza os íons H+
NH4+
NH3
Amônia
Íon Amônio
Ácido- conjugado
35 meq/dia excreção
normal de Amônia
+ 300 meq/dia em
acidemia severa
APICAL
URINA
BASAL
CÉLULA TUBULAR
PROXIMAL
Na+
S
A
N
G
U
E
SEQUENCIA DE TAMPONAMENTO DO PH
DISTÚRBIO
Aceptores e
Doadores de H +
PROTEÍNAS
DO CORPO
IMEDIATO
TROCA RESPIRATÓRIA
DE CO2
LEVA MINUTOS
EXCREÇÃO RENAL DE HCO3 LEVA DIAS
CLASSIFICAÇÃO DOS DISTURBIOS ÁCIDO-BASE
O pH anormal devido a concentração
de bicarbonato alterada.
(alteração primária)
Alteração da PaCO2 plasmática.
(alteração secundária)
pH mais ácido pela diminuição primária
de Bicarbonato no sangue - Acidemia
ACIDOSE METABÓLICA
Pode ser compensada pela diminuição
PaCO2 plasmática (secundária) respiração rápida e profunda
pH mais básico pelo aumento primário
de bicarbonato no sangue - Alcalemia
ALCALOSE METABÓLICA
Pode ser compensada pelo aumento da
PaCO2 plasmática (secundária) respiração pausada
CLASSIFICAÇÃO DOS DISTURBIOS ÁCIDO-BASE
O pH anormal devido MUDANÇAS
NA PaCO2 sanguinea.
(alteração primária)
Alteração plasmática das
concentrações de
Bicarbonato.
(alteração secundária)
pH mais ácido pelo aumento primário da
PaCO2 no sangue - Acidemia
ACIDOSE RESPIRATÓRIA
Pode ser compensada pelo aumento da
concentração de bicarbonato no sangue
(secundária)
pH mais básico pela diminuição primária
de PaCO2 no sangue - Alcalemia
ALCALOSE RESPIRATÓRIA
Pode ser compensada pelo diminuição
da concentração plasmática de
Bicarbonato (secundária) -
ALCALOSE RESPIRATÓRIA
Causas comuns
Causas comuns
É acompanhada de hipóxia
Hiperventilação por esforço
voluntário (ansiedade)
Distúrbios de ventilação/perfusão
Estimulação dos centros
respiratórios, secundária a
meningite ou a febre
Depressão central por sobredose de
barbitúritos
ALCALOSE METABÓLICA
Insuficiência renal
ingestão de antiácidos
Diabetes descompensado
(cetoasidose)
Perda de ácido gástrico
(vômitos)
No hiperaldosteronismo
ACIDOSE METABÓLICA
Causas comuns
Causas comuns
Aumento da perda renal de
ACIDOSE RESPIRATÓRIA
H+
Diarréia
BIBLIOGRAFIA INDICADA
FISIOLOGIA HUMANA – Stuart Ira Fox
FISIOLOGIA HUMANA – Guyton e Hall
FISIOLOGIA HUMANA – Berne e Levy
Conceitos de pH e tampões
Sistemas que controlam o pH no organismo
Diagrama de Davenport dá uma representação visual dos distúrbios ácido-básicos
Acidose metabólica
Acidose respiratória
Alcalose metabólica
Alcalose respiratória
DISTURBIOS ACIDOS-BASES
E
SUAS CONSEQUENCIAS
FISIOPATOLÓGICAS
Esquerda
Aumento afinidade
Efeito do pH na curva de dissociação da
hemoglobina
Direita
Diminui afinidade
células
Ajuda na
hipóxia
tissular
CO2
O2
aumento
de CO2
hipercapenia
Deixa o meio mais ácido
Facilita a liberação de O2
sangue
O meio mais básico
dificulta a liberação de O2 e facilita a
ligação de O2 na Hemoglobina
Isso facilita o carreamento de Oxigênio no
capilares pulmonares
No pulmão o pH sanguíneo é levemente
alcalino
ALCALOSE RESPIRATÓRIA
AUMENTO DA SECREÇÃO
DE PTH
HIPERPARATIREOIDISMO
SECUNDÁRIO
DISTURBIOS ÓSSEOS
(OSTEOPOROSE)
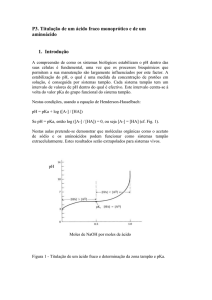
Equação de Henderson-Hasselbach
[H3O+][A-]
Ka = [HA]
HA + H2O = A- + H3O+
pKa = pH - log [espécie ionizada]
[espécie não ionizada]
Coeficiente de
ionização
pKa
bases
ácidos
fortes
fracos
fracos
fortes
pH dos compartimentos biológicos
Mucosa gástrica – pH 1
Mucosa intestinal – pH 5
Plasma – pH 7,4
A equação de Henderson-Hasselbach pode ser empregada
na previsão do comportamento farmacocinético de
fármacos
Espécie ñ-ionizada = + lipossolúvel
HA
H3 O+ + AEspécies ionizadas = + hidrossolúveis
Meio extracelular
Meio intracelular
Suco gástrico
pH = 3
Acido Fraco
pKa 3,5
Xilocaína
Base Fraca
pKa 8,0
Concentração relativa
Aspirina
Ácido não
dissociado
AH
A
Plasma
pH = 7,4
ção
a
z
i
ion
a
ém
mp
e
r
H
Urina
pH = 8
lino
a
c
al
400
io
Ânion
100
> 0,1
Base
protonada
BH+
106
A io
niza
ç
ão é
m
aior
em
pH á
c
ido
100
30
Base livre
ALCALINIZAÇÃO DA URINA
ACELERA ELIMINAÇÃO DOS ÁCIDOS FRACOS
RETARDA A ELIMINAÇÃO DAS BASES FRACAS
ACIDIFICAÇÃO DA URINA
ACELERA A ELIMINAÇÃO DAS BASES FRACAS
RETARDA ELIMINAÇÃO DOS ÁCIDOS FRACOS
ADMINISTRAÇÃO INTRAVENOSA
BICARBONATO aumenta o pH da urina = facilita a eliminação dos
salicilatos = Importante para tratamento de uma superdosagem de
ASPIRINA.
FARMACOS ÁCIDOS
REAÇÃO INFLAMATÓRIA
N. Eng. J. Med.,1998, 338, 435-45.
CARACTERÍSTICAS DA REAÇÃO
INFLAMATÓRIA
CALOR
RUBOR
EDEMA
DOR
ANTI-INFLAMATÓRIOS
PERDA DA
FUNÇÃO
ÁCIDO ACETIL SALICÍLICO
Ácido orgânico fraco, pKa 3,5 - PK
HASac + H2O = ASac- + H3O+
absorvido no estômago e
principalmente no intestino.
Eliminado na forma de saliciliato.
Alcalinização da urina aumenta a
eliminação de salicilato. Diurese alcalina
MECANISMO DE AÇÃO DA ASPIRINA E SEUS EFEITOS FARMACOLÓGICOS
Inibe a BIOSSÍNTESE das prostaglandinas
MEDIADORES QUÍMICOS QUE PROVOVEM
INFLAMAÇÃO, AGREGAÇÃO PLAQUETÁRIA, DOR E FEBRE.
SOBREDOSE : Estimula o centro respiratório – hiperventilação – dimunição
da PCO2 - alcalose respiratória
FARMACOS BÁSICOS
Fármacos básicos
Anestésicos locais
pKa em torno de 8 a 9
Bloqueiam de modo reversível a condução de impulsos ao
longo dos axônios dos nervos e outras membranas
excitáveis que utilizam canais de sódio com principal meio
de geração de potenciais de ação.
Xilocaína
Anestésicos locais
São bases fracas e são apresentados geralmente na
forma de sais, por razões de estabilidade e solubilidade.
Apresentam pKa em torno de 8 a 9. No pH fisiológico
há uma fração maior da forma catiônica presente nos
líquidos corporais.
A forma catiônica é que tem atividade no local
receptor, embora a forma não ionizada é muito
importante para a penetração rápida de membranas
biológicas. Os receptores situam-se no lado interno da
membrana.
Tecidos infectados baixo pH extracelular
efeito.
pouco
Estudo dirigido
TRANSTORNO ACIDO-BÁSICO POR SUBERDOSAGEM DE SALICILATO
Criança, com três anos de idade, é trazida ao departamento de
emergência. Única história pertinente do menino foi encontrado
brincado com um vidro de comprimidos de aspirina. A gasometria do
sangue arterial revelou:
Limites confiáveis de normalidade:
pH : 7,47
PCO2 = 20 mmHg
PCO2
Bicarbonato
37 mmHg e 45 mmHg
22meq/l e 26 meq/l
[HCO3] = 14 mEq/l
Durante os 30 minutos seguintes, a criança ficou menos responsiva a
estímulos e a frequencia respiratória diminui.
1- identifique o transtorno ácidó-básico inicial.
2 - que ação a aspirina causa a diminuição da PCO2?
3 – O que é responsável pela queda nas [HCO3]?
4 – Se a criança não for tratada, qual transtorno ácido-basico ocorrerá em
seguida
5 – indique um possível tratamento
Algorítmo que permite determinar a causa do distúrbio ácido-básico
Qual é o pH?
ácido
básico
Excesso de
CO2 ?
não
É causado
pela
diminuição de
HCO3 ?
sim
sim
Acidose
respiratória
Acidose
metabólica
Qual é o
HCO3 ?
Qual é o
CO2 ?
alto
compensada
baixo
alto
misto
É causado pela
diminuição CO2 ?
não
não
não
Erro: checar
dados
É causado
pelo aumento
de HCO3 ?
sim
sim
Alcalose
metabólica
Alcalose
respiratória
Qual é o
CO2 ?
Qual é o
HCO3 ?
baixo
alto
compensada
compensada
baixo
alto
misto
baixo
compensada
RESPOSTAS
1- existe alcalose branda.
Algoritmo indica alcalose respiratória.
Bicarbonato normal é de 22 mEq/l (normal é de 24mEq/l), reduzido em 2 mEq/l devido a queda
de PaCO2
O Bicarbonato real é mais baixo, provavelmente a alcalose respiratória foi parcialmente
compensada pelo pela excreção renal de Bicarbonato
2- Os salicilatos estimulam diretamente o centro respiratório, aumentando a ventilação. Isso
provoca queda na PaCO2 e a alcalose respiratória é um achado inicial na superdosagem de
salicilatos
3 – A baixa de Bicarbonato resulta na compensação metabólica da alcalose respiratória.
Diminuição da reabsorção e aumento da excreção de Bicarbonato bicarbonato.
4 – acidose metabólica progressiva. Diminuição da freqüência respiratória pode
levar ao acumulo de CO2, que na presença de Bicarbonato reduzido, produzirá
acidose metabólica combinada a acidose respiratória
5 - alcalinização da urina com administração intravenosa de bicarbonato para pacientes
com acidemia relevante.
A alcalinização mantém os salicilatos ionizados no sangue e evita sua penetração nos
tecidos. Esse processo também auxilia na eliminação dos salicilatos na urina. pH urinário
acima de 8.