ICET – Instituto de Ciências Exatas e Tecnologia
Química Aplicada - Prof. Barbieri
2 Lista de Exercícios – QI gabarito
Questão 1. O que é corrosão e suas conseqüências?
A corrosão é um tipo de degradação espontânea e irreversível em um material metálico.
Suas conseqüências da Corrosão são:
Reposições e conseqüentes despesas com minérios, energia e mão de obra;
Custos e manutenção de processos de proteção;
Emprego de materiais mais caros (ex:aço inoxidável) em substituição a outros mais baratos;
Superdimensionamentos;
Interrupções na produção;
Perdas de produtos; queda de rendimento;
Contaminações de produtos;
Eventuais riscos em potencial de acidentes e poluições de ambientes de trabalho;
Questão 2. Explique sobre a instabilidade termodinâmica dos metais.
A instabilidade termodinâmica dos metais em geral, faz com que os mesmos apresentem a tendência
natural de atingirem um estagio mais estável por meio de formação de compostos metálicos
(minérios).
O processo espontâneo (natural) é chamado CORROSÃO e ocorre devido a reação (eletroquímica) do
metal com os agentes presentes no meio considerado.
Por exemplo o ferro elementar é termodinamicamente instável, como os demais metais, e tende a
voltar ao seu estado mais estável (oxido) oxidando (processo corrosivo), sendo esta a causa básica da
corrosão.
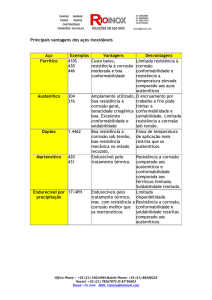
Questão 3. Explique sucintamente sobre:
- Corrosão atmosférica
- Corrosão uniforme
- Corrosão por placas
- Corrosão por pites
- Corrosão por lixiviação
- Corrosão erosão
- Corrosão sob tensão
- Corrosão por frestas
- Corrosão em ranhuras
- Corrosão em canto vivo
- Corrosão galvânica
Corrosão Uniforme
Ataque de toda a superfície metálica
Diminuição da espessura
Formação de pilhas de ação local
Desgaste de fácil acompanhamento
Leva a falhas significativas do equipamento
Corrosão por placas:
Produtos de corrosão formam-se em placas que se desprendem progressivamente.
É comum em metais que formam película inicialmente protetora mas que, ao se tornarem espessas,
fraturam e perdem aderência, expondo o metal a novo ataque;
Corrosão por Pites
Localizada, com formação de cavidades de pequena extensão e razoável profundidade.
Característica de materiais metálicos formadores de películas protetoras (passiváveis)
Pilha ativa-passiva, com rompimento da camada passiva
Pequena área anódica e grande área catódica
Difícil acompanhamento
Corrosão por lixiviação
Ataque às superfícies, essa corrosão forma laminas de material oxidado e se espalha por debaixo dele
até camadas mais profundas.
O combate a essa floculação é feito normalmente com tratamento térmico.
Corrosão-erosão
Erosão – desgaste mecânico provocado pela abrasão superficial de uma substância sólida, líquida ou
gasosa.
Desgaste maior do que se apenas o processo corrosivo ou erosivo agisse isoladamente.
Tubulações, permutadores, pás de turbina.
Corrosão sob tensão
Material submetido a tensões de tração, aplicadas ou residuais, é colocado em contato com um meio
corrosivo específico.
Fatores decisivos: dureza, encruamento, fases presentes.
Propagação de trinca por corrosão sob tensão é geralmente lenta, até atingir o tamanho crítico para
uma ruptura brusca.
Corrosão em frestas
Pilhas de aeração diferencial (meio gasoso) e de concentração iônica diferencial (meio
líquido)
Juntas soldadas com chapas superpostas, juntas rebitadas, ligações roscadas, revestimentos com chapas
aparafusadas.
Evitar frestas.
Corrosão por Concentração Diferencial
Pilhas de concentração iônica diferencial e Pilhas de aeração diferencial
Ânodo – área com menor concentração
Cátodo – área com maior concentração.
Corrosão Galvânica
Pilhas de eletrodos diferentes.
Maior ddp, maior corrosão.
Menor relação entre área catódica e anódica => desgaste menor e mais uniforme da área anódica.
Presença de íons metálicos (de materiais mais catódicos) no eletrólito => oxidação do metal, devido à
redução destes íons..
Questão 4. Considere a pilha galvânica representada a baixo, através da tabela de potencial de
redução:
Ni / Ni+2 // Cu+2 / Cu
Co / Co+2 // Au+3 / Au
Zn / Zn+2 // Cu+2 / Cu
Calcule a ddp da seguinte pilha
Ni / Ni+2 // Cu+2 / Cu
E0 = +0,34 – (- 0,25) = 0,58V
E0 = + 0,34V
Co / Co+2 // Au+3 / Au
E0 = +1,50 – (- 0,28) = 1,78V
Zn / Zn+2 // Cu+2 / Cu
Questão 5. Considere a pilha galvânica representada a baixo:
Ni0 / Ni+2 // Cu+2 / Cu0
Calcule:
1. Quais as semi-reações e a global?
2. Quem é o catodo e o anodo?
3. Quem se oxida e se reduz?
4. Qual o sentido dos elétrons pelo fio condutor?
5. Qual o sentido dos íons pelo circuito interno?
6. Qual solução irá se diluir e se concentrar?
Questão 6. Sabendo-se que o cobalto pode ceder elétrons espontaneamente para o íon Au+3, pede-se:
Co0 / Co+2 // Au+3 / Au0
Calcule:
1. Quais as semi-reações e a global?
2. Quem é o catodo e o anodo?
3. Quem se oxida e se reduz?
4. Qual o sentido dos elétrons pelo fio condutor?
5. Qual o sentido dos íons pelo circuito interno?
6. Qual solução irá se diluir e se concentrar?
Questão 7. A corrosão de ferro metálico envolve a formação envolve a formação de íons Fe2+. Para
evitá-la, chapas de ferro são recobertas por uma camada de outro metal. Em latas de alimentos a
camada é de estanho metálico e em canos d'água, de zinco metálico.
Explique por que:
a) a camada de zinco evita a corrosão de canos d'água;
b) quando a camada de estanho é danificada, expondo a camada do ferro, a corrosão
acontece mais rapidamente do que quando a referida camada está ausente.
Dados: Potenciais padrões de redução a 25°C.
Zn2+ + 2e Zn(s) E0 = - 0,763 V
Fe2+ + 2e Fe(s) E0 = - 0,409 V
Sn2+ + 2e Sn(s) E0 = - 0,136 V
a) O zinco por apresentar menor potencial de redução que o cano de ferro, atua como
eletrodo de sacrifício, ele é corroído enquanto o ferro está a salvo no estado reduzido.
b) Este fato ocorre devido ao estanho ter maior tendência a se reduzir frente ao ferro, este
último em contato com o oxigênio atmosférico terá uma rápida oxidação.
Questão 8. Nas semi-reações:
Ni2+ (aq.) + 2 e Ni0 (s)
Ag+1 (aq.) + 1 e Ag0 (s)
A ddp da pilha, o cátodo e o ânodo são, respectivamente:
Dados: E°red.Ag = + 0,80V; E°red.Ni = - 0,24V (a 25°C e 1 atm.)
a) + 1,04 V, prata, níquel.
b) + 1,04 V, níquel, prata.
c) - 0,56 V, prata, níquel.
d) - 1,04 V, níquel, prata.
e) + 0,56 V, prata, níquel
E° = E°maior – E°menor E° = +0,8 – (-0,24) E° = +1,04V
Cátodo – Ag
Ânodo - Ni
Resposta: letra A
Questão 9. O que é Proteção catódica e Proteção anódica.
Proteção catódica é um processo de controle contra a corrosão de metais (tubulações e estruturas). O
princípio básico é tornar o elemento metálico a ser protegido - um aqueduto, por exemplo - em um cátodo
de uma célula de corrosão, o que pressupõe a presença de um ânodo. Assim, o processo natural de perda
de elétrons da estrutura para o meio, fenômeno que causa a corrosão, é compensado pela ligação da
estrutura metálica a um ânodo de sacrifício, em geral, um eletrodo de cobre/sulfato. O direcionamento da
corrente elétrica preserva a estrutura metálica, ocorrendo corrosão controlada no ânodo.
É bom lembrar que a proteção catódica é um processo anticorrosivo ativo - em que é possível ajustar a
eficiência às necessidades operacionais - que complementa a proteção proporcionada pelo revestimento
externo/interno das tubulações. É o único processo capaz de eliminar a corrosão eletroquímica e eletrolítica,
mesmo em estruturas não-revestidas.
Os mecanismos de proteção catódica para estruturas metálicas são dois: galvânica (PCG) e por corrente
impressa (PCCI). Para a PCG, é feita a instalação de um ânodo galvânico paralelo à tubulação, e para a
PCCI, a estrutura metálica é ligada a um retificador de corrente elétrica. No decorrer da vida da estrutura,
como o revestimento externo perde eficiência por causa da interação com o eletrólito, torna-se necessário
aumentar a intensidade da corrente de proteção produzida pelo retificador. Os períodos de
revisão/manutenção da estrutura e do sistema de proteção são estimados em 20 anos para corrente
impressa e cinco anos para proteção galvânica.
A proteção anódica é um método de aumento da resistência à corrosão que consiste na aplicação de uma
corrente anódica na estrutura a proteger. A corrente anódica favorece a passivação do material dando-lhe
resistência à corrosão. A proteção anódica é empregada com sucesso somente para os metais e ligas
formadores de película protetoras, especialmente o titânio, o cromo, ligas de ferro-cromo, ligas de ferro-cromoníquel.
O seu emprego encontra maior interesse para eletrólitos de alta agressividade (eletrólitos fortes), como por
exemplo um tanque metálico para armazenamento de ácidos.
A proteção anódica não só propicia a formação da película protetora mas principalmente mantém a
estabilidade desta película. O emprego de proteção anódica é ainda muito restrito no Brasil, porém tem grande
aplicação em outros países na indústria química e petroquímica.
Questão 10. Quais sãos os tipos de revestimento que servem para minimizar o processo de corrosão.
Revestimentos Metálicos:
Trata-se da aplicação de filmes metálicos sobre a superfície do metal.
Analisando os potenciais relativos do metal de cobertura e do metal base frente ao meio eletrolítico
considerado podemos ter as situações seguintes:
1a) Caráter Anódico:
Quando o metal de cobertura apresenta maior potencial de oxidação que o metal base.
1b) Caráter Catódico:
Quando o metal de cobertura apresenta maior potencial de redução que o metal base.
A análise do caráter do revestimento metálico a ser aplicado é especialmente importante, pois
todos os revestimentos preparados comercialmente apresentam porosidade em maior ou menor
grau.
Além disso tais revestimentos podem sofrer trincas ou rupturas durante o uso ou transporte. Assim,
os metais ficam expostos ao meio agressivo, sofrendo corrosão o metal de cobertura ou o metal
base em função do revestimento ser anódico ou catódico respectivamente.
Revestimento não Metálicos Inorgânicos
Trata-se de substâncias inorgânicas formadas ou depositadas sobre a superfície metálica. Podem ser
óxidos, cimentos, carbetos, nitretos, vidros, esmaltes vitrosos, porcelanas e outros.
Os óxidos, carbetos e nitretos são empregados geralmente para revestimentos que resistem a altas
temperaturas.
Os revestimentos obtidos pela deposição de produtos de reação química que ocorrem entre o metal e
um meio adequado, protegem o material metálico contra posterior ação agressiva. Assim, uma solução
de ácido sulfúrico ataca o chumbo formando sulfato de chumbo que por ser insolúvel acaba
protegendo o chumbo da ação do ácido.
Entre os processos mais usados para a obtenção de revestimentos inorgânicos estão a anodização, a
cromatação e a fostatização.
Revestimento não Metálicos Inorgânicos
1) Anodização
Em certos casos, o próprio produto da corrosão do metal reveste a superfície chegando mesmo a
proteger o metal conforme sua aderência e uniformidade.
É o caso do Alumínio que apresenta grande resistência à corrosão atmosférica devido a camada de
óxido que se forma e recobre o metal tão logo ele é exposto no ar. Devido a aderência e alta
resistividade elétrica apresentada pela camada ela acaba protegendo o metal.
2) Cromatação
As soluções de cromatos e dicromatos (7,5 pH 9,5) passivam o ferro e o aço, possivelmente devido
a formação de micro-película protetora de Fe2O3, (magnético) e Cr2O3.
A concentração de cromatos usadas é da ordem de 0,1%, mas cresce principalmente em presença do
ânion Cl-. A concentração do inibidor, para exercer ação protetora deve manter-se acima de certo valor
crítico, em todas as partes do sistema, pois do contrário terá a formação de elementos de corrosão do
tipo ativo-passivo.
Fosfatização
Consiste na adição de uma camada de fosfatos à superfície metálica. A camada de fosfatos inibe
processos corrosivos e constitui-se, quando aplicada em camada fina e uniforme, em uma excelente
base para pintura, em virtude da sua rugosidade.
A fosfatização é um processo largamente empregado nas indústrias automobilísticas e de
eletrodomésticos. Após o processo de desengraxe da superfície metálica, aplica-se a fosfatização,
seguindo-se a pintura;
Revestimentos Orgânicos
Consiste na interposição de uma camada de natureza orgânica entre a superfície metálica e o meio
corrosivo. Os principais revestimentos orgânicos são os seguintes:
Pintura industrial: é um revestimento, em geral orgânico, largamente empregado para o controle de
corrosão em estruturas aéreas e, em menor escala, em superfícies enterradas ou submersas.
O revestimento por pintura é empregado para estruturas submersas que possam sofrer manutenção
periódica em dique seco, tais como navios, embarcações, bóias, etc. Só em casos especiais é
empregado em estruturas enterradas, pela dificuldade de manutenção apresentada nestes casos.
Revestimento com borrachas: consiste o recobrimento da superfície metálica com uma camada de
borracha, utilizando-se o processo de vulcanização. É um revestimento que pode assumir diversas
durezas dependendo do tipo de borracha e do processo de vulcanização.
Este revestimento é utilizado na indústria química em equipamentos e tubulações que trabalham com
meios altamente corrosivos, especialmente ácidos. O tipo de borracha é selecionado em função destas
características de agressividade;
Revestimentos para tubulações: enterradas ou submersas: as tubulações enterradas ou submersas,
oleodutos, gasodutos, adutoras, etc. são, em geral, protegidas contra a corrosão por revestimentos de
alta espessura.
O mecanismo básico de proteção é por barreira entre o metal e o meio corrosivo. Por melhor que seja o
revestimento, a eficiência é sempre inferior a 100%, surgindo, então, a necessidade de
complementação com o uso de proteção catódica.