LIVRO 2 | QUÍMICA 2
Resoluções das Atividades
Sumário
Módulo 4 – Sal orgânico, anidrido de ácido carboxílico e haleto de ácido, amina, amida, isonitrila e nitrocomposto – Nomenclaturas e aplicações ...........................1
Módulo 5 – Isomeria plana e estereoisomeria configuracional geométrica...............................................................................................................................................3
Módulo 6 – Estereoisomeria configuracional óptica, diastereoisômeros e mesocomposto .................................................................................................................... 5
III. Componente em bebidas ⇒
Módulo 4
Sal orgânico, anidrido de ácido carboxílico e haleto
de ácido, amina, amida, isonitrila e nitrocomposto –
Nomenclaturas e aplicações
Atividades para Sala
(Lista 2 ⇒ f)
(Lista 2 ⇒ g)
IV. Vinagre ⇒
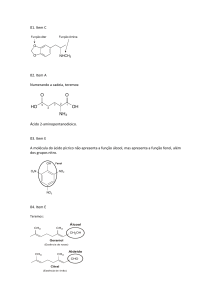
03 B
A reação de saponiicação transforma um éster em um sal
de ácido carboxílico, que é o sabão, e um álcool.
(1)
(C3H8O)
(2)
(C4H8O)
04 E
O
C = O Amida, R – C
NH2
H2N
H2N
(3)
(4)
(5)
(C3H6O)
(C3H6O2)
(C4H6O3)
(6)
–
–
–
=
01 B
05 A
Ácido etanoico ⇒
por:
Cloreto de etanoíla
Cl ⇒
NH2 ⇒
(C3H4O4)
Etanamida
Etanal
H ⇒
CH3 ⇒
02 C
substituindo a hidroxila
Propanona
Lista 1
06 C
Ácido carboxílico
O
OH
–
II. Anestésico primitivo ⇒
(Lista 2 ⇒ b)
O
(Lista 2 ⇒ c)
NH2
+
I. Solvente para tirar esmalte de unha ⇒
O, Na
Sal orgânico
Amina
Pré-Vestibular | 1
LIVRO 2 | QUÍMICA 2
Atividades Propostas
08 B
N
A acroleina,
, é um aldeído de nome
C
CH3 Éster
H
C–O–C–
O
H
Éster
Amina
propenal.
O
–
C–
=
01 C
02 D
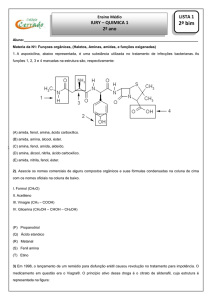
I. Formol ⇒ Metanal (R)
II. Acetileno ⇒ Etino (T)
III. Vinagre ⇒ Ácido etanoico (Q)
IV. Glicerina ⇒ Propanotriol (P)
09 E
03 E
Éster
I. (V) O sabão produz mais CO2, que é um dos responsáveis pelo efeito estufa.
II. (V) O detergente apresenta mais nitrogênio e enxofre,
componentes da chuva ácida.
III. (V) A demanda bioquímica do sabão é bem maior, portanto, apresenta menos oxigênio dissolvido na água.
Amida
04 A
a) (V) Os sabões são sais de ácido carboxílico, sais de amônio quaternário ou sais de ácido sulfônico de cadeias
longas, possuindo parte da cadeia apolar e grupo do
sal que é polar.
b) (F) O álcool possui fórmula C2H6OH.
c) (F) A água sanitária apresenta hipoclorito de sódio.
d) (F) Não existe hipoclorito de sódio nos desinfetantes.
05 E
•
•
•
•
•
O
=
CH3
Álcool terciário
10 E
Dopamina: fenol e amina.
Serotonina: fenol e amina.
Epinefrina: fenol, álcool e amina.
Etilfenilamina: amina.
Norepinefrina: fenol, álcool e amina.
I. Fenol, álcool e amina
II. Álcool e amina
III. Amina.
11 A
06 A
Amida
Amina terciária
a) (V)
b) (F) Ácido but-2-enoico e nitrocomposto (nitrobenzeno).
c) (F) Anidrido de ácido (anidrido etanoico) e nitrila (benzonitrila).
d) (F) 1-clorobutano e ciclohexilmetanamida.
12 E
07 C
a)
b)
c)
d)
(F) A substância não é um alceno, ela é uma amina.
(F) Não possui –OH que caracteriza um álcool.
(V)
(F) A fórmula molecular é C10H14N2.
e) (F) Não possui o grupo
uma amida.
2 | Pré-Vestibular
que caracteriza
a) (F) O composto não é amida, e sim amina.
b) (F) As aminas possuem caráter básico por apresentarem um par de elétrons não ligantes no nitrogênio.
c) (F) O ácido clorídrico pode ser neutralizado pelo caráter básico das aminas.
d) (F) A amina terciária (III) não apresenta hidrogênio
ligado diretamente ao nitrogênio.
e) (V) A amina III, por não fazer ponte de hidrogênio
com a água, apresenta menor solubilidade que as
demais aminas.
LIVRO 2 | QUÍMICA 2
Isomeria plana e estereoisomeria
coniguracional geométrica
Módulo 5
06 A
A dupla ligação que não é conjugada com a carbonila
Atividades para Sala
é a dupla central da cadeia.
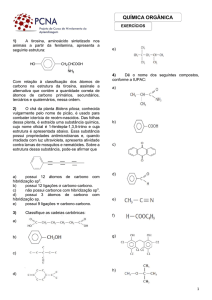
01 A
O etanoato de etila apresenta a fórmula estrutural:
O isômero de função que apresenta cadeia ramiicada com
a mesma fórmula molecular (C4H8O2) é o ácido 2-metilpropanoico.
'
Os grupos de prioridade maior estão em lados opostos ao
plano, sendo o composto classificado como trans ou “E”.
Atividades Propostas
01 C
A → Funções diferentes sem equilíbrio ⇒ Isomeria de junção
B → Funções diferentes com equilíbrio ⇒ Tautomeria
02 D
Os dois compostos diferem entre si na posição da dupla
ligação da parte alifática da cadeia. Sendo classificados
como isômeros de posição.
C → Mesma junção com cadeias diferentes ⇒ Isomeria de
cadeia
D → Mesma junção com mesma cadeia principal ⇒ Isomeria de posição
E → Mesma junção com mudança na posição do heteroátomo ⇒ Metameria
03 C
Isômero
de função
Isomeria de compensação
(metameria)
1-butanol
02 a)
Ácido propanoico
b)
2-Metilpropan-1-ol
c)
2-Metilpropanal
Metoxipropano
04 D
Os dois compostos diferem entre si na configuração da
dupla ligação que apresenta a hidroxila (–OH), sendo classificados como isômeros geométricos.
05 C
Butan-2-ona
d)
03 D
a) (F) 2 - metilbutan-1,3-dieno
b) (F) Apresenta quatro carbonos insaturados.
Apolar
Polar
O composto trans apresenta interações intermoleculares
fracas típicas de moléculas apolares, possuindo temperaturas de ebulição menor que o composto cis (polar).
c) (F)
1
2
4
3
C6H10
5
≠
C5H8
Pré-Vestibular | 3
LIVRO 2 | QUÍMICA 2
d) (V)
e) (F) Tautomeria não pode ser observada em estruturas
sem heteroátomo e, hidrocarboneto não apresenta
isomeria funcional.
04 E
Os dois hidrocarbonetos devem ser apolares e solúveis
entre si.
n-heptano
C7H16
09 E
I. (F) A estrutura A é insaturada correspondendo a um
óleo, enquanto B é saturada e corresponde a uma
gordura.
II. (V) Cada mol de A possui 5 mol de duplas ligações
entre carbonos, necessitando de 5 mols de H2 para
sofrer adição e se transformar em 1 mol de B.
III. (V) A estereoisomeria geométrica estuda as estruturas
cis e trans.
10 C
2,2,4-trimetilpentano
C8H18
A reação de retinal para a formação da vitamina A trans-
05 B
Os dois compostos apresentam a mesma fórmula molecular, mas pertencem a funções orgânicas diferentes.
CH3—CH2—CH2—CH2—CH2—COOH
forma aldeído
em álcool, sendo classifi-
Ácido carboxílico
cada como uma redução.
A isomeria que o retinal apresenta em relação ao neoretinal é na mudança, na configuração de uma dupla ligação,
chamada de isomeria geométrica.
éster
06 E
I. (V) Os isômeros possuem a mesma fórmula molecular
e podem apresentar propriedades físicas, químicas
e isiológicas diferentes.
II. (V) O propanal (
mero de função da propanona (
C3H6O).
⇒ C3H6O) é isô⇒
III. (V) A propilamina (CH3—CH2—CH2—NH2) é isômera
de cadeia da trimetilamina (
).
IV. (V) A tautomeria é conhecida como isomeria dinâmica.
V. (V) O 1-buteno (CH3–CH2–CH=CH2) não possui isomeria geométrica, pois apresenta grupos iguais
ligados a um mesmo carbono da dupla. O composto 1-buteno é isômero de posição 2-buteno
(CH3–CH=CH–CH3).
07 A
Os compostos são isômeros, pois apresentam a mesma
fórmula molecular, diferindo um do outro pela configuração da segunda dupla ligação após o grupo funcional,
podendo ser chamado de 11-trans-retinal.
11 B
O butano CH3CH2CH2CH3 (C4H10), admite como isômero
de cadeia um composto de mesma fórmula molecular.
Assim, para cada item, temos:
a) C4H8
b) C4H10
c) C3H6
d) C3H6
e) C4H8
12 A
Os compostos:
I. etoxietano ⇒ CH3—CH2—O—CH2—CH3 (C4H10O ⇒éter)
II. ácido etanoico ⇒
(C2H4O2 ⇒ ácido car-
boxílico)
III. álcool benzílico ⇒
(C7H8O ⇒álcool)
IV. éter etilpropílico ⇒ CH3—CH2—O—CH2—CH2—CH3
(C5H12O ⇒éter)
08 E
I. (V) O composto representado é cis, possuindo o estereoisômero trans.
II. (V) Ácidos graxos são de cadeia longa com um grupo
de ácido carboxílico.
III. (V) Possui fórmula C22H42O2.
4 | Pré-Vestibular
V. 1-hidróxi-2-metilbenzeno ⇒
(C7H8O ⇒fenol)
LIVRO 2 | QUÍMICA 2
VI. metanoato de etila ⇒
⇒éster)
05 B
(C3H6O2
São isômeros funcionais os compostos que possuem a
mesma fórmula molecular, mas pertençam à funções orgânicas diferentes (III e V).
II
III
1444442444443
Módulo 6
Estereoisomeria coniguracional óptica,
diaste-reoisômeros e mesocomposto
Atividades para Sala
01 C
a) (F) Os dois não são isômeros.
b) (F) Não possuem a mesma fórmula molecular.
c) (V) O carbono que possui o grupo amina (–NH2) é quiral, nas duas substâncias.
d) (F) Não possuem dupla ligação entre carbonos.
e) (F) A tautomeria ocorre basicamente com aldeído ou
cetona. Nas substâncias temos ácido carboxílico, amina
e tioéter (metionina), tioálcool, amina e ácido (cisteína).
Par de diastereoisômeros (não formam o par objeto-imagem porque não são sobreponíveis).
Obs.:
III e IV são estereoisômeros, assim como I e II;
II e III são diastereoisômeros.
06 B
a) (F) O composto não possui carbono quiral.
b) (V) A glicose
possui 4 carbonos quirais.
c) (F) O cis-1,2-diclorociclopropano apresenta plano de
simetria.
02 D
Não há centro estereogênico da molécula, nem tampouco
observa-se assimetria na sua configuração. Portanto, não
há atividade óptica.
03 A
O ácido lático apresenta cadeia homogênea e massa
molar 90 g/mol, bem como as funções álcool e ácido carboxílico, possuindo 1 carbono quiral e 2 estereoisômeros
ativos (os enanciômeros).
Plano de simetria
não
d) (F) O composto
possui isomerismo geométrico, pois no carbono 1
da dupla existem 2 hidrogênios.
04 B
Atividades Propostas
II (trans)
01 B
III (cis)
Diastereoisômeros (não formam o par objeto-imagem)
Obs.:
I e II são enantiômeros;
III e IV são o mesmo composto.
O único carbono cujos quatro ligantes são diferentes é o
g. Os carbonos benzílicos e os alquílicos não produzem
estereoisomeria.
Pré-Vestibular | 5
LIVRO 2 | QUÍMICA 2
02 D
06 D
A molécula de aspirina não apresenta carbono quiral, por
isso não possui isomerismo óptico.
A molécula de vitamina C possui dois carbonos quirais.
Os dois compostos são um a imagem do outro no espelho, são assimétricos e consequentemente enanciômeros
(apresentando configurações espaciais diferentes).
07 B
A molécula I apresenta uma cadeia aberta (acíclica) e é
aquiral (possui plano de simetria). As moléculas II e III são
moléculas que apresentam anéis (sistemas cíclicos) em
suas estruturas com 2 e 6 centros estereogênicos, respectivamente.
*
*
Obs.: I chama-se ácido trans-2-undecenodioico.
08 B
Os dois compostos apresentam a mesma fórmula molecular com carbono assimétrico. Assim, o odor do limão e o
odor da laranja são enantiômeros (um a imagem especular
não superponível do outro), sendo classiicados como isômeros ópticos.
03 D
*
*
09 E
1. Isômeros cis-trans (geométricos).
2. Possuem carbono quiral e são isômeros ópticos.
3. Apresentam o mesmo esqueleto com posições diferentes da dupla ligação.
10 B
Na estrutura, existem 2 carbonos assimétricos (marcados
com asteriscos), apresentando atividade óptica.
* dois centros estereogênicos
Me
04 F, F, F, V, V
a) (F) O nome do composto é 3-fenilpropenal.
b) (F) O composto II (ciclohexilamina) não possui carbono
assimétrico.
c) (F) O composto III apresenta a função éster (
*
*
).
Me
Me
d) (V) O composto IV apresenta a função fenol (Ar–OH), a
função éter (Ar–OCH3) e a função aldeído (
).
e) (V) Apresenta uma dupla na cadeia aberta, onde em
cada carbono da dupla existem grupos diferentes.
05 B
a) (F) Os dois compostos não são isômeros (fórmulas
moleculares diferentes).
b) (V) São isômeros de posição e possuem carbono quiral.
c) (F) Os dois possuem as mesmas funções (amina e ácido).
d) (F) São opticamente ativos e apresentam as mesmas
funções.
e) (F) Não são isômeros.
6 | Pré-Vestibular
11 C
a)
b)
c)
d)
e)
(F)
(F)
(V)
(F)
(F)
Só II representa estereoisômeros.
Em I, há diastereoisômeros.
Isômeros funcionais.
Ambos são trans.
12 E
a) (F) Não há centros estereogênicos nem assimetria
molecular em ambas.
b) (F) Não há centros estereogênicos nem assimetria
molecular em II.
c) (F) Não há aldeído ou enol.
d) (F) I é fenol.
e) (V) Há dupla com ligantes diferentes.