UNIDADE 3 - CINÉTICA QUÍMICA
CAPÍTULO 1 − VELOCIDADE DA REAÇAO.................................................................................................................2
Conceito...........................................................................................................................................................................2
Velocidade média............................................................................................................................................................2
Velocidades de formação e de desaparecimento.............................................................................................................4
Medida da velocidade......................................................................................................................................................6
Velocidade imensurável..............................................................................................................................................6
Velocidade mensurável...............................................................................................................................................6
Processos químicos................................................................................................................................................6
Processos físicos.....................................................................................................................................................6
CAPÍTULO 2 − FATORES QUE INFLUEM NA VELOCIDADE....................................................................................7
Introdução........................................................................................................................................................................7
Estudo dos fatores............................................................................................................................................................7
1º fator: colisão entre as moléculas reagentes.............................................................................................................7
2º fator: energia de ativação........................................................................................................................................7
3º fator: temperatura....................................................................................................................................................9
4º fator: concentração dos reagentes.........................................................................................................................10
5º fator: pressão.........................................................................................................................................................12
6º fator: estado sólido................................................................................................................................................13
CAPÍTULO 3 − CATÁLISE..............................................................................................................................................15
Conceitos.......................................................................................................................................................................15
A ação do catalisador.....................................................................................................................................................15
Catálise...........................................................................................................................................................................16
Inibidor...........................................................................................................................................................................17
Ativador ou promotor....................................................................................................................................................17
Veneno...........................................................................................................................................................................17
EXERCÍCIOS DE APRENDIZAGEM..............................................................................................................................18
EXERCÍCIOS DE FIXAÇÃO............................................................................................................................................22
EXERCÍCIOS COMPLEMENTARES..............................................................................................................................22
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 2
CAPÍTULO 1 − VELOCIDADE DA REAÇAO
Conceito
Cinética química é o ramo da Química que estuda a velocidade de uma reação, bem como os fatores
que a influenciam. Você já sabe, através da observação cotidiana, que os processos químicos podem ser
lentos ou rápidos. Observe:
Assim, com a finalidade de caracterizar a lentidão ou a rapidez com que as reações ocorrem, foi
introduzida a grandeza velocidade de reação.
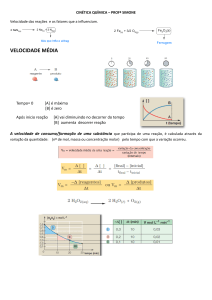
Velocidade média
Velocidade média de uma reação é a razão entre a
variação do número de moles de um participante e o intervalo
de tempo gasto nessa variação:
Analisemos, então, o que ocorre com a reação: C2H2 + 2H2 C2H6. Um químico, medindo o número
de moles do participante C2H6 em função do tempo e nas condições em que a reação se processa, obteve os
seguintes resultados:
Tempo (min)
Número de moles de C2H6 formados
0
0
4
12
6
15
10
20
Vamos, então, calcular a velocidade média dessa reação no intervalo de 0 min a 4 min:
Isso significa que, nesse intervalo, a cada minuto formam-se em média 3 moles de C2H6. Vamos
admitir, agora, que o químico descubra o número de moles dos participantes C2H2 e H2 nos tempos indicados
para o C2H6 e organize assim a tabela:
Tempo (min)
0
4
6
10
Número de moles de C2H2 presentes
50 38 35 30
Número de moles de H2 presentes
60 36 30 20
Número de moles de C2H6 presentes
0
12 15 20
Se você calcular a velocidade média da reação em função do C 2H2, no intervalo de 0 min a 4 min,
empregando a fórmula dada, encontrará:
Note que encontramos o mesmo valor referente ao C 2H6, no mesmo intervalo, porém com valor
negativo. A fim de evitar que isso ocorra, devemos colocar o sinal negativo na fórmula, para que o valor da
velocidade da reação seja o mesmo para qualquer participante no mesmo intervalo.
Então, para os produtos usamos a fórmula com sinal positivo (caso do
C2H6), e para os reagentes, a fórmula com sinal negativo (caso do C2H2). Logo:
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 3
Vamos, agora, calcular a velocidade média da reação no intervalo de 0 min a 4 min em função do H2:
Note que obtivemos novamente valor negativo, pois o H2 é reagente. Assim, conforme vimos,
devemos colocar o sinal negativo na fórmula. Entretanto, o valor numérico encontrado é o dobro do valor
referente ao C2H6 no mesmo intervalo. Então, devemos dividir 6 por 2 para encontrarmos 3: 6 ÷ 2 = 3
Mas, o que é o 2? Onde encontrá-lo? Ele é obtido a partir da análise dos coeficientes da equação
química correspondente:
Vejamos o cálculo da velocidade média num outro intervalo, por exemplo, de 6 min a l0 min:
Observe que para todos os participantes da reação obtivemos o mesmo valor da velocidade média da
reação. Considerando, então, uma reação genérica, temos:
Vm =
-VA
a
=
-VB
b
=
VC
c
=
VD
d
Exercícios resolvidos
ER1. Um analista, efetuando medidas do número de moles da substância H2 para a reação de formação do
NH3, (N2 + 3H2 2NH3.) obteve, em função do tempo, a seguinte tabela:
Tempo (min)
0
5
15
Número de moles de H2 existentes
20,0 10,0 2,5
Calcular a velocidade média da reação nos intervalos de 0 min a 5 min e de 5 min a 15 min.
Resolução:
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 4
ER2. A tabela abaixo mostra a variação da massa de SO2 em função do tempo para a reação: 2SO2 + O2
2SO3:
Tempo (min)
0
8
10
Massa de SO2 presente (g)
35
15
10
Calcular a velocidade média da reação no intervalo de 8 min a 10 min.
Resolução: Na fórmula da velocidade média, podemos substituir a variação do número de moles ∆n
pela variação da massa ∆m:
ER3. Ao adicionarmos ferro a uma solução de HCl, ocorre a reação: Fe + 2HCl FeCl2 + H2. Medindo a
concentração molar de HCl, encontramos:
Tempo (min)
0
5
8
Concentração molar do HCl: [HCl] (mol/l) 0,200 0,115 0,100
Calcular a velocidade média da reação no intervalo de 5 min a 8 min. Resolução:
Na fórmula da velocidade média, podemos substituir a variação do número de moles ∆n pela
variação da concentração molar ∆[ ]: Fe + 2HCl FeCl2 + H2.
Exercícios: EA1; EA2; EA3; EA4; EA5; EA6.
Velocidades de formação e de desaparecimento
Suponhamos um recipiente de V litros de capacidade no qual realizaremos o processo:
2O3
3O2
(Desaparecimento de ozone com formação de oxigênio.)
Ozone
oxigênio
Observe que para cada 2 moles de ozone que desaparecem há a formação de 3 moles de oxigênio.
Vamos admitir, para esse processo, as seguintes medidas:
Tempo (s)
Número de moles de O3 (ozone)
Número de moles de O2 (oxigênio)
0
2,0
0,0
5
1,5
0,75
7
0,5
2,25
Note que os valores tabelados obedecem à relação, em moles, indicada na equação. Veja:
No início (t = 0s), o número de moles de O3 é 2,0 e o de O2 é zero, pois ainda não houve formação de O2.
No tempo t = 5s, o número de moles de O 3 é 1,5. Isso significa que 0,5 mol (2,0 - 1,5) de O 3 desapareceu,
dando origem a 0,75 mol de O2:
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 5
No tempo t = 7s, o número de moles de O 3 é 0,5. Isso significa que 1,0 mol (1,5 - 0,5) desapareceu,
dando origem a 1,5 mol de O2, o qual, somado com 0,75 mol já existente no tempo t = 5s, nos dá 2,25 moles
de O2:
Agora, vamos calcular a velocidade média (Vm) da reação: 2O3
Intervalo
2O3
3O2.
Reação
3O2.
De 0s a 5s
De 5s a 7s
Exercício resolvido
ER4. Dado o processo 3C2H2 (acetileno ) C6H6, (benzeno) determinar a velocidade de formação do
benzeno em função da velocidade de desaparecimento do acetileno. Resolução: 3C2H2 C6H6:
Exercícios: EA7; EA8; EA9; EA10; EA11.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 6
Medida da velocidade
Com relação à medida da velocidade, as reações podem apresentar velocidade imensurável e
velocidade mensurável.
Velocidade imensurável
Algumas reações, tais como as explosivas e as de precipitação, são tão rápidas que podem ser
consideradas instantâneas. Evidentemente nesses casos a velocidade não pode ser medida.
Entretanto, outras são tão lentas que a medida da velocidade se torna também impraticável. É o caso,
por exemplo, da formação de água a partir de hidrogênio e oxigênio a 0°C e na ausência de catalisador (neste
caso, para obtermos, por exemplo, 18 g de água seriam necessários alguns séculos). Assim, temos:
Velocidade mensurável
Muitas reações ocorrem com uma velocidade suscetível de ser medida na prática. Essa medida pode
ser feita através de processos químicos ou processos físicos.
Processos químicos
Considere um sistema no qual está ocorrendo uma reação cuja velocidade queremos determinar. Em
diferentes intervalos de tempo retiramos uma amostra do sistema e fazemos uma análise quantitativa (de
preferência uma dosagem volumétrica) de uma das substâncias participantes (escolhemos, evidentemente, a
mais favorável à dosagem).
Assim, por exemplo, vamos supor que queiramos determinar a velocidade da reação:
Neste caso, retiramos uma amostra e dosamos o hidróxido de sódio (NaOH) por alcalimetria.
Processos físicos
Os processos físicos utilizados na determinação da velocidade
de uma reação são muito mais precisos que os processos químicos,
pois não há a introdução de novas substâncias no sistema.
Assim, se no sistema em que ocorre a reação há a formação
de um gás insolúvel, podemos medir, em diferentes intervalos de
tempo, o volume desse gás.
Os processos físicos mais empregados são; medida do índice
de refração, medida da condutibilidade elétrica e medidas
colorimétricas.
Assim, medindo a velocidade da reação em diferentes
intervalos de tempo, podemos estabelecer um gráfico da velocidade
em função do tempo.
Observamos que sempre a velocidade é máxima no início e
vai diminuindo com o tempo. Assim, obtemos gráficos do tipo
ilustrado ao lado.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 7
CAPÍTULO 2 − FATORES QUE INFLUEM NA VELOCIDADE
Introdução
A velocidade de uma reação depende de uma série de fatores. Vamos, agora, examinar os seguintes:
colisão entre as moléculas reagentes, energia de ativação, temperatura, concentração dos reagentes, pressão e
estado sólido.
Estudo dos fatores
1º fator: colisão entre as moléculas reagentes
Para que duas ou mais substâncias possam reagir é evidente que suas moléculas devem colidir entre
si, de modo que haja quebra das ligações com conseqüente formação de outras novas, dando origem, assim, a
novas substâncias. As colisões entre as moléculas podem ser não-efetivas e efetivas.
Colisões não-efetivas
Colisões efetivas
São aquelas em que não há quebra de ligações e, São aquelas em que há quebra de ligações e
conseqüentemente, não existe formação de outras conseqüente formação de outras novas. Neste caso,
novas. Neste caso, não ocorre a reação.
ocorre a reação.
Para que uma colisão seja efetiva, o choque entre as moléculas deve acontecer com uma orientação favorável
e suficiente energia. Analisemos, por exemplo, algumas colisões entre moléculas H2 e 12:
Colisão
Significado
Colisão não-efetiva, pois ela ocorre com uma
orientação não-favorável para a quebra das
ligações.
Colisão não-efetiva, pois também ocorre com
uma orientação não-favorável para a quebra das
ligações.
Colisão que ocorre com uma orientação
favorável. Portanto, se a energia é suficiente,
temos uma colisão efetiva: H2 + I2 HI + HI
Conclusão: Quanto maior o número de colisões efetivas entre as moléculas dos reagentes, maior é a
velocidade da reação. Mais colisões efetivas maior velocidade
2º fator: energia de ativação
Consideremos, inicialmente, a seguinte experiência:
Vamos colocar um pouco de álcool num pires e aproximar do
álcool um fósforo aceso. O que acontece?
Como você sabe, o álcool entra em combustão, ou seja, queima
continuamente, até o final.
Essa queima nada mais é que a reação entre as moléculas do
álcool e as de oxigênio do ar.
Mas, para que ocorresse a reação, foi necessário fornecer inicialmente certa dose de energia
(aproximação do fósforo aceso). Desse modo, concluímos que, antes do fornecimento de energia, as
eventuais colisões entre moléculas de álcool e de oxigênio do ar eram não-efetivas. Entretanto, com o
fornecimento de energia, as moléculas, agora com maior conteúdo energético, passaram a colidir
efetivamente, iniciando, assim, a reação, que prossegue espontaneamente.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 8
Desse modo, vemos que o álcool não entra em combustão sem que iniciemos o processo. Isso mostra
que essa reação necessita de um “empurrão” de energia. Essa energia inicial recebe o nome de energia de
ativação. A energia de ativação é, então, uma “barreira” que as moléculas precisam vencer.
Para que você entenda melhor, vamos fazer uma comparação com uma carroça.
Imagine uma carroça na base de uma montanha, Se essa carroça tiver que subir a montanha, ela vai
precisar vencer uma barreira.
Uma vez no topo da montanha, ela adquiriu energia (potencial) e está em condições de efetuar uma
confortável descida.
Mas, na descida a carroça devolve a energia potencial adquirida.
Com as moléculas acontece algo parecido, ou seja, elas precisam vencer uma “barreira de energia”
para que ocorra a reação. Vejamos o caminho da energia através de um gráfico para a seguinte reação:
H2 + I2 2HI
Ponto 1: As moléculas reagentes não possuem suficiente energia para reagirem.
Ponto 2: A energia do sistema é maior, mas ainda não suficiente para que se verifique uma colisão efetiva.
Ponto 3: Neste ponto, a energia é suficiente para a reação. Dá-se, então, a formação de um composto
intermediário, instável, denominado complexo ativado. Aqui temos um estado ativado ou estado de
transição.
Ponto 4: Está vencida a “montanha” de energia. As moléculas do produto estão praticamente formadas.
Ponto 5: As moléculas do produto (HI) estão definitivamente formadas.
Com base no que vimos, podemos dizer que:
A energia mínima necessária para ativar as moléculas, fazendo com que elas colidam efetivamente,
possibilitando assim o inicio da reação, recebe o nome de energia de ativação.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 9
O estado ativado, ou seja, o “topo da montanha” é pouco conhecido pelos químicos. A estrutura do
composto formado (complexo ativado) é muito difícil de ser estudada, devido à grande instabilidade que
existe nessa situação.
A representação gráfica de uma reação envolvendo a energia de ativação (Ea) pode ser de dois tipos:
Conclusão: Quanto menor a energia de ativação, mais facilmente se forma o complexo ativado e, portanto,
mais rápida é a reação: Menor energia de ativação maior velocidade.
Exercícios: EA12; EA13; EA14; EA15.
3º fator: temperatura
Vamos supor o cozimento de um ovo. Se você cozinhar um ovo em água fervente, certamente levará
menos tempo do que cozinhando-o em água morna. A influência da temperatura na velocidade de uma
reação pode ser analisada observando-se o comportamento das moléculas reagentes. Aumentar a temperatura
significa aumentar a energia cinética das moléculas, ou seja, aumentar a velocidade das moléculas.
E fácil perceber que moléculas mais rápidas colidem
com mais freqüência e com mais violência. Logo, mais
moléculas reagem em certo espaço de tempo e, com isso, a
velocidade aumenta.
As moléculas reagentes não apresentam todas, a
mesma energia. E, se pudéssemos contar o número de
moléculas com certa energia, montaríamos um gráfico como
este.
Note que temos um grande número n de moléculas
com energia média Em e números menores de moléculas com
energia superior ou inferior ao valor médio.
Vamos, então, marcar nesse gráfico o valor da energia de ativação Ea:
Note que a região hachurada é proporcional
ao número de moléculas com energia igual ou maior
que a energia de ativação. Ela indica, portanto, a
parcela de moléculas em condições de reagir.
Um gráfico como esse é denominado curva
de energia.
Para cada temperatura temos uma curva de
energia.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 10
Desse modo, construindo as curvas de energia para duas temperaturas diferentes (T1 e T2), temos:
Note que, com o aumento da temperatura de T1
para T2, aumenta também a região hachurada, ou seja, a
parcela de moléculas em condições de reagir.
Conseqüentemente, mais moléculas reagem e a
velocidade logicamente aumenta.
Conclusão: Quanto mais alta é a temperatura,
maior é o número de moléculas em condições de reagir
e, portanto, mais rápida é a reação.
Maior temperatura maior velocidade
Observação: A preocupação de medir a velocidade de uma reação é muito antiga. Um grande cientista do
século XIX, Van’t Hoff, já dizia que: “Um aumento de 100 C na temperatura duplica a velocidade de uma reação”. Esse
fato, traduzido em fórmula matemática, nos conduz a:
Jacobus Hendricus Van’t Hoff (1852-1911).: Nasceu em
Rotterdam, Holanda. Foi um dos fundadores da moderna
Físico-Química, tendo estudado nas Universidades de
Bonn, Paris e Utrecht. Entre suas inúmeras contribuições,
podemos citar seus estudos sobre as leis das reações
químicas, dos equilíbrios químicos, das soluções etc. A
equação da pressão osmótica das soluções e o fator
corretivo dos efeitos coligativos em soluções iônicas levam
o seu nome. Van’t Hoff foi o primeiro cientista a receber o
Prêmio Nobel de Química, em 1901.
4º fator: concentração dos reagentes
Observe,
inicialmente,
a
seguinte
experiência: Um químico colocou um pedaço de
palha de aço numa cuba com solução diluída de
ácido clorídrico (HCl) e notou que a reação durou
um certo tempo (digamos, 20 min).
Depois, o químico repetiu o experimento,
usando, porém, uma solução de ácido clorídrico
mais concentrado e notou que a reação foi mais
rápida (digamos, 8 min).
Por que essa diferença de tempo? Porque na solução mais concentrada de ácido clorídrico temos mais
íons H3O+ por litro. Logo, ocorrem mais colisões entre esses íons e a palha de aço, e a reação se torna mais
rápida.
Como conseqüência, podemos dizer que o aumento da concentração dos reagentes tende a aumentar
a velocidade da reação. A primeira observação da influência da concentração dos reagentes na velocidade de
uma reação foi feita pelo químico alemão Karl Friedrich Wenzel, no século XVIII, quando estudava a ação
dos ácidos sobre metais. Entretanto, somente em 1864 essa influência foi rigorosamente enunciada, através
da lei da ação das massas, pelos cientistas noruegueses Cato Maximilian Guldberg e Peter Waage.
Lei da ação
das massas:
A velocidade de uma reação, num dado instante e a cada temperatura, é proporcional ao
produto das concentrações molares dos reagentes, elevadas as potências iguais aos
respectivos coeficientes na equação química balanceada.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 11
Observe a aplicação dessa lei para as seguintes reações:
Observações:
1) A expressão da lei de Guldberg e Waage se aplica à velocidade em certo instante de tempo, sendo
conhecidas as concentrações molares naquele instante de tempo. Em outras palavras, estamos medindo uma
velocidade instantânea e não uma velocidade média.
2) Para uma dada reação, a constante de velocidade depende fundamentalmente da temperatura, isto
é, mudando a temperatura, muda o valor de k.
3) Quando um dos reagentes se encontra no estado sólido, a sua concentração não aparece na
equação da lei da ação das massas, isso porque as colisões intermoleculares se dão na superfície do sólido, de
modo que a velocidade da reação depende da superfície de contato e não da concentração. Veja:
4) Quando um dos reagentes se encontra no estado líquido, a sua concentração pode ser considerada
constante desde que esse reagente esteja em excesso. Veja:
5) Para soluções aquosas diluídas, a concentração da água pode ser encarada como constante. Assim,
por exemplo, para a hidrólise da sacarose, temos:
A etapa lenta: um fator decisivo na velocidade
Imagine dois técnicos montando uma máquina, de modo que cada
um monte metade dela. Suponha que um dos técnicos, bastante hábil, monte
a sua parte em uma semana, enquanto o outro, bastante lento, demore três
meses. Em quanto tempo a máquina ficará pronta? Evidentemente, em três
meses, pois o tempo de montagem está na dependência do técnico mais
lento. Com as reações químicas que ocorrem em etapas acontece algo
parecido. Consideremos a reação:
Sua velocidade é dada por:
e não por
Por quê? Porque a reação ocorre em três etapas:
e o comando da velocidade é dado pela etapa
lenta. Então:
Conclusão: Quanto mais alta é a concentração, maior é a probabilidade de ocorrerem colisões
efetivas e, portanto, mais rápida é a reação. maior concentração maior velocidade.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 12
5º fator: pressão
Quando falamos em influência da pressão na velocidade de uma reação, devemos pensar somente nos
reagentes gasosos. Consideremos a reação de formação da água:
Como vimos, a reação se processa através das colisões entre as moléculas H2 e O2:
Se aumentarmos a pressão (diminuindo o volume, por exemplo), aumenta o número de colisões e,
portanto, a velocidade. Note que aumentar a pressão equivale a aumentar a concentração dos participantes
gasosos, o que também explica o aumento da velocidade da reação. Evidentemente, como se trata de uma
mistura (substâncias reagentes), estamos nos referindo, para cada participante, à sua pressão parcial. A
pressão parcial de um gás é a pressão que este gás exerceria sozinho na temperatura e no volume de uma
mistura gasosa. A pressão parcial pode ser dada pela equação: PAV = nART, dessa equação, resulta:
Logo, a pressão parcial de um gás é diretamente proporcional à sua concentração molar. Então,
aumentando a pressão parcial de um gás, estamos aumentando a sua concentração molar e, em conseqüência,
aumenta a velocidade da reação. Como a pressão parcial é proporcional à concentração molar, a lei de
Guldberg e Waage pode ser expressa em termos de pressão parcial:
Logo: V = k.PaA.PbB. Assim, para a reação de formação da água, temos:
Conclusão: Quanto maior é a pressão parcial de um participante gasoso, mais rápida é a reação.
maior pressão parcial maior velocidade
Exercícios resolvidos
ER5. Considere a reação de síntese da água, a uma temperatura t. O que ocorrerá com a velocidade dessa
reação se a concentração molar do hidrogênio for duplicada, sem variar a temperatura?
Resolução:
Primeira situação
Segunda situação
Conclusão
Resposta: A velocidade da reação quadruplicará.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 13
ER6. Dada a reação:
o que ocorrerá com a velocidade se dobrarmos a pressão
parcial do O2 e reduzirmos à metade a pressão parcial do H2?
Resolução:
Primeira situação
Segunda situação
Conclusão
Resposta: A velocidade da reação se reduzirá à metade.
Exercícios:
EA16; EA17. EA18; EA19; EA20; EA21; EA22; EA23; EA24; EA25; EA26;
EF1; EF2; EF3; EF4; EF5; EF6; EF7.
6º fator: estado sólido
A reação de um sólido com outro reagente qualquer ocorre através de colisões das partículas do
reagente com a superfície do sólido. Logo, não interessa saber qual a concentração do sólido, mas sim qual a
sua superfície de contato. Quanto maior essa superfície, maior o número de colisões e maior a velocidade.
Para que você perceba melhor a influência da superfície de contato na velocidade da reação, vamos examinar
duas experiências.
1ª experiência: Considere duas esferas de ferro, com
o mesmo diâmetro, uma maciça e outra oca. E fácil
perceber que duas esferas nessas condições, embora
apresentem massas diferentes, possuem a mesma
superfície de contato.
Agora, vamos colocar essas esferas, isoladamente, em soluções de ácido clorídrico (HCl) de mesma
concentração. Verificamos que, inicialmente, a reação ocorre com a mesma velocidade, pois os cátions H +
(aq) efetuam o mesmo número de colisões com uma e com outra esfera, pois a superfície disponível para
essas colisões é a mesma. Veja:
A velocidade, de acordo com a lei da ação das massas, depende somente da concentração dos íons H +
(e não da concentração do sólido) e da sua superfície de contato.
2ª experiência: Considere, agora, em lugar das esferas,
um prego e uma palha de aço. Suponhamos que as
massas do prego e da palha de aço sejam as mesmas.
Entretanto, é fácil perceber que as superfícies de
contato são diferentes.
Vamos colocar o prego e a palha de aço em soluções de ácido clorídrico (HCl) de mesma
concentração. Percebemos, agora, que a reação da palha de aço com o ácido é bem mais rápida que a reação
do prego com o ácido, o que nos mostra que a velocidade realmente depende da superfície de contato, e não
da concentração do prego ou da palha de aço.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 14
(reação lenta)
Conclusão: A palha de aço apresenta
uma superfície de contato muito maior;
assim, sofre um número maior de
colisões dos íons H. Por isso, reage
mais rapidamente. Quanto maior a
superfície de contato do sólido, maior é
o número de colisões por parte do outro
reagente e, assim, mais rápida é a
reação.
(reação rápida)
Maior superfície de contato maior velocidade
Observações:
1) As reações químicas, além dos fatores estudados, podem ser influenciadas também por agentes tais como
a luz e a eletricidade.
A influência da luz pode ser apreciada na fotólise e na fotossíntese:
Fotólise: reação de decomposição de uma substância com absorção de luz (λ):
Fotossíntese: reação de composição de uma substância com absorção de luz:
A influência da eletricidade pode ser apreciada através de corrente elétrica, faísca elétrica, eflúvio
elétrico e arco voltaico. Observe:
2) A ordem de uma reação é dada pela
soma dos expoentes aos quais estão
elevadas as concentrações na fórmula da
velocidade, conforme a lei da ação das
massas:
3) Molecularidade de uma reação é o
número de moléculas que se chocam em
cada etapa da reação:
Esta é uma reação de molecularidade 2 ou bimolecular, pois se
dá pelo choque entre duas moléculas (C12H22O11 e H2O).
Ordem
Molecularidade
Dada pela soma dos expoentes na fórmula da Dada pela soma dos coeficientes das substâncias
velocidade:
reagentes:
x + y = 0 ordem zero
x + y = 1 ordem 1 ou 1ª ordem
x + y = 2 ordem 2 ou 2ª ordem
***
Exercícios: EA27; EA28; EA29.
a + b = 1 molecularidade 1 (monomolecular)
a + b = 2 molecularidade 2 (bimolecular)
a + b = 3 molecularidade 3 (trimolecular)
***
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 15
CAPÍTULO 3 − CATÁLISE
Conceitos
Catalisador é a espécie química que, juntamente com as moléculas reagentes, faz com que estas
reajam com uma velocidade maior.
A decomposição do peróxido de hidrogênio (H2O2) produz água (H2O) e
oxigênio (O2). Em determinadas condições, essa reação ocorre com
velocidade V.
Entretanto, se juntamente com o peróxido de hidrogênio colocarmos íons
ferrosos (Fe2+), a decomposição ocorrerá com uma velocidade V’ maior.
Nessas condições, dizemos que a espécie química Fe 2+ é catalisador da reação de decomposição do
peróxido de hidrogênio, e essa reação de decomposição na presença do catalisador recebe o nome de catálise.
As espécies químicas que possuem a propriedade de aumentar a velocidade de uma reação sem sofrer
modificações permanentes, tanto na composição química como na quantidade, recebem o nome de
catalisadores; as reações em que os catalisadores atuam são chamadas catálises.
O interesse pelos catalisadores começou a existir no início do século passado, através de cientistas
famosos como Jõns Jakob Berzelius e Wilhelm Ostwald.
A ação do catalisador
Os químicos são unânimes em
aceitar o fato de que os
catalisadores
abaixam
a
energia de ativação da reação.
Veja:
Note que a presença do catalisador diminui a energia de ativação de Ea2 para Ea1, isto é, diminui a
“montanha de energia” que as moléculas devem vencer para que ocorra a reação. Assim, mais moléculas
podem reagir e, em conseqüência, a velocidade da reação aumenta.
Vamos estabelecer uma analogia
com um carro que, dirigindo-se a um
determinado lugar, dispõe de dois
caminhos:
Mas, como agem os catalisadores? O mecanismo de ação dos catalisadores é bastante complexo e
não está ainda perfeitamente esclarecido.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 16
Entretanto, podemos dizer que:
O catalisador participa ativamente da
reação, sendo, no entanto, devolvido “intacto” no
final do processo.
Analisemos, por exemplo, a decomposição
do peróxido de hidrogênio (H2O2), que sabemos
ser bastante rápida na presença de íons Fe2+:
Fe2+: catalisador (reação rápida)
Veja o que ocorre:
1ª etapa: O catalisador Fe2+ se combina facilmente com
o reagente H2O2:
2ª etapa: O íon Fe3+ formado se combina facilmente
com o reagente H2O2:
Somando as duas etapas obtemos a equação do
processo:
Note que o catalisador reagiu na 1ª etapa e foi regenerado integralmente na 2ª etapa. Com isso, ele
não apareceu na equação química final, mas aumentou a velocidade da reação.
por
O catalisador “não participa” ativamente da reação. Analisemos,
exemplo,
a
reação
de
formação
da
água:
A simples mistura de hidrogênio e oxigênio, à temperatura
ambiente, praticamente não produz água. Entretanto, na presença de
platina, os gases se combinam rapidamente:
Pt: catalisador
Neste caso, admite-se que os gases reagem na superfície do metal
platina: As moléculas de hidrogênio se ligam à superfície da platina e a
ligação fica enfraquecida. As moléculas de oxigênio, colidindo com as
moléculas de hidrogênio de ligação enfraquecida, reagem muito mais
facilmente. Terminada a reação com a formação de moléculas de água, o
catalisador platina deixa de participar do processo.
Observação: Sabemos que o catalisador não sofre alteração permanente na sua composição química e na
quantidade. Entretanto, pode sofrer alteração quanto à sua natureza física. Veja:
A decomposição do clorato de potássio (KC1O3) é catalisada
pelo dióxido de manganês (MnO2):
Se usarmos MnO2 em fragmentos grandes, verificaremos que,
após a reação, ele aparecerá na forma de um pó bastante fino. Isso serve
como prova de que o catalisador toma parte intermediariamente na
reação, mas se regenera no final.
Catálise
Catálise é a denominação dada à reação que ocorre com a presença de um catalisador. De acordo com
o sistema formado pelo catalisador e os reagentes, a catálise pode ser homogênea ou heterogênea.
Catálise homogênea
Catálise heterogênea
É a catálise em que o catalisador e os reagentes É a catálise em que o catalisador e os reagentes
constituem uma única fase. Exemplo:
constituem mais de uma fase. Exemplo:
O sistema formado pela mistura SO2, O2 e NO é O sistema formado pela mistura SO2, O2 e Pt é
difásico (duas fases: gás e sólido).
monofásico (uma fase: gás).
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 17
Inibidor
Inibidor é toda espécie química que, juntamente com as moléculas reagentes, faz com que estas
reajam com uma velocidade menor.
A decomposição do peróxido de hidrogênio (H2O2) produz água e
oxigênio, e ocorre, em determinadas condições, com uma velocidade V.
Entretanto, adicionando a espécie química H+ (ácido) às moléculas
do peróxido, a decomposição ocorre com uma velocidade V’ menor.
Nessas condições, dizemos que a espécie química H+ é um inibidor da reação de decomposição do
peróxido de hidrogênio. As soluções aquosas de peróxido de hidrogênio são conhecidas como água
oxigenada. Nessas soluções costuma-se adicionar um ácido (H3PO4) para inibir a decomposição do H2O2.
Ativador ou promotor
Ativador ou promotor é a espécie química que, juntamente com o catalisador e as moléculas
reagentes, faz com que estas reajam com uma velocidade ainda maior do que se estivessem somente com o
catalisador.
A síntese do amoníaco (NH3), a partir de seus elementos, ocorre,
em determinadas condições, com uma velocidade V.
Entretanto, adicionando a espécie química Fe (ferro) às
moléculas reagentes, a reação ocorre com uma velocidade V’ maior.
Se, agora, adicionarmos as espécies Al2O3 e K2O juntamente
com as moléculas reagentes e o catalisador, a reação ocorrerá com uma
velocidade V1 maior que V’.
É importante saber, no entanto, que o ativador sem a presença do catalisador não tem nenhuma ação
sobre a velocidade da reação.
Veneno
Veneno é a espécie química que, juntamente com o catalisador e as moléculas reagentes, faz com que
estas reajam com uma velocidade menor do que se estivessem somente com o catalisador. Você viu, no item
anterior, que a espécie Fe (ferro) atua como catalisador na síntese do amoníaco. Adicionando a espécie As
(arsênio) juntamente com as moléculas reagentes e o catalisador, notamos que a reação ocorre com uma
velocidade menor. Assim:
Observações:
1) Existem reações, chamadas de autocatálises, em que um dos produtos funciona como catalisador. Um
exemplo típico é a reação entre cobre metálico e ácido nítrico:
Inicialmente, a reação é lenta; porém, aos poucos, torna-se mais rápida, chegando a ser uma reação violenta,
Isso porque o monóxido de nitrogênio (NO), formado na reação, atua como catalisador da mesma.
2) Existem reações em que um dos produtos atua
como inibidor. Um exemplo típico é a reação de
hidrólise do ácido bromo propanóico:
A velocidade da reação diminui com o passar do tempo porque o bromidreto (HBr), formado na
reação, atua como inibidor da mesma.
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 18
EXERCÍCIOS DE APRENDIZAGEM
EA1. Dada a reação 2SO2 + O2 2SO3, calcule a velocidade média, conforme a tabela, nos seguintes
intervalos:
Tempo (s)
0
2
6
12
Número de moles de SO2 existentes
6,0 5,0 2,2 1,0
a) de 0s a 2s
b) de 0s a 12s
c) de 2s a 6s
d) de 2s a 12s
e) de 6s a 12s
EA2. De acordo com a tabela referente à equação C + O2 CO2, calcule a velocidade média nos seguintes
intervalos:
Tempo (s)
0
3
5
8
10
Número de moles de CO2 existentes
0,0 1,5 2,5 4,0 6,0
a) de 0s a 3s
b) de 3 s a 5s
c) de 3s a 8s
d) de 5s a 10s
e) de 8s a 10s
1) de 3s a 10s
EA3. Dada a equação Zn + H2SO4 ZnSO4 + H2, calcule a velocidade média, de acordo com a tabela, nos
intervalos:
Tempo (s)
0
5
8
15
30
Massa de ZnSO4 existente (g)
0
10
15
40
60
a) de 0 min a 5 min
b) de 5 min a 15 min
c) de 8 min a 30 min
d) de 5 min a 30 min
EA4. A tabela abaixo mostra a variação da massa da substância C que se forma na reação: A + B 2C
Tempo (s)
Massa de C existente (g)
a) de 0s a l0s
b) de l0s a 30s
0
0
c) de 30s a 50s
d) de 30s a 80s
10
5
30
15
50
40
80
60
e) de l0s a 50s
f) de l0s a 80s
EA5. A tabela abaixo fornece as concentrações molares de B em vários tempos, de acordo com a sua reação
com A: 2A + 3B 2C + D:
Tempo (min)
0
2
5
8
11
Concentração molar de B
2,0 1,0 0,5 0,3 0,2
Calcule a velocidade média da reação nos seguintes intervalos:
a) de 0 min a 2 min
c) de 2 min a 5 min
b) de 0 min a 5 min
d) de 5 min a 8 min
e) de 5 min a li min
f) de 8 min a 11 min.
EA6. Um químico realizou a reação de decomposição do H2CO3:
H2CO3 H2O + CO2.
Mediu a concentração molar do CO2 nos tempos l0s e 20 s, e obteve:
10 s [CO2] = 0,2 M
Qual é a velocidade média dessa reação no intervalo de 10 s a 20 s?
20 s [CO2] = 0,8 M
EA7. Com relação à reação Fe + 2HCl FeCl2 + H2 foram feitas as seguintes medidas:
Tempo (s)
0
2
4
8
Número de moles de HCl
1,5
1,0
0,6
0,1
Número de moles de FeCl2
0
0,25 0,45
0,70
Calcule as velocidades de desaparecimento do HCl, de formação do FeCl2 e da reação nos intervalos:
a) de 0s a 2s
b) de 2s a 4s
c) de 2s a 8s
d) de 4s a 8s
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 19
EA8. As medidas que constam na tabela abaixo se referem à reação: N2 + 3H2 2NH3
Tempo (s)
0
3
5
10
Concentração molar de H2
1,0
0,7
0,4 0,1
Concentração molar de NH3
0,0
0,2
0,4 0,6
Calcule as velocidades de desaparecimento do H2, de formação do NH3 e da reação nos intervalos:
a) de 0s a 3s
b) de 0s a 5s
e) de 3s a 5s
d) de 5s a 10s
EA9. Dada a reação 2H2 + O2 2H2O, determine a velocidade de desaparecimento do O2 em função da
velocidade de formação do H2O.
EA10. Dado o processo 2SO2 + O2 2SO3, calcule a velocidade de desaparecimento do SO2 em função da
velocidade de desaparecimento do O2.
EA11. Dada a equação C2H6O + 3O2 2CO2 + 3H2O, calcule:
a) a velocidade de desaparecimento do O, em função da velocidade de formação do CO2;
b) a velocidade de formação do H2O em função da velocidade de desaparecimento do C2H6O.
EA12. Observe o gráfico da reação A + B C + D:
EA13. Considere o gráfico da reação X + Y P:
Agora, determine:
a) a energia de ativação;
b) a energia absorvida pela reação.
Agora, responda:
a) Qual a energia do complexo ativado?
b) Qual a energia de ativação?
c) Qual o tipo de reação? Por quê?
d) Qual a energia absorvida ou liberada pela reação?
EA14. Considere o gráfico da reação A + B C + D:
EA15. Esboce os gráficos das seguintes reações:
Agora, responda:
a) Qual a energia das moléculas reagentes e das
moléculas dos produtos? b) Qual a energia de ativação?
c) Qual o tipo da reação em questão? Por quê?
d) Qual a energia liberada ou absorvida pela reação?
EA16. Escreva a equação da velocidade em função das concentrações e das pressões parciais dos reagentes
para cada uma das seguintes reações:
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 20
EA17. A síntese da água ocorre com velocidade V, a uma temperatura t. Na mesma temperatura, o que
ocorrerá com a velocidade se reduzirmos à metade a concentração molar do hidrogênio e duplicarmos a do
oxigênio?
EA18. Considere a reação de síntese da amônia, dada pela equação: N2(g) + 3H2(g) 2NH3(g). Admita que
à temperatura t essa reação se processa com uma velocidade V.
a) O que ocorrerá com a velocidade se a concentração molar do H 2(g) for reduzida à terça parte e a
do N2(g) for triplicada?
b) O que ocorrerá com a velocidade se a pressão parcial do N 2(g) for quadruplicada e a do H2(g) for
reduzida à metade?
EA19. A síntese parcial do trióxido de enxofre é representada pela equação: 2SO 2 + O2 2SO3. Admitindo
que essa reação ocorra com a velocidade x e que, reduzindo a concentração molar do SO2 à quarta parte e
dobrando a do O2, ela passa a ocorrer com a velocidade y, calcule a razão x/y.
EA20. Considere a reação 2NO(g) + 2H2(g) 2H2O(g) + N2(g) que ocorre com a velocidade V, a uma
temperatura t. Calcule a velocidade V’ dessa reação, à mesma temperatura t, quando a concentração molar
do NO é duplicada e a do H2 reduzida à metade.
EA21. Considere a reação: N2(g) + 3H2(g) 2NH3(g). O que ocorrerá com a velocidade se reduzirmos à
metade a pressão parcial do H2?
EA22. Admita o seguinte processo: 2CO(g) + O2(g) 2CO2(g). Reduzindo à metade a pressão parcial do
CO e quadruplicando a pressão parcial do O2, o que ocorrerá com a velocidade desse processo?
EA23. Escreva a equação da velocidade das reações, em termos de concentração, segundo a lei da ação das
massas:
a) Zn(s) + 2HCl(aq) ZnCl2(aq) + H2(g)
b) CaO(s) + 2H+(aq) Ca + H2O
EA24. Admita a transformação: 3O2 2O3. Descubra qual o aumento da velocidade previsto pela lei da
ação das massas ao duplicarmos a concentração do O2.
EA25. Considere o processo AB + C AC + B, que se desenvolve em duas etapas:
1ª etapa (lenta): AB A + B
2ª etapa (rápida): A + C AC
Escreva a equação da velocidade desse processo, segundo a lei da ação das massas.
EA26. Considere a reação: (CH3)3C—Br + NaOH(aq) (CH3)3C—OH + NaBr
Escreva a equação da velocidade, de acordo com a lei da ação das massas, em termos de
concentração, sabendo que ela ocorre em duas etapas:
1ª etapa (lenta): (CH3)3C—Br (CH3)3C+ + Br2ª etapa (rápida): (CH3)3C+ + NaOH (CH3)3C—OH + Na+.
EA27. Um químico dispunha de dois frascos idênticos, A e B, contendo cada um a mesma quantidade de
ácido sulfúrico de concentrações iguais. No frasco A colocou uma lâmina de zinco (Zn) de 100 g de massa e
no frasco B, 100 g de zinco em pó. Em qual frasco a reação entre zinco e ácido sulfúrico terminou primeiro?
Por quê?
EA28. Determine a molecularidade das seguintes reações:
EA29. Calcule a ordem das reações:
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 21
EA30. Dado o gráfico abaixo, referente à reação A + B C + D, responda:
a) Qual a energia absorvida pela reação?
b) Qual a energia de ativação sem catalisador?
c) Qual a energia de ativação com catalisador?
d) Qual a diminuição da energia de ativação provocada pelo
catalisador?
e) Qual a diminuição da energia absorvida pela reação com a
presença do catalisador?
f) Qual a diminuição da energia do complexo ativado com a
presença do catalisador?
EA31. Considere o gráfico:
Agora, responda:
a) Qual a energia de ativação sem catalisador da reação A + B AB?
b) Qual a energia de ativação com catalisador da reação A + B AB?
c) Qual a energia de ativação com e sem catalisador da reação AB
A + B?
d) Qual a energia absorvida pela reação AB A + B?
e) Qual a energia liberada pela reação A + B AB?
EA32. Dadas as equações químicas e as relações entre as velocidades, responda às questões:
a) Qual a função da platina (Pt)?
b) e do arsênio (As)?
Qual a função do níquel (Ni)?
Qual a função do ferro (Fe)?
Qual a função de D?
a) Qual a função de C?
b) Qual a função de D?
a) Qual a função de C?
b) Qual a função de D?
EA33. Classifique as catálises em homogêneas e heterogêneas:
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 22
EXERCÍCIOS DE FIXAÇÃO
EF1. A tabela abaixo mostra a variação da massa de peróxido de hidrogênio que ocorre na reação de
decomposição desse peróxido: 2H2O2 2H2O + O2.
Tempo (min)
0
3
5 10 18
Massa de H2O2 existente (g)
12 10 6
4
1
Calcule a velocidade de decomposição do peróxido de hidrogênio nos intervalos:
a) de 0 a 3 min
b) de 3 a 5 min
c) de 5 a l0 min
d) de 5 a 18 min
e) de 10 a l8 min
EF2. Para a reação H2 + Cl2 2HCl foram feitas as seguintes medidas:
Tempo (s)
0
3
6
10
Número de moles de H2
2,0
1,4
0,5 0,1
Número de moles de HCl
0,0
1,2
3,0 3,8
Calcule as velocidades de desaparecimento do H2, de formação do HCl e da reação nos intervalos:
a) de 0s a 3s
b) de 3s a 6s
c) de 6s a l0s
EF3. Considere a reação de formação do cloridreto, representada pela equação: H 2 + Cl2 2HCl. Calcule a
velocidade de formação do HCl em função da velocidade de desaparecimento do H2.
EF4. Dado o gráfico, responda às questões propostas:
a) Qual a energia do complexo ativado?
b) Qual a energia de ativação para a reação A + B C?
c) Qual a energia de ativação para a reação C A + B?
d) Qual a energia absorvida na reação A + B C?
e) Qual a energia liberada na reação C A + B?
EF5. Escreva a equação da lei da ação das massas em função
das concentrações molares e das pressões parciais dos
reagentes para as seguintes reações:
EF6. Como varia quantitativamente a velocidade da reação CaO(s) + CO2(g) CaCO3(s) quando a
concentração molar do CO2 é triplicada?
EF7. Determine o que ocorre com a velocidade da reação 2NO2 N2O4 quando:
a) a concentração molar do NO2 é duplicada;
b) a concentração molar do NO2 é reduzida à metade.
EXERCÍCIOS COMPLEMENTARES
1) Explicar por que a velocidade da reação ao lado, quando
efetuada em solução aquosa diluída, não depende da
concentração da água.
2) Num recipiente fechado são introduzidos 2 moles de CO(g) e 1 mol de O2(g). No início da transformação
2 CO(g) + O2(g) 2 CO2(g) a velocidade da reação é V. Decorrido certo intervalo de tempo, passa a existir
no recipiente apenas 1 mol de CO(g). Qual é, então, em função de V0, a velocidade da reação?
Apostila de Química 2 − Unidade 3 − Cinética Química − Pagina 23
3) Observe os fatores abaixo mencionados:
(1) concentração dos reagentes
(2) cor dos reagentes
(3) temperatura dos reagentes
(4) presença de catalisador
4) Em uma reação, o complexo ativado:
d) é um composto estável.
b) age como catalisador.
c) sempre forma produtos.
Assinale a alternativa que contém aqueles que afetam a
velocidade da reação:
a) 1 e 2.
c) 1 e 4 somente.
b) 1 e 3 somente.
d) 1, 3 e 4.
a) possui mais energia que os reagentes ou os produtos.
e) possui menos energia que os reagentes ou os produtos.
5) A combustão do propano obedece à equação:
Havendo consumo de 0,5 mols de moléculas do propano em 15 min, a velocidade da reação, em moles de
CO2 por minuto, é:
a) 0,033.
b) 0,3.
c) 0,1.
d) 0,2.
e) nda
6) Dada a reação A + B C + D, que se processa com velocidade x, se as concentrações de A e B forem
reduzidas à metade, a nova velocidade da reação será:
7) A reação A + 2 B C se realiza com velocidade x. Se a concentração molar de A for duplicada e a de B
reduzida à metade, a reação se realizará com uma velocidade igual a:
8) O gráfico energético da reação A + B AB é o seguinte:
A energia de ativação dessa reação é de:
a) 30 kcal.
b) 40 kcal.
c) 45 kcal.
d) 75 kcal.
e) 10 kcal.
9) A reação 3A + B C se processa com velocidade V. Se a concentração molar de A se reduzir à metade e
a de B octuplicar, a reação se processará com uma velocidade iguala:
10) A tabela abaixo se refere à reação: 2O3 3O2.
Calcule as velocidades de
Tempo (s)
desaparecimento do O3, de formação
Número de moles de O3 existentes
do O2 e da reação nos intervalos:
Número de moles de O2 existentes
a) de 0s a 2s
b) de 2s a 5s
c) de 5s a l0s
0
4,00
0,00
2
2,00
3,00
5
0,50
5,25
10
0,00
6,00
11) A reação de combustão do metano é dada pela equação:
Descubra a relação existente entre a velocidade de desaparecimento do CH4(g) e a de formação do H2O(g).
12) Verifica-se, experimentalmente, que a velocidade da reação 2H2 + 2NO 2H2O + N2, em fase gasosa, é
proporcional ao produto da concentração de H2 pelo quadrado da concentração de NO. Pergunta-se: Como
varia, quantitativamente, a velocidade da reação quando a concentração de NO é triplicada, mantendo-se
constante a concentração de H2?
13) A velocidade da reação H2(g) + I2(g) 2HI(g) é proporcional ao produto das concentrações de iodo e
hidrogênio. Determine o que ocorre com a velocidade quando:
a) é introduzido um catalisador no recipiente da reação;
b) é aumentada a concentração de iodo;
c) é diminuída a concentração de hidrogênio.