RAFAEL SANZIO DINIZ LACERDA GOMES
Estudo comparativo da Psychotria ipecacuanha
(Brot.) Stokes - Rubiaceae - do Bioma Amazônia
obtida na mata nativa e do cultivo in vitro submetido
a diferentes tratamentos de interceptação da
radiação solar
Belo Horizonte
2007
Livros Grátis
http://www.livrosgratis.com.br
Milhares de livros grátis para download.
RAFAEL SANZIO DINIZ LACERDA GOMES
Estudo comparativo da Psychotria ipecacuanha
(Brot.) Stokes - Rubiaceae - do Bioma Amazônia
obtida na mata nativa e do cultivo in vitro submetido
a diferentes tratamentos de interceptação da
radiação solar
Dissertação apresentada ao Curso de PósGraduação, em Ciências Farmacêuticas,
Faculdade de Farmácia da Universidade
Federal de Minas Gerais, como requisito
parcial à obtenção do título de Mestre.
Orientador: Profa. Dra. Ana Maria Dantas
Barros.
Co-orientador: Profa. Dra. Rose Lisieux
Ribeiro Paiva Jácome.
Belo Horizonte
2007
G633e
Gomes, Rafael Sanzio Diniz Lacerda
Estudo comparativo da Psychotria ipecacuanha (Brot.) Stokes –
Rubiaceae – do Bioma Amazônia obtida na mata nativa e do cultivo
in vitro submetido a diferentes tratamentos de interceptação da
radiação solar / Rafael Sanzio Diniz Lacerda. – 2009.
101 f. : il.
Orientadora Profa. Dra. Ana Maria Dantas Barros
Co-Orientadora: Profa. Dra. Rose Lisieux Ribeiro Paiva Jácome
Dissertação (mestrado) - Universidade Federal de Minas Gerais.
Faculdade de Farmácia. Programa de Pós-Graduação em Ciências
Farmacêuticas.
1.Psychotria ipecacuanha – Teses. 2. Plantas medicinais Teses. 3. Alcalóides - Teses. 4. Farmacognosia – Teses. I. Barros,
Ana Maria Dantas. II. Rose Lisieux Ribeiro Paiva, Jácome. III.
Universidade Federal de Minas Gerais. Faculdade de Farmácia. III.
Título.
CDD 615.321
AGRADECIMENTOS
A Professora Doutora Ana Maria Dantas Barros por seu apoio e inspiração no
amadurecimento dos conhecimentos que possibilitaram a conclusão dessa
Dissertação.
A Professora Doutora Rose Lisieux Ribeiro Paiva Jácome por sua contribuição ao
desenvolvimento desse trabalho.
Ao Doutor Osmar Alves Lameira, pesquisador da EMBRAPA Amazônia Oriental
(CPATU/EMBRAPA), pelo fornecimento das amostras da poaia nativa da Amazônia
e ao Professor Doutor José Eduardo Brasil Pereira Pinto, do Laboratório de Cultura
de Tecidos e Plantas Medicinais da Universidade Federal de Lavras, pelo tratamento
biotecnológico destas plantas utilizadas neste estudo.
Ao Professor Doutor Ênio Lacerda Vilaça por sua estimada ajuda nos tratamentos e
interpretações dos dados estatísticos desse trabalho.
A minha família, pela confiança e motivação nos momentos difíceis.
Aos amigos que acompanharam de perto esta jornada.
Aos professores e colegas de Curso, pois juntos trilhamos uma etapa importante de
nossas vidas.
A todos que, com boa intenção, colaboraram para a realização e finalização desse
trabalho.
RESUMO
Nos vários recursos naturais presentes na Mata Atlântica estão as espécies
medicinais, inclusive algumas ameaçadas de extinção. Dentre estas, destaca-se a
Psychotria ipecacuanha (Brot.) Stokes, pertencente à família Rubiaceae. Conhecida
popularmente como poaia, contém em suas raízes cerca de 2 a 2,7% de alcalóides
totais, sendo os mais importantes a emetina, a cefalina e a psicotrina, que conferem
a planta suas propriedades terapêuticas. A emetina atua principalmente como
expectorante e amebicida, enquanto que a cefalina é responsável pela atividade
emética. O objetivo deste estudo foi a comparação dos aspectos morfoanatômicos,
farmacoquímicos, validação farmacognóstica/farmacopéica, entre a poaia originária
do Bioma Amazônia, e aquelas cultivadas in vitro e submetidas a diferentes
tratamentos de interceptação da radiação solar, visando, desta forma, dar suporte a
estudos com fins de preservação, cultivo, uso medicinal e ampliar o conhecimento
biotecnológico desta espécie. A planta nativa foi coletada em fragmento de mata
nativa, no município de Belém, Estado do Pará, na fase vegetativa de
desenvolvimento. As plantas cultivadas in vitro e submetidas a diferentes
tratamentos foram preparadas na Universidade de Federal de Lavras. No aspecto
geral verificou-se que as plantas cultivadas, originadas por processo biotecnológico
e submetidas a diferentes tratamentos, apresentaram morfologia semelhante à
planta nativa, observada através da descrição morfológica. No entanto, constatou-se
um maior número de raízes secundárias. Através da análise estatística realizada, a
única diferença observada foi entre os comprimentos de caule, mas apenas entre a
espécie nativa e as submetidas aos tratamentos, mas não nas tratadas entre si. As
características anatômicas observadas para a raiz, rizomas e grãos de amido da
planta nativa confirmam as várias literaturas consultadas. A histolocalização dos
alcalóides nas raízes da amostra nativa foi realizada através do teste com o reativo
de Dragendorff, na região que circunda o cilindro vascular, sendo positiva. Todas as
características anatômicas observadas para a planta nativa também puderam ser
observadas nas plantas cultivadas tratadas, não sendo constatada nenhuma
diferença marcante. A cromatografia em camada delgada realizada confirma a
presença dos alcalóides emetina e cefalina, Rf = 0,24 e 0,13 respectivamente. Os
teores de alcalóides não fenólicos apresentaram diferença estatisticamente
significativa para a amostra nativa em relação à amostra cultivada tratada. Nas
plantas originadas de processos in vitro foram maiores. Os teores de alcalóides
fenólicos não apresentaram diferença estatisticamente significativa entre a amostra
nativa e a cultivada tratada. Os teores de alcalóides totais apresentaram diferença
estatisticamente significativa entre a amostra nativa em relação aos tratamentos de
interceptação da radiação solar. Claramente observa-se que as plantas obtidas por
processo biotecnológico apresentaram maiores teores de alcalóides, que a espécie
nativa. A planta nativa apresentou teor menor que o especificado pela Farmacopéia
em alcalóides totais (1,71%). As plantas cultivadas e tratadas atenderam a estas
condições. Os perfis cromatográficos obtidos por cromatografia líquida de alta
eficiência confirmaram a presença de emetina nas amostras avaliadas.
Palavras-chave: Psychotria ipecacuanha, descrição morfológica, cultivo vegetal in
vitro, doseamento de alcalóides
ABSTRACT
In the various natural resources present in the Atlantic Forest are the medicinal
species, including some endangered species. Among these, stands out Psychotria
ipecacuanha (Brot.) Stokes, belonging in the family Rubiaceae. Popularly known as
ipecac, contains in its roots about 2 to 2.7% of total alkaloids, the most important are
the emetine, the cephaeline and the psichotrine, giving the plant its therapeutic
properties. The emetine acts mainly as an expectorant and amebicide, while the
cephaeline is responsible for emetic activity. The objective of this study was to
compare the morphological, anatomical and pharmacochemical aspects,
pharmacognostic/pharmacopoeia validation between ipecac originating in the
Amazon, and those cultivated in vitro and subjected to different treatments of solar
radiation interception, in order thus to support studies with the purpose of
preservation, cultivation, medicine and increase biotechnology knowledge of this
species. The native plant was collected in native forest fragment in the municipality of
Belém, state of the Pará, in the vegetative stage of development. The plants grown in
vitro and subjected to different treatments were prepared at the Universidade Federal
de Lavras. In general appearance it was found that the cultivated plants originating
from the biotechnological process and subjected to different treatments, showed
morphology similar to native plant, observed by the morphological description.
However, there were a greater number of secondary roots. Through statistical
analysis, the only difference was observed between the lengths of the stem, but only
among native species and subjected to treatment, but not in those treated with one
another. The anatomical characteristics observed for the roots, rhizomes and starch
grains of native plant confirm the various literature. The histolocalization of alkaloids
in the roots of native sample was performed using the test with Dragendorff's
reagent, in the region surrounding the vascular cylinder, which is positive. All
anatomical characteristics observed for the native plant could be observed in the
treated cultivate plants are not observed any significant difference. The thin layer
chromatography carried out confirms the presence of alkaloids emetine and
cephaeline, Rf = 0.24 and 0.13 respectively. The levels of non-phenolic alkaloids
showed statistically significant difference between the native sample and the sample
grown treated. In plants from in vitro procedures were higher. The contents of
phenolic alkaloids showed no statistically significant difference between the native
samples and cultivated treated. The levels of total alkaloids showed a statistically
significant difference between the native sample in relation to the processing of
interception of solar radiation. Clearly it is observed that the plants obtained by
biotechnological process showed larger levels of alkaloids, than the native species. A
native plant had less than the level specified by the Pharmacopoeia of total alkaloids
(1.71%). Plants grown and treated responded to these conditions. The
chromatographic profiles obtained by high performance liquid chromatography
confirmed the presence of emetine in the evaluated samples.
Key-words: Psychotria ipecacuanha, morphological description, vegetable cultivation
in vitro assay of alkaloids
LISTA DE FIGURAS
1 Alcalóides isolados de P. ipecacuanha..........................................................................................20
2 Aspectos da P. ipecacuanha coletada na Amazônia....................................................................45
3 Aspecto da P. ipecacuanha, após serem submetidas aos diferentes tratamentos...................49
4 Secção transversal mostrando súber (s), parênquima cortical (pc), floema (f) e xilema (x),
(barra = 200µ
µm).................................................................................................................................61
5 Detalhe do súber (s) e parênquima cortical (pc), (barra = 20µ
µm).................................................61
6 Secção transversal mostrando células com grãos de amido (cga), floema (f) e xilema (x),
(barra = 20µ
µm)...................................................................................................................................61
7 Detalhe das células com grãos de amido (ga) e ráfides (rf), (barra = 10µ
µm)..............................61
8 Grãos de amido simples (ga), trigêmeos (gat) e quadrigêmeos (gaq), (barra = 10µ
µm).............62
9 Secção longitudinal da raiz mostrando traqueídes com numerosas pontoações (tp) nas
paredes laterais (barra = 20µ
µm).......................................................................................................62
10 Secção transversal da raiz mostrando súber (s), colênquima (co) e parênquima cortical
(pc), (barra = 20µ
µm)........................................................................................................................62
11 Detalhe das estrias de Caspary (es), (barra = 15µ
µm)..................................................................62
12 Região medular mostrando células parenquimáticas com numerosas pontoações (p),
(barra = 15µ
µm).................................................................................................................................63
13 Detalhe do súber (s) e esclereídes (barra = 20µ
µm)......................................................................63
14 Controle, (barra = 20µ
µm)................................................................................................................65
15 Reativo de Dragendorff mostrando região com alcalóides (a), (barra = 20µ
µm)........................65
16 Controle, (barra = 10µ
µm)................................................................................................................65
17 Reativo de Dragendorff mostrando detalhe da região com alcalóides (a), (barra = 10µ
µm)....65
18 Secção transversal mostrando súber (s) e parênquima cortical (pc), (barra = µm).................68
19 Detalhe do súber (s) e parênquima cortical (pc), (barra = µm)...................................................68
20 Secção transversal mostrando o cilindro vascular, região do floema (f) e xilema (x),
(barra = µm).....................................................................................................................................68
21 Detalhe das células com grãos de amido (ga) e ráfides (rf), (barra = 10µ
µm)............................68
22 Secção transversal mostrando súber (s), parênquima cortical (pc), tricomas (tr) e parte
do cilindro vascular com floema (f) e xilema (x), (barra = µm)...................................................69
23 Secção transversal mostrando súber (s) e parênquima cortical (pc) (barra = µm)..................69
24 Detalhe das estrias de Caspary (es), (barra = µm)......................................................................69
25 Grupos de esclereídes (es), região do floema (f) e do xilema (x) (barra = µm).........................70
26 Região medular do caule mostrando células parenquimáticas com numerosas
pontoações (p), (barra = µm).........................................................................................................70
27 Detalhe das pontoações (p) (barra = µm)....................................................................................70
28 Análise em CCD de alcalóides de raízes da espécie P. ipecacuanha, nativa da Amazônia.
Revelação: luz ultravioleta (365nm). (Pa: padrão emetina; N: nativa; a - u: amostras 1 a
21)....................................................................................................................................................72
29 Análise em CCD de alcalóides de raízes da espécie P. ipecacuanha, nativa da Amazônia.
Revelação: solução clorofórmica de iodo. (Pa: padrão emetina; N: nativa; a - u:
Amostras 1 a 21).............................................................................................................................72
30 Cromatogramas obtidos por CLAE do extrato bruto de raízes de P. ipecacuanha.
Gradiente com a seguinte fase móvel: água acidificada com ácido hexanosulfônico
(pH 2,6) e acetonitrila de 70 a 30% em 30 minutos. O fluxo foi de 1 ml/min., temperatura
de 30°C e detecção por UV a 285 nmG40L (amostra 2)..............................................................81
31 Cromatogramas obtidos por CLAE do extrato bruto de raízes de P. ipecacuanha.
Gradiente com a seguinte fase móvel: água acidificada com ácido hexanosulfônico
(pH 2,6) e acetonitrila de 70 a 30% em 30 minutos. O fluxo foi de 1 ml/min., temperatura
de 30°C e detecção por UV a 285 nm. G80E (amostra 17)..........................................................81
32 Cromatogramas obtidos por CLAE do extrato bruto de raízes de P. ipecacuanha.
Gradiente com a seguinte fase móvel: água acidificada com ácido hexanosulfônico
(pH 2,6) e acetonitrila de 70 a 30% em 30 minutos. O fluxo foi de 1 ml/min., temperatura
de 30°C e detecção por UV a 285 nm. - Padrão emetina.............................................................82
33 Cromatogramas obtidos por CLAE do extrato bruto de raízes de P. ipecacuanha. Sobreposição das amostras G40L (amostra 2), G80E (amostra 17) e Padrão emetina.
Gradiente com a seguinte fase móvel: água acidificada com ácido hexanosulfônico
(pH 2,6) e acetonitrila de 70 a 30% em 30 minutos. O fluxo foi de 1 ml/min., temperatura
de 30°C e detecção por UV a 285 nm............................................................................................82
LISTA DE TABELAS
1 Cultivo in vitro de P. ipecacuanha: origem do explante, meios de culturas, reguladores
de crescimento, resultados e as referências bibliográficas........................................................30
2 Indivíduos da espécie P. ipecacuanha cultivados em casa de vegetação e seus
respectivos ambientes.....................................................................................................................35
3 Indivíduos da espécie P. ipecacuanha cultivados em casa de vegetação e seus
respectivos tratamentos..................................................................................................................36
4 Comprimentos de folhas, caules, raízes e estípulas e peso das raízes das diversas
amostras de P ipecacuanha............................................................................................................51
5 Análise descritiva da média e desvio-padrão das folhas (comprimento e largura), caule
(comprimento), raiz (comprimento), estípulas (comprimento) e raízes (peso) de amostras
de P ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três
níveis de interceptação da radiação solar.....................................................................................52
6 Análise comparativa das médias dos comprimentos das folhas de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e de três
níveis de interceptação da radiação solar.....................................................................................53
7 Análise comparativa das médias das larguras das folhas de amostras de P ipecacuanha
nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis de
interceptação da radiação solar......................................................................................................54
8 Análise comparativa das médias dos comprimentos dos caules de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis
de interceptação da radiação solar................................................................................................55
9 Análise comparativa das médias dos comprimentos das raízes de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis
de interceptação da radiação solar................................................................................................56
10 Análise comparativa das médias dos comprimentos das estípulas de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis
de interceptação da radiação solar..............................................................................................57
11 Análise comparativa das médias dos pesos das raízes de amostras de P ipecacuanha
nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis de
interceptação da radiação solar....................................................................................................58
12 Ensaios de pureza para a amostra nativa e os respectivos limites farmacopéicos................71
13 Valores da média e desvio-padrão dos teores de alcalóides fenólicos, não fenólicos e
totais (%) nas raízes de P. ipecacuanha.......................................................................................73
14 Análise comparativa das variáveis “aluminete®” 80% e “aluminete®” 40% sob a
influência de três níveis de interceptação da radiação solar na concentração de alcalóides
não-fenólicos (%) das amostras de P. ipecacuanha...................................................................74
15 Análise comparativa das variáveis “aluminete®” 80% e “aluminete®” 40% sob a
influência de três níveis de interceptação da radiação solar na concentração de alcalóides
fenólicos (%) das amostras de P. ipecacuanha...........................................................................76
16 Análise comparativa das variáveis “aluminete®” 80% e “aluminete®” 40% sob a
influência de três níveis de interceptação da radiação solar na concentração de
alcalóides totais (%) das amostras de P. ipecacuanha..............................................................77
LISTA DE ABREVIATURAS E SIGLAS
a
alcalóides
AM
América Central
C
Colômbia
AACT
Academia Americana de Toxicologia Clínica
AIA
ácido indol-3-acético
AIB
ácido indol-3-butírico
ANA
ácido naftalenoacético
BA
6-benzilaminopurina
BAP
N-benzil-9-(2-tetraidropiranil)-adenina
CCD
cromatografia em camada delgada
CENARGEN Centro Nacional de Recursos Genéticos e Biotecnologia
cga
células com grãos de amido
CLAE
cromatografia líquida de alta eficiência
cm
centímetros
cols.
colaboradores
COPAM
Comissão de Política Ambiental
CPATU
Centro de Pesquisa Agroflorestal do Leste da Amazônia
E
Escuro
EAPCCT
Associação Européia dos Centros de Intoxicação e dos Toxicologistas
Clínicos
EMBRAPA Empresa Brasileira de Pesquisa Agropecuária
es
esclereides
f
floema
FAA 70
solução de formaldeído 37%, ácido acético, etanol 70%
g
grama
ga
grãos de amido
gat
grãos de amido trigêmeos
gaq
grãos de amido quadrigêmeos
G40
grupo 40%
G80
grupo 80%
GA3
ácido giberélico
IBAMA
Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais
Renováveis
IBGE
Instituto Brasileiro de Geografia e Estatística
K
kinetina
L
luminosidade
larg.
largura
M
molar
MG
Minas Gerais
min.
minutos
ml
mililitros
MMA
Ministério do Meio Ambiente
MS
Murashige & Skoog
N
nenhum
nm
nanômetros
NT
nativa
P.
Psychotria
p
Pa.
PA
pc
pH
pubesc.
p/V
rf
RJ
RPM
s
SR
UFLA
UV
USA
WP
x
2,4-D
µm
pontoações
padrão
Pará
parênquima cortical
potencial hidrogeniônico
pubescente
parte por volume
ráfides
Rio de Janeiro
rotações por minuto
súber
solução reagente
Universidade de Federal de Lavras
ultravioleta
United States of America
Wood Plant Liquid
xilema
ácido 2,4-diclorofenoxiacético
micrômetro
SUMÁRIO
1 INTRODUÇÃO.........................................................................................................15
1.1
Psychotria ipecacuanha (Brot.) Stokes.............................................................17
1.1.1
Aspectos botânicos..........................................................................................17
1.1.2
Aspectos químicos...........................................................................................19
1.1.3
Aspectos farmacológicos.................................................................................22
1.1.4
O extrativismo e comércio................................................................................24
1.1.5
Aspectos ecológicos e cultivo convencional.................................................26
1.1.6
Aspectos biotecnológicos................................................................................27
2
OBJETIVOS.............................................................................................................32
2.1 Objetivos
2.2
3
gerais...................................................................................................32
Objetivos específicos......................................................................................... 32
MATERIAIS E MÉTODOS.......................................................................................34
3.1
Material vegetal....................................................................................................34
3.1.1
Plantas obtidas da mata nativa........................................................................34
3.1.2
Plantas obtidas pela micropropagação e tratamentos..................................34
3.2
Estudo morfológico.............................................................................................36
3.3
Estudo anatômico................................................................................................37
3.3.1
Caracterização botânica microscópica...........................................................37
3.3.2
Testes Histoquímicos.......................................................................................37
3.4
Ensaios de pureza (Farmacopéia Brasileira 4ª edição)....................................37
3.4.1
Perda por dessecação......................................................................................38
3.4.2
Cinzas totais......................................................................................................38
3.4.3
Cinzas insolúveis..............................................................................................38
3.5
Presença de alcalóides por CCD (Farmacopéia Brasileira 4ª edição)............39
3.6
Doseamento de alcalóides (Farmacopéia Brasileira 4ª edição)......................39
3.6.1
Alcalóides não fenólicos..................................................................................40
3.6.2
3.7
Alcalóides Fenólicos........................................................................................41
Perfil cromatográfico do extrato alcaloídico e identificação da emetina
por CLAE............................................................................................................. 41
3.7.1
Preparação do extrato alcaloídico da poaia.................................................. 41
3.7.2
Preparação da solução padrão de emetina....................................................42
3.7.3
Condições cromatográficas............................................................................42
3.8
4
Análise dos dados..............................................................................................42
RESULTADOS E DISCUSSÃO...............................................................................44
4.1
Estudo morfológico............................................................................................44
4.1.1
Descrição macroscópica da planta nativa.....................................................44
4.1.2
Descrição macroscópica da planta cultivada in vitro, submetidas aos
diferentes tratamentos.....................................................................................48
4.1.3
Tratamentos estatísticos ................................................................................52
4.2
Estudo anatômico...............................................................................................59
4.2.1
Descrição microscópica da planta nativa......................................................59
4.2.2
Histolocalização dos alcalóides nas raízes da amostra nativa....................64
4.2.3
Descrição microscópica da espécie cultivada in vitro, submetidas aos
diferentes tratamentos (G40L, G40E, G40N; G80L, G80E, G80N).................66
4.3
Ensaios de pureza...............................................................................................71
4.4
Presença de alcalóides por CCD (Farmacopéia Brasileira 4ª edição)...........71
4.5
Doseamento de alcalóides (Farmacopéia Brasileira 4ª edição).....................73
4.5.1
4.6
5
Tratamentos estatísticos para os doseamentos de alcalóides
não-fenólicos, fenólicos e totais.....................................................................73
Perfil cromatográfico do extrato alcaloídico e identificação da emetina
por CLAE.............................................................................................................80
CONCLUSÃO..........................................................................................................83
REFERÊNCIAS BIBLIOGRÁFICAS..........................................................................86
ANEXO – Reagentes gerais.....................................................................................97
Apêndice A – Esquema de extração de alcalóides não-fenólicos e
fenólicos (Farmacopéia Brasileira, 1996)...............................................................99
Apêndice B – Média e desvio-padrão dos teores de alcalóides (%)
das amostras de P. ipecacuanha...........................................................................101
1. INTRODUÇÃO
O Instituto Brasileiro de Geografia e Estatística (IBGE) e o Ministério do Meio
Ambiente (MMA), dividem o Brasil em seis biomas: Amazônia, Cerrado, Caatinga,
Mata Atlântica, Pantanal e Pampas (IBGE, 2004). Considerado um dos países de
maior biodiversidade do planeta, com cerca de 55 mil espécies nativas Vieira, (1999)
distribuiu-as em seis biomas: Amazônia (30.000); Cerrado (10.000); Caatinga
(4.000); Mata Atlântica (10.000); Pantanal (10.000) e Floresta Subtropical (3.000).
Para o IBGE a floresta subtropical foi considerada como parte da Mata Atlântica.
A Mata Atlântica é uma formação florestal distribuída ao longo da costa
Brasileira. Originalmente formava uma faixa de mata contínua desde o Estado do
Rio Grande do Norte até o Rio Grande do Sul, abrangendo (até o início deste
século) cerca de 1.110.182 km2. Ela está distribuída ao longo de uma grande
variação latitudinal, ocupando cerca de trinta graus de latitude, desde seu limite
norte até o seu limite sul e uma grande variedade altitudinal, ocupando áreas desde
o nível do mar podendo chegar até aproximadamente três mil metros de altitude no
topo das serras. Esta distribuição geográfica ocasiona uma grande variedade
ambiental (clima, relevo, solo, etc.). Por conseqüência, encontramos na Mata
Atlântica uma grande variedade de espécies, concentrando neste ecossistema uma
parte considerável da biodiversidade da flora e da fauna do Brasil e do mundo
(VIEIRA, 1999; IBGE, 2004; BASE DE DADOS TROPICAL, 2005).
Hoje a Mata Atlântica é um dos ecossistemas mais ameaçados do planeta,
restando menos de 10% da sua cobertura original (VIEIRA, 1999; IBGE, 2004; BASE
DE DADOS TROPICAL, 2005).
Nos vários recursos naturais presentes na Mata Atlântica estão as espécies
medicinais, inclusive algumas ameaçadas de extinção devido a prática extrativista
estimulada pelo interesse econômico e o desenvolvimento da agricultura e pecuária
(VIEIRA, 1999). Dentre estas, destacamos a Psychotria ipecacuanha (Brot.) Stokes,
que apesar de seu valor farmacológico e sócio/econômico, observado ao longo da
sua história na terapêutica, é observada a cada dia com menor freqüência nos seus
locais de ocorrência. Estes fatos estão relacionados à destruição da mata com a
diminuição gradativa do habitat natural (SILVA, 2000).
15
A P. ipecacuanha tem como sinonímia vulgar ipeca, ipecacuanha,
ipecacuanha-verdadeira, poaia, poaia-verdadeira, papaconha, raiz-emética entre
outros (CORRÊA, 1969; LORENZI & MATOS, 2002). A denominação ipecacuanha
vem do indígena ipeckaaguene, que significa “trepadeira que faz vomitar”
(ROBBERS et al., 1997; LORENZI & MATOS, 2002). E, Poaia significa “a raiz
saudável” (GREGÓRIO, 1980).
Esta espécie pertence à família Rubiaceae, um grupo taxonomicamente bem
definido que segundo Cronquist (1981) é composta por cerca de 450 gêneros e 6500
espécies, sendo que o gênero Psychotria apresenta 800 espécies, número variável
ao longo do tempo. A família apresenta uma ampla distribuição geográfica e
concentra-se nas regiões tropicais e subtropicais.
A classificação da poaia tem
suscitado dúvidas ao longo do tempo. Inicialmente, foi denominada por Brotero
(1802) como Callicocca ipecacuanha Brot. (BROTERO, 1802, apud ASSIS &
GIULIETTI, 1999, p.205). Posteriormente, foi denominada com diferentes epítetos
como Psychotria ipecacuanha (Brot.) Stokes, Ipecacuanha officinalis Arruda ex
Koster, Cephaelis ipecacuanha (Brot.) A. Rich., Psychotria emetica Vell. e Uragoga
ipecacuanha Baill. O nome Cephaelis ipecacuanha (Brot.) A. Rich. tem sido o mais
utilizado. Steyermark em 1972 mencionou a dificuldade de separação dos gêneros
Cephaelis Sw. e Psychotria L. e considerou que apenas o último deles deveria ser
mantido (STEYERMARK, 1972 apud ASSIS & GIULIETTI, 1999, p.208). Esse
posicionamento é, também, aceito por outros especialistas (D. R. Simpson, J.
Kirkbride & E. Robbrecht, dados não publicados) (ASSIS & GIULIETTI, 1999). Neste
trabalho adotou-se, portanto, o nome Psychotria ipecacuanha (Brot.) Stokes. É
aceito como sinonímia científica os seguintes nomes para esta espécie: Callicocca
ipecacuanha Brot., Ipecacuanha officinalis Arruda ex Koster, Cephaelis ipecacuanha
(Brot.) A. Rich., Psychotria emetica Vell., Uragoga ipecacuanha Baill., Cephaelis
acuminata Karsten.
A grande procura por essa espécie fez com que também fossem
comercializadas as falsas poaias, que possuem propriedades semelhantes à
verdadeira devido à presença de emetina, embora nestas espécies o teor seja
menor. As principais apontadas são: Richardia brasiliensis Gomes (poaia branca) e
Richardia rosea St. Hil. (poaia do campo ou rosa), da família Rubiaceae; Hybanthus
ipecacuanha Taub., da família Violaceae; Polygala angulata DC. da família
16
Polygalaceae (LORENZI & MATOS, 2002; OLIVEIRA & MARTINS, 1998;
EMBRAPA, 2002).
1.1 Psychotria ipecacuanha (Brot.) Stokes
1.1.1 Aspectos botânicos
1.1.1.1 Descrição macroscópica
A poaia é um subarbusto, de caule fracamente lenhificado, com 30 a 50 cm
de altura. Quando atinge esse comprimento o caule vai se inclinando para o solo,
formando um falso rizoma que emite ramos aéreos e raízes laterais partindo dos
nós, transformando algumas delas em raízes tuberosas, de 15 a 30 cm de
comprimento e 0,6 a 1,7 cm de largura, com coloração variando do vermelho-tijolo
escuro ao marrom escuro.
Externamente, apresenta numerosos anéis rugosos separados entre si por
sulcos arredondados contornando completamente a raiz. Superfície lisa em corte
transversal, com larga casca espessa, uniformemente densa e muito dura. Rizomas
curtos, cilíndricos, de até 2 mm de diâmetro, finamente enrugados no sentido
longitudinal, com parênquima medular ocupando aproximadamente 1/6 do diâmetro
total.
As estípulas são concrescidas em bainha e à primeira vista parecendo uma
só. As folhas são simples, inteiras, opostas, ovaladas ou estreito-elípticas,
curtamente pecioladas, membranácea, peninervadas. O pecíolo é levemente
canaliculado. As flores são brancas, em capítulo terminal, envoltas em brácteas. O
fruto é do tipo baga, elipsóides, contendo duas sementes (BARROS, 1942;
CORREIA, 1969; FARMACOPÉIA BRASILEIRA, 1996; LAMEIRA, 2002; BRITISH
PHARMACOPOEIA, 2005; UNITED STATES PHARMACOPEIA, 2005).
17
1.1.1.2 Descrição microscópica de caule, raízes e rizomas
A raiz consiste em súber formado por três a quatro camadas de células
tabulares achatadas, de paredes finas e larga banda parenquimática de feloderme.
O parênquima cortical, muito desenvolvido, é constituído por um tecido de células
repletas de grãos de amido e de células maiores com rafídeos de oxalato de cálcio.
Os grãos de amido são simples ou, mais freqüentemente, compostos de duas a oito
unidades; os grãos trigêmeos mostram, muitas vezes, um componente menor e os
quadrigêmeos, dois componentes menores. Grãos individuais, ovais, arredondados
ou grosseiramente hemisféricos possuem, raramente, mais de 15 µm de diâmetro. O
floema é muito reduzido, desprovido de fibras, e constituídos de células mais
estreitas, em relação ao xilema. O xilema é denso, consistindo principalmente em
traqueídeos estreitos, misturados com proporção menor de vasos, ambos com
pontoações simples e areoladas nas paredes laterais. A zona lenhosa não mostra
raios medulares distintos; suas células aparecem fibrosas, com poros oblíquos e
encerram grãos de amido; as demais partes da zona lenhosa são constituídas, na
secção transversal, de elementos muitos uniformes; e finalmente, um parênquima
lenhoso. O rizoma apresenta, na seção transversal de um entrenó, várias camadas
de casca com paredes finas. O córtex é ligeiramente colenquimatoso; periciclo com
grupos de grandes esclereídeos, claramente pontuados, com pequeno anel de
floema e largo anel de xilema, circundando parênquima medular composto por
células com pontoações areoladas, de paredes finas.
Os caules jovens em corte transversal apresentam córtex bem desenvolvido,
com cerca de 20 fileiras de células, com endoderme evidente e estrias de Caspary.
Na estrutura secundária o xilema apresenta os elementos de vaso com diâmetro
praticamente igual ao das fibras e são evidentes camadas de crescimento
(OLIVEIRA et al., 1998; FARMACOPÉIA BRASILEIRA, 1996; ASSIS & GIULIETTI,
1999; UNITED STATES PHARMACOPEIA, 2005).
18
1.1.2 Aspectos químicos
1.1.2.1 Composição química
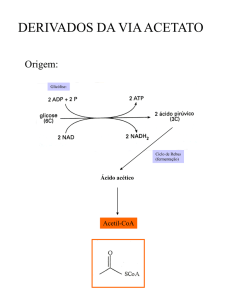
A poaia, dependendo da idade de sua raiz, pode conter de 2 a 2,7% de
alcalóides totais, sendo os mais importantes a emetina, a cefalina e a psicotrina
(Figura 1), que conferem a planta suas propriedades terapêuticas (PARIS &
MOYSE, 1971; HASEGAWA, et al., 2002). A emetina atua principalmente como
expectorante e amebicida, enquanto que a cefalina é responsável pela atividade
emética. De acordo com a farmacopéia americana o conteúdo de emetina e cefalina
não deve ser menor do que 90% dos alcalóides totais. (ROBBERS et al., 1997;
KLAASSEN, 2006; GARCIA et al., 2005; UNITED STATES PHARMACOPEIA,
2005).
Do extrato das raízes e rizomas da ipeca foram isolados vários outros
alcalóides como protoemetina, emetamina, 9-demetilprotoemetinol, neocefalina,
isocefalina, 7`-O-demetilcefalina, 10-O-demetilcefalina, O-metilpsicotrina e doze
glicosídeos monoterpenos-tetraidroisoquinolínicos como 6-O-metilipecosídeo, ácido
ipecosídeo,
alangisídeo,
demetilalangisídeo,
neoipecosídeo,
7-O-metil-
neoipecosídeo, 7-O-metilipecosídeo, 3,4-desidroneoipecosídeo, trans-cefalosídeo,
cis-cefalosídeo, 6-O-metil-trans-cefalosídeo e 6-O-metil-cis-cefalosídeo (Figura 1)
(HATFIELD et al., 1981; ITOH et al., 1991; NAGAKURA et al., 1993; ITOH et al.,
1994; ITOH et al., 1999).
A droga vegetal possui ainda grande quantidade de amido (30 a 40%), além
de açúcares redutores, resinas, tanino, ácido málico, cítrico e ácido ipecacuânhico.
(LAMEIRA, 2002).
19
(A)
(B)
H3CO
H3CO
R1O
N
H
H
N
H3CO
H
R1
R2
H
H
H
OCH3
OR3
HN
N
R4
OR2
(C)
(D)
H3CO
H3CO
R1
N
NAc
R2O
H
R3
H
H
H
OGlc
H
N
R4O2C
OCH3
O
OCH3
Figura 1 - Alcalóides isolados de P. ipecacuanha
(A)
Emetina
Cefalina
Neocefalina
7’-O-demetilcefalina
10-O-demetilcefalina
(B)
Psicotrina
O-metilpsicotrina
Alangicina
(C)
Emetamina
(D)
Ipecosídeo
6-O-metilipecosídeo
Ácido ipecosídeo
Neoipecosídeo
7-O-metilneoipecosídeo
R1
R2
R3
R4
CH3
CH3
CH3
CH3
H
H
H
OH
H
H
CH3
CH3
CH3
H
CH3
OCH3
OH
H
OH
OH
H
H
OH
H
CH3
H
-
-
-
-
-
-
OH
OCH3
OH
H
H
H
H
H
H
CH3
H
H
H
OH
OH
CH3
CH3
H
CH3
CH3
20
1.1.2.2 Doseamento de alcalóides
A Farmacopéia Brasileira 4ª edição (1996) preconiza o doseamento dos
alcalóides totais da ipeca (não fenólicos e fenólicos) por espectrofotometria no
visível, enquanto que a Americana (UNITED STATES PHARMACOPEIA, 2005) e a
Britânica (BRITISH PHARMACOPOEIA, 2005) preconizam método volumétrico por
titulação indireta. O teor especificado em todas as farmacopéias é de no mínimo 2%
de alcalóides totais expressos em emetina.
Em 1981 Hatfield e cols. descreveram um método para determinação dos
alcalóides da poaia por cromatografia líquida de alta eficiência (CLAE). Amostras do
Panamá foram misturadas com hidróxido de amônio (23%) e extraídas com éter
etílico. Uma alíquota foi evaporada até secura e o resíduo redissolvido com
diclorometano-metanol (25:1). Como fase móvel foi utilizado um sistema de
solventes que consistiu em diclorometano-metanol-hidróxido de amônio (250:10:1).
O fluxo do solvente programado foi de 1 a 4 ml/min. em um período de 10 min. com
detector ultravioleta (UV) a 280 nm. O conteúdo de emetina variou de 0,42% a
1,60% e o de cefalina de 0,76% a 1,82%.
Teshima e cols., (1984) quantificou o conteúdo de emetina e cefalina de
amostras da América do Sul e do Japão e obteve uma variação de 0,6 a 1,43% de
emetina e 0,72 a 3,33% de cefalina.
Amostras de ipeca coletadas em Visconde do Rio Branco (MG) e Itaperuna
(RJ), durante um ano, foram analisadas por CLAE. A extração dos alcalóides foi feita
utilizando-se uma amostra de raiz seca e pulverizada, misturada sob agitação com
NH4OH e extraído com éter etílico. A mistura foi centrifugada e a fase orgânica
removida por evaporação até secura. O resíduo obtido foi redissolvido na fase móvel
constituída por 0,25 M de acetato de sódio (pH 5) e acetonitrila (9:5), em condições
isocráticas. O fluxo foi 0,5 ml/min., com detecção por monitoramento da absorbância
a 288 nm. A identificação da emetina foi feita por comparação do seu tempo de
retenção com o padrão analisado em idênticas condições. A quantificação foi
realizada pelo método do padrão externo, com curva de calibração. O conteúdo de
emetina de amostras coletadas em Itaperuna variou de 0,18% à 1,55%, enquanto
que o de cefalina de 0,08% à 0,52%.
21
As amostras coletadas em Visconde do Rio Branco apresentaram um
conteúdo de emetina que variou de 0,81% à 2,24% e de cefalina de 0,07% à 0,28%.
Nesses estudos observou-se que o conteúdo de emetina apresentava significativa
variação na planta dependendo do local e época de coleta, de algumas
características físicas da raiz, do nível de luminosidade incidente no local não só em
relação a população investigada, mas também entre os vários indivíduos de uma
mesma população. O conteúdo de cefalina apresentou variação sazonal significativa
apenas em relação à “reboleira” amostrada. Nenhum padrão claro de sazonalidade
que explicasse as oscilações no teor de emetina ou cefalina observadas durante o
período de investigação pôde ser identificado (GARCIA et al., 2001, 2005).
Vários outros trabalhos foram publicados, empregando-se esta mesma
técnica cromatográfica, com alcalóides de outras espécies como, por exemplo, de
folhas de tabaco (Nicotiana attenuata Torrey ex Watson), de raízes de Catharanthus
roseus (L.) G. Don, de culturas de células híbridas de Rauvolfia serpentina (L.)
Benth. ex Kurz e Rhazya stricta Decne. e de alcalóides tropânicos em cultura de
tecidos de Datura innoxia Mill. e Atropa belladonna L.. Em todos estes trabalhos
foram utilizadas colunas de fase reversa C18 e gradientes de fase móvel com
metanol ou água acidificada com tampão fosfato ou com ácido hexanosulfônico e
acetonitrila. O fluxo variou de 1 a 2 ml/min. e a detecção foi monitorada no UV a 210,
254, 320 e 365 nm e por eletrtoforese capilar acoplada com espectrômetro de massa
(KEINÄNEN et al., 2001; TIKHOMIROFF & JOLICOEUR, 2002; STÖCKIGT et al.,
2002; KURSINSZKI et al., 2005).
1.1.3 Aspectos farmacológicos
O xarope de ipeca foi amplamente utilizado em nível hospitalar e domiciliar
como emetizante em casos de envenenamento por ingestão e apresentava bom
resultado, ou seja, a êmese ocorria em 93 a 100% dos casos (GORDON 1985;
BARBOSA et al. 1986; BARTSCHERER, 1997; PARIS, 1999). Se a êmese não
ocorresse em vinte ou trinta minutos, administrava-se uma segunda dose, e se ainda
22
não ocorresse procedia-se à lavagem gástrica. Relatos de uso em crianças
apontavam para episódios de sonolência em 20% e diarréia em 25% delas.
O emprego oficial, conforme a Farmacopéia Brasileira primeira, segunda e
terceira edições e a Farmacopéia Americana, era na forma de pó, tintura, extrato
fluido e xarope. A posologia recomendada do xarope como vomitivo é de 15 a 30 ml,
e como expectorante é de 0,05 a 0,2 g (70 a 100g de poaia/L de xarope)
(KLAASSEN, 2006; FARMACOPÉIA BRASILEIRA, 1959, 1977; PARIS, 1999;
SILVA, 1929; UNITED STATES PHARMACOPEIA, 2005).
O efeito emético é devido a sua ação local irritante sobre o trato entérico e,
seu efeito sobre a zona de disparo quimioreceptora na área póstrema do bulbo
(KLAASSEN, 2006 ROBBERS et al., 1997; SIMÕES et al., 2003). A dosagem
administrada deve ser cuidadosamente controlada, tendo em vista a significativa
toxicidade se administrada em doses acima da terapêutica. A superdosagem pode
causar
cardiomiopatia,
fibrilação
ventricular
e
morte
(KLAASSEN,
2006;
BARTSCHERER, 1997).
Atualmente há controvérsias em torno da escolha do xarope de ipeca para
indução de êmese no tratamento de intoxicações. Alguns autores afirmam que esta
é uma escolha segura e eficaz (GORDON 1985; BARBOSA et al., 1986; PARIS,
1999), enquanto outros questionam sua segurança, sugerindo que outras
intervenções, como o carvão ativado, teriam eficácia semelhante, com maior
margem de segurança (BOLETIM FARMACOTERAPÊUTICA, 2005). Por isso a
Academia Americana de Toxicologia Clínica (AACT) e a Associação Européia dos
Centros de Intoxicação e dos Toxicologistas Clínicos (EAPCCT) não recomendam o
uso do xarope de ipeca em salas de emergências (KRENZELOK, 2002;
BUCARETCHI & BARACAT, 2005).
Young & Bivins (1993), comparam a eficácia da lavagem gástrica e da
indução da êmese pelo xarope de ipeca no esvaziamento gástrico após ingestão de
marcadores radioativos, tendo o xarope maior efetividade. Outros autores relatam o
uso do xarope em casos de bulimia, alertando para o risco da toxicidade
(BARTSCHERER, 1997).
A poaia é ainda utilizada como diaforética e no tratamento de doenças
relacionadas ao trato respiratório, como por exemplo, coqueluche, bronquite e asma
(KLAASSEN, 2006). Atualmente são encontrados no mercado alguns medicamentos
23
contendo preparações
de ipeca, como Cardus
Benedictus® -
Granado®
(anticatarral); Ki-expectorante - Cimed; Gosmil® - Jofadel® (anti-séptica e
antitussígena para uso veterinário); Fenergan® - Rhodia Pharma® (expectorante).
Outro emprego da poaia é como amebicida, pois a emetina destrói as formas
tecidulares da ameba, Entamoeba histolytica, implicada na desinteria amebiana.
Contudo, devido à toxicidade que a emetina e o seu derivado semi-sintético, a
desidroemetina, apresentam, a terapêutica passou a utilizar o metronidazol, que
apresenta atividade carcinogênica (Raether & Hanel, 2003; KLAASSEN, 2006).
1.1.4 O extrativismo e comércio
A pressão econômica e a coleta descontrolada colocaram a poaia na lista das
espécies em ameaça de extinção pelo Instituto Brasileiro do Meio Ambiente e dos
Recursos Naturais Renováveis, o IBAMA (EMBRAPA, 2002; IBAMA, 2007). Em
Minas Gerais ela também consta da Lista das espécies ameaçadas de extinção
elaborada pela Comissão de Política Ambiental – COPAM (COPAM, 1997). Várias
excursões realizadas na região de Mata Atlântica do entorno do Parque Nacional do
Caparaó confirmam esta ameaça, uma vez que alguns botânicos não registraram a
presença desta espécie (GRANDI, 1993; LEONI, 1997; LEONI & SOUZA 1999).
Para a realização deste trabalho, novas excursões foram realizadas na região
pela professora Dra. Ana Maria Dantas Barros e colaboradores, entre os anos de
2003 e 2006, num total de oito expedições, não encontrando a espécie. Este fato
acarretou mudanças nos objetivos originais do trabalho, com a troca da espécie de
ocorrência da Região Sudeste, para aquela nativa da Região Amazônia.
No início do século passado o extrativismo da poaia em várias regiões foi tão
significativo, que em 1918, no Estado do Mato Grosso, foi criada uma lei que visava
controlar sua coleta, assim como beneficiar os indivíduos que a cultivavam
sistematicamente, através de prêmios em dinheiro e abatimentos no valor do
imposto de exportação (OLIVEIRA & MARTINS, 1998; BARROS, 1942). Durante a
década de 40, houve uma tentativa de regulamentar a colheita (BOTELHO, 1942). A
época permitida por lei era de novembro a abril, quando se extraía, por dia, cerca de
24
100 a 1000 g de raízes de uma grande mata, conhecida como “mata da poaia”, que
ia das proximidades de Cárceres até a serra de Tapirapoan (BARROS, 1942).
Para a colheita da poaia empregava-se o “saracuá”, um instrumento
composto basicamente de um cone de ferro oco preso em um cabo de madeira, que
era manejado com facilidade pelos “poaieiros”. Nesta coleta predatória, a planta era
arrancada do solo intacta, incluindo suas raízes (BARROS, 1942). Alguns municípios
mineiros cresceram e se desenvolveram a partir da extração e comércio da poaia,
como Visconde do Rio Branco e Muriaé. O extrativismo alcançou seu ápice na
década de 40, quando a extração da poaia chegou a 400 toneladas em um ano
(ASSIS, 1992; OLIVEIRA & MARTINS, 1998; GARCIA, 2001). A produção nesta
época se destinava principalmente à exportação para países como Inglaterra,
Estados Unidos e Canadá, além do consumo interno (LAMEIRA, 2002). Diante desta
situação, no editorial da Revista Brasileira de Farmácia, de 1945, foi defendida a
importância da proteção da poaia e o seu cultivo. Em 1960 o Brasil chegou a
exportar mais ou menos 80 toneladas da raiz principalmente para a Europa
(SKORUPA & ASSIS, 1998) e em 1961 sai o decreto nº 264 proibindo a sua
exportação (IBAMA, 1996). Em 1969, Rennó defendeu a criação de um programa de
proteção às espécies medicinais, alertando em particular, para a coleta depredativa
desta espécie. De 1980 a 1993 essa exportação diminuiu substancialmente, nunca
excedendo 7,5 toneladas/ano (SKORUPA & ASSIS, 1998). Dados da FIOCRUZ
apontam para 6,6 toneladas de raiz de ipeca em 1992 (GARCIA, 1998).
Em 1998, a exportação da poaia se encontrava limitada no Brasil devido ao
difícil acesso ao material espontâneo nas matas e as questões legais e ambientais,
sendo que a demanda mundial girava em torno de 100 toneladas por ano. Parte
desta demanda era suprida pela C. acuminata, exportada da Colômbia, Nicarágua e
Costa Rica (YOSHIMATSU & SHIMOMURA, 1994; SKORUPA & ASSIS, 1998).
Apesar de a poaia constar da lista de plantas proibidas para exportação,
informações da Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA) apontam que
o extrativismo das suas raízes ainda ocorre, principalmente, no Mato Grosso e
Rondônia, sendo o mercado externo o principal comprador (EMBRAPA, 2002;
LAMEIRA, 2002).
A diminuição dos locais de coleta aliado ao alto valor de exportação, cerca de
40 US$ o quilo, estimulou o cultivo dessa espécie, sendo que a Índia e Malásia
25
foram os primeiros países que obtiveram êxito nesse cultivo (YOSHIMATSU &
SHIMOMURA, 1994; SKORUPA & ASSIS, 1998).
1.1.5 Aspectos ecológicos e cultivo convencional
A poaia é nativa de regiões sombreadas e úmidas de florestas tropicais da
América, preferindo solos sílico-argilo-humífero, principalmente quando ricos em
ferro. Possui populações remanescentes na América Central (Panamá e Costa
Rica), América do Sul (Colômbia, Venezuela, Peru, Equador, Bolívia e Guianas),
parte ocidental da Amazônia Brasileira (Mato Grosso, Rondônia e Pará) e ao longo
da costa Atlântica Brasileira (principalmente no Rio de Janeiro, Minas Gerais,
Espírito Santo, Pernambuco e Bahia). Porém, a área de maior ocorrência no Brasil,
atualmente, fica no Estado de Mato Grosso, principalmente no município de
Cárceres (BARROS, 1942; ALENCAR & SANTOS, 1980; LAMEIRA, 2002; ROSSI et
al., 2005). No Estado de Minas Gerais, originalmente, ocorria na faixa florestal que
se estende por todo leste, sudeste e sul do estado (Silva, 2000).
A poaia se desenvolve em agregados perenes denominados “reboleiras”, as
quais se dispõem de forma circular ou elíptica (ROSSI et al., 2005). Neto & Morais
(2003) encontraram esta espécie também no Cerrado de Mato Grosso. Em
condições naturais, sua propagação natural envolve um pássaro chamado “poaieiro”
(Lipaugus vociferans), também denominado de cricrió ou tropeiro, que se alimenta
com os frutos da espécie (SICK, 1993). De acordo com Almeida & Alves (2000) uma
outra espécie de ave do mesmo gênero (Lipaugus lanioides), é considerada como
consumidora de frutos de duas outras espécies de Psychotria. Eventualmente pode
haver propagação vegetativa por fragmentos do caule ou raiz no solo.
Para Garcia (2001) o conteúdo de alcalóides no habitat pode variar
significativamente nas reboleiras localizadas num único fragmento florestal. Mesmo
sob efeitos de condições ambientais similares, os teores de alcalóides variam
mesmo assim, indicando que a seleção de genótipos mais produtivos em alcalóides
pode ser viável. Os teores podem variar dependendo das condições de
sombreamento local onde as reboleiras se desenvolvem, refletindo inclusive nas
26
características morfológicas. A variação de alcalóides não apresenta um padrão
claro de sazonalidade (Garcia, 2001). A literatura mostra poucos trabalhos
relacionados a esta questão, demonstrando que estes estudos não são conclusivos.
Esta espécie é passível de se adequar a um cultivo economicamente viável e
nesse aspecto pode ser um modelo para estudos de sistemas economicamente
aproveitáveis da biodiversidade. Uma das dificuldades do cultivo convencional devese ao fato da semente perder rapidamente seu poder germinativo, sendo a sua
propagação realizada, geralmente, através de estacas obtidas de fragmentos de
caules e raízes (PINTO, 1976; YOSHIMATSU & SHIMOMURA, 1994; OLIVEIRA &
MARTINS, 1998). A colheita da poaia deve ser feita quando a planta atinge seu
pleno desenvolvimento. Em plantas provenientes de cultivo sob sombreamento
artificial (sombrite), sugere-se que uma semana antes da colheita, remova-se a
cobertura artificial para induzir um aumento do teor de emetina nas raízes
(LAMEIRA, 2002).
Na última década iniciou-se no Brasil um esforço para preservar a
variabilidade genética de plantas medicinais. O Centro Nacional de Recursos
Genéticos e Biotecnologia - CENARGEN - em colaboração com outros centros de
pesquisa da EMBRAPA e algumas universidades têm um programa para estabelecer
um banco de germoplasma de espécies medicinais e aromáticas. Em várias
expedições realizadas cobrindo alguns estados brasileiros, de 1988 até 1991, a
poaia foi encontrada em vários acessos (VIEIRA, 1999).
Skorupa & Assis (1998) iniciaram um trabalho de sua manutenção num banco
de germoplasma, localizado em Belém (PA), no Centro de Pesquisa Agroflorestal do
Leste da Amazônia (CPATU/EMBRAPA). Outras coleções de germoplasma foram
estabelecidas na Universidade do Norte Fluminense, provenientes de 10 acessos da
Mata Atlântica nos Estados do Rio de Janeiro e São Paulo (VIEIRA, 1999).
1.1.6 Aspectos biotecnológicos
O cultivo vegetal in vitro é um processo por meio dos quais fragmentos
vegetais, denominadas explantes, são retirados dos organismos, transferidos para
27
serem cultivados sobre um meio de cultura apropriado em condições assépticas. A
partir deste cultivo podem ser regeneradas células amorfas (calos), órgãos e brotos,
que dependendo do meio e das condições irão regenerar a planta, inicialmente
chamada de plântula quando ainda jovem. Essas são cultivadas no laboratório em
substrato asséptico, formando plantas inteiras e, posteriormente, levadas à casa-devegetação para aclimatação antes de serem transferidas para o campo
definitivamente (AMARAL & SILVA, 2003).
Durante o cultivo celular, a cultura se estabelece aleatoriamente, a partir do
explante. E, desta forma pode-se obter numerosas fontes celulares, cada uma com
um fenótipo particular. Uma das estratégias adotadas para a obtenção de diferentes
fenótipos celulares é a combinação de diferentes reguladores de crescimento, os
chamados hormônios vegetais. (PERES, 2002; AMARAL & SILVA, 2003). São
substâncias orgânicas que, estando presentes em concentrações muito baixas,
controlam os processos biológicos das células e tecidos, promovendo crescimento e
desenvolvimento
normais.
Estas
substâncias
tiveram
seu
isolamento
e
caracterização química nos anos 40, propiciando amplo avanço nas técnicas que
constituem a biotecnologia atual. São agrupadas em duas classes: auxinas
(reguladoras do processo de crescimento celular e citodiferenciação) e citocininas
(reguladoras do crescimento celular e outros processos) (MURASHIGE & SKOOG,
1962; FRANÇA, 2003). O tipo e a concentração de auxinas e citocininas, ou a
proporção auxina/citocinina pode alterar o crescimento e a formação de substâncias
em culturas de células vegetais (Batistine et al., 2002; Reis et al., 2004).
Como exemplo de auxinas pode-se citar: ácido 2,4-diclorofenoxiacético (2,4D); ácido indol-3-acético (AIA); ácido indol-3-butírico (AIB) ácido naftalenoacético
(ANA) entre outros. E, como citocininas: 6-benzilaminopurina (BA); Kinetina (K); Nbenzil-9-(2-tetraidropiranil)-adenina (BAP), entre outros.
A variabilidade espontânea que ocorre quando se estabelece um cultivo,
também permite esperar uma produção de metabólitos secundários variáveis em
qualidade e quantidade. Um cultivo in vitro pode não produzir metabólitos
secundários, produzir muito pouco ou em quantidades superiores ao da planta de
origem.
(ZENK,
1975;
DANTAS-BARROS
&
JACQUIN-DUBREUIL,
1994;
VASCONSUELO & BOLAND, 2007). Um dos fatores cruciais na produção e acúmulo
destes metabólitos secundários são os reguladores de crescimento. A possibilidade
28
de se aumentar e otimizar o conteúdo de determinados princípios ativos no cultivo in
vitro, pode ser alcançado através da seleção, tratos culturais, mantido através de
procedimentos adequados, e também através do uso de determinadas substâncias,
que estimulam a produção e acúmulo destas substâncias, os chamados elicitores
(PLETSCH, 1998; ZHONG, 2002; AMARAL & SILVA, 2003; VASCONSUELO &
BOLAND, 2007).
Uma estratégia para a produção de compostos ativos é a seleção de clones
altamente produtores e sua propagação in vitro. A micropropagação oferece
vantagens como a maior rapidez na obtenção de um grande número de mudas e a
erradicação das pragas e doenças da cultura, principais responsáveis pela baixa
produtividade da planta. A clonagem in vitro é particularmente útil para a
conservação de espécies ameaçadas e a propagação daquelas recalcitrantes ou de
ciclo de vida longo (PLETSCH, 1998).
Vários autores relataram a tentativa do cultivo in vitro da poaia. A formação de
brotos, calos e/ou plântulas a partir de explantes de folhas, segmentos internodais,
sementes ou de raízes foi conseguida, adicionando-se diversos reguladores de
crescimento ao meio de cultura. O meio mais freqüentemente utilizado foi aquele
desenvolvido por Murashige & Skoog - MS (1962). Outros meios também foram
testados, como os desenvolvidos por Gamborg, por Schenk & Hildebrandt e WP
(wood plant liquid). Alguns autores quantificam a produção dos alcalóides emetina e
cefalina por calos ou raízes. Para melhor visualização dos resultados obtidos em
relação à concentração dos reguladores de crescimento e ao tipo de meio de cultura
utilizado, essas informações foram resumidas na Tabela 1.
29
Tabela 1 - Cultivo in vitro de P. ipecacuanha: origem do explante, meios de culturas,
reguladores de crescimento, resultados e os respectivos autores
Origem do
explante
Meio de
cultura
Gamborg
Cotilédone
Brotos das
sementes
Schenk &
Hildebrandt
MS
MS
Raiz
MS
(metade da
conc.)
Segmentos
Gamborg
internodais
Segmentos
de folhas MS (líquido)
de brotos
in vitro
Segmentos
internodais
Segmentos
de raízes
WP
MS
MS
Folhas
Resultados / reguladores de
crescimento
Formação de calo / AIB (8 mg/l);
AIA (4 mg/l); ANA (4 mg/l)
Melhor rendimento de alcalóides cefalina
(0.93%) e emetina (0.346%) / AIB (8
mg/l); AIA (4 mg/l); ANA (4 mg/l)
Formação de brotos / K (8 mg/l); ANA
(0,05 mg/l); adenina (200 mg/l)
Formação de raízes / AIB (2 mg/l)
Produção de emetina e cefalina a partir
do calo / AIB; AIA
Formação de calo / 2,4-D; ANA
Produção de emetina e cefalina a partir
de raízes / AIB (0,25 mg/l)
Autores
Jha et al.
(1988)
Jha & Jha
(1989)
Jha et al.
(1991)
Formação de brotos / BA (0,01 a 0,1
mg/l); K (0,1 mg/l)
Formação de raízes adventícias e
produção de emetina (0.6 mg) e cefalina
(2.4 mg) / AIA (0,01 mg/l)
Yoshimatsu &
Shimomura
(1991)
Formação de brotos
BA (0,01 a 0,1 mg/l); K (0,1 mg/l)
Produção de emetina (0,04 a 0,07%) e
cefalina (0,4 a 0,5%)/BA (0,01 a 0,1 mg/l)
Formação de plântulas
AIB:BAP (4:1mg/l e 2:1mg/l)
Formação de calo / 2,4-D (4.0 mg/l);
K (0.5 mg/l)
Diferenciação do calo em brotos / K (4.5
mg/l); 0.1 mg/l ANA
Hidalgo et al.
(1992)
Rout et al.
(1992)
MS (líquido
- metade da
conc.)
Produção de raízes e desenvolvimento
em plântulas / ANA (0,1 a 1,0 mg/l)
Folhas
Não
informado
Produção de cefalina (1%) a partir de
calo
Veeresham et
al.
(1994)
Folhas
MS
Segmentos
internodais
WP
Formação de raízes adventícias / ANA
(0,5 a 3 mg/l)
Formação de brotos adventícios / BA
(0,01 a 0,1 mg/l); K (0,1 mg/l)
Yoshimatsu &
Shimomura
(1994)
Não
informado
Schenk and
Hildebrandt
Formação de calo / ANA 3,0 mg/l
Cedeira et al.
(1995)
30
TABELA 1 - Cultivo in vitro de P. ipecacuanha: origem do explante, meios de culturas,
reguladores de crescimento, resultados e os respectivos autores (continuação)
Origem do
explante
Segmentos
internodais
Segmentos
internodais
Folhas
Não
informado
Segmentos
internodais
Meio de
cultura
MS
Gamborg
MS
(metade da
conc.)
MS
Resultados / reguladores de
crescimento
Formação de raízes / AIB; GA3
Formação de brotos
Formação de raízes / AIB (4.92 µM)
Formação de brotos / BAP (6.66 µM)
Formação de calo / K (0,5 mg/l); 2,4-D
(4,0 mg/l)
Formação de embriões somáticos / K 2,5
MS
mg/l; 2,4-D 1,0 mg/l
Maturação e germinação de embriões
somáticos / com ausência de reguladores
Formação de brotos / BAP (1,5mg/l);
MS (líquido)
GA3 (0,5mg/l)
MS
Formação de brotos / BAP (1,5 mg/l)
Autores
Lameira et al.
(1994)
Costa et al.
(2000)
Rout et al.
(2000 e 2001)
Batistine et al.
(2002)
Reis et al.
(2004)
31
2. OBJETIVOS
2.1 Objetivos gerais
O objetivo do presente trabalho foi realizar o estudo quantitativo, experimental
(PEREIRA, 1995) da poaia (Psychotria ipecacuanha (Brot.) Stokes – Rubiaceae),
para comparação de aspectos morfoanatômicos, farmacoquímicos, validação
farmacognóstica/farmacopéica, entre plantas da espécie originária da região
Amazônica Brasileira, coletadas em fragmento de mata nativa, e aquelas cultivadas
in vitro e submetidas a diferentes tratamentos de interceptação da radiação solar,
visando, desta forma, dar suporte a estudos com fins de preservação, cultivo, uso
medicinal e ampliar o conhecimento biotecnológico desta espécie.
2.2 Objetivos específicos:
2.2.1 Nos indivíduos nativos realizar:
- Caracterização botânica:
● Macroscópica (raízes, rizomas e partes aéreas);
● Microscópica (raízes e rizomas).
- Ensaios gerais (raízes e rizomas):
● Perda por dessecação;
● Cinzas totais;
● Cinzas insolúveis.
- Verificação da presença de alcalóides por cromatografia em camada delgada –
CCD (raízes e rizomas);
- Doseamento de alcalóides totais (raízes e rizomas).
32
2.2.2 Nos indivíduos obtidos por processo biotecnológico cultivados in vitro,
submetidos a diferentes tratamentos de interceptação da radiação solar,
realizar:
- Caracterização botânica
● Macroscópica (raízes, rizomas e partes aéreas);
● Microscópica (raízes e rizomas).
- Verificação da presença de alcalóides por CCD nas raízes e rizomas;
- Doseamento de alcalóides não fenólicos e fenólicos nas raízes e rizomas;
- Obtenção do perfil cromatográfico do extrato alcaloídico e identificação da
emetina por CLAE nas raízes e rizomas.
2.2.3 Estudo comparativo entre a planta nativa e as cultivadas in vitro, e
submetidas a diferentes tratamentos de interceptação da radiação solar.
2.2.4 Validação farmacognóstica da planta nativa e daquelas obtidas por
processo
biotecnológico
e
submetidas
a
diferentes
tratamentos
de
interceptação da radiação solar.
33
3. MATERIAIS E MÉTODOS
3.1 Material vegetal
3.1.1 Plantas obtidas da mata nativa:
O material botânico estudado é procedente da região Amazônica (Estado do
Pará) e foi coletado em fragmento de mata nativa, em áreas da EMBRAPA
Amazônia Oriental (CPATU/EMBRAPA), próximo ao Horto Florestal, no município de
Belém/Pará. O município está localizado a 1° 27′ 21″ S de latitude e 48° 30′ 14″ W de
longitude, com altitude de 10 metros. O material foi coletado na fase vegetativa de
desenvolvimento e transferido para o Laboratório de cultura de tecidos da UFLA em
Lavras/MG
3.1.2 Plantas obtidas pela micropropagação e tratamentos:
O presente estudo foi conduzido no Laboratório de Cultura de Tecidos e
Plantas Medicinais da Universidade de Federal de Lavras (UFLA) a partir da
multiplicação das plantas obtidas em mata Amazônica nativa e fornecida pela
CPATU/EMBRAPA de Belém do Pará. A região de Lavras/MG se encontra a
21°14’S de latitude, 45°00’W de longitude e 918 metros de altitude, na região do sul
de Minas Gerais. Na obtenção deste material a planta nativa da Amazônia foi
multiplicada através do cultivo in vitro, a partir de fragmentos de segmentos
internodais, sobre o meio de cultura: Murashige e Skoog (1962), com o regulador de
crescimento BAP, na concentração de 2,0 mg/l de meio. Este processo permitiu a
obtenção de plântulas. Estas plântulas foram transferidas para se desenvolverem
numa casa-de-vegetação por dois anos, sob dois tipos de ambiente. O primeiro
ambiente se caracterizou por 40% de interceptação da radiação solar incidente, por
meio de tela refletora comercialmente denominada “aluminete®”. O segundo
34
ambiente se caracterizou por 80% de interceptação da radiação solar incidente, pelo
mesmo tipo de tela. As plantas obtidas após estes dois anos de cultivo formaram
dois grupos: Grupo 40% (G40) e Grupo 80% (G80).
As plantas do G40 e G80 receberam três tipos de tratamento e se dividiram
em subgrupos:
•
O primeiro subgrupo foi submetido a um estresse de luminosidade por dez
dias com 0% de interceptação da radiação solar (L).
•
O segundo subgrupo foi submetido a um estresse por dez dias, com
interceptação de 100% da radiação solar (escuro) (E).
•
O terceiro subgrupo permaneceu sob os respectivos “aluminetes®” até o dia
da coleta sem nenhum estresse (N).
Os grupos e subgrupos formados estão indicados nas Tabelas 2 e 3.
Para os procedimentos das análises realizadas, os subgrupos de cada
ambiente foram coletados todos ao mesmo tempo, na fase vegetativa.
Tabela 2 - Indivíduos de P. ipecacuanha cultivados em casa de vegetação e seus respectivos
ambientes
G40
01
02
03
04
05
06
07
08
09
10
11
G80
12
13
14
15
16
17
18
19
20
21
-
35
TABELA 3 - Indivíduos de P. ipecacuanha cultivados em casa de vegetação e seus
respectivos tratamentos
Tratamentos
0% de interceptação da
radiação solar
(por dez dias)
100% de interceptação da
radiação solar
(por dez dias)
Nenhum estresse
Subgrupos
L
E
N
G40
G80
01
12
02
13
03
14
04
15
05
16
06
17
07
18
08
19
09
20
10
21
11
-
Originando as amostras tratadas: G40L, G40E, G40N; G80L, G80E, G80N.
3.2. Estudo morfológico
A caracterização botânica macroscópica foi realizada nas partes aéreas,
folhas (forma e dimensão), caule (forma e dimensão) e nas raízes (forma, dimensão
e peso) de amostras nativas e cultivadas/tratadas de P. ipecacuanha. As
observações e medidas foram feitas a olho nu, com dispositivo semelhante a um
paquímetro e balança analítica (OHAUS, modelo AS120). Empregou-se material
vegetal fresco.
36
3.3 Estudo anatômico
3.3.1 Caracterização botânica microscópica:
Foi realizada nas partes aéreas (caule), raízes e rizomas de amostras nativas
e cultivadas, ainda frescas. Estas foram fixadas em FAA 70 (JOHANSEN, 1940) e
conservadas em álcool 70%. Foram realizadas secções transversais e longitudinais
à mão livre e coradas com solução de azul de astra e safranina segundo técnica
descrita por Johansen, 1940. As fotomicrografias foram obtidas em microscópio
Olympus CX-31, acoplado a uma câmara fotográfica Olympus SC-35.
3.3.2 Testes Histoquímicos:
Os testes histoquímicos para detecção de alcalóides foram efetuados na amostra
nativa utilizando material fresco. Os cortes obtidos foram submetidos aos seguintes
reagentes: ácido tartárico (controle) e reativo de Dragendorff (JOHANSEN, 1940).
3.4 Ensaios de pureza (Farmacopéia Brasileira 4ª edição)
Foram realizadas nas raízes de amostras nativas. O material foi submetido à
secagem em estufa sob temperatura de 40°C por três dias.
37
3.4.1 Perda por dessecação
Pesou-se, com precisão, cerca de 3g da amostra, em cápsula de porcelana
seca e previamente tarada. Dessecou-se a amostra em estufa, a 100°C ± 5oC, até
massa constante, por um tempo mínimo de 5 horas. Resfriou-se à temperatura
ambiente em dessecador. O cálculo da perda foi realizado como a porcentagem da
massa inicial, de acordo com a seguinte expressão:
% perda ={[(massa inicial da amostra) - (massa final da amostra)] / (massa inicial da
amostra)} x 100
3.4.2 Cinzas totais
Pesou-se, com precisão, cerca de 3 g do pó da amostra, em cadinho de
porcelana previamente calcinado e tarado. Calcinou-se o material em chapa
aquecedora e posteriormente incinerou-se em mufla, aumentando gradativamente a
temperatura, não ultrapassando 450oC até que todo o carvão tenha sido eliminado
totalmente. Resfriou-se em dessecador e pesou-se. Nos casos em que o carvão não
foi eliminado totalmente, resfriou-se o cadinho e umedeceu-se o resíduo com 2 ml de
água ou solução saturada de amônio. Evaporou-se até secura, em chapa quente e
incinerou-se até massa constante, não excedendo 450°C. Calculou-se o teor de
cinzas totais, em relação à droga seca, de acordo com a seguinte expressão:
% cinzas totais = [(massa do resíduo) / (massa inicial da amostra)] x 100
3.4.3 Cinzas insolúveis
Ferveu-se o resíduo obtido na determinação de cinzas totais, durante cinco
minutos, com 25 ml de ácido clorídrico 7% (p/V), em cadinho coberto com vidro de
relógio. Lavou-se o vidro de relógio com 5 ml de água quente, juntando esta água
38
ao cadinho. Recolheu-se o resíduo insolúvel em ácido sobre papel de filtro isento de
cinza lavando-o com água quente até que o filtrado se mostre neutro. Transferiu-se o
papel de filtro contendo o resíduo para o cadinho original, secou-se sobre chapa
aquecedora e incinerou-se a cerca de 500oC, até massa constante. Calculou-se a
porcentagem de cinzas insolúveis em relação à droga seca ao ar, de acordo com a
seguinte expressão:
% cinzas insolúveis em ácido = [(massa do resíduo)/(massa inicial da amostra de
cinzas totais)]x100
3.5 Presença de alcalóides por CCD (Farmacopéia Brasileira 4ª edição)
Foram realizadas nas raízes de amostras das plantas nativas e cultivadas,
secas em estufa sob temperatura de 40°C por três dias. Empregaram-se placas
cromatográficas de sílica-gel GF254 com espessura de 250 µm. A fase móvel foi
constituída de mistura de clorofórmio, metanol, hidróxido de amônio (93:6,5:0,5).
Solução amostra: pesou-se 0,1 g da amostra pulverizada, adicionar uma gota
de hidróxido de amônio e 5 ml de clorofórmio e manteve-se sob agitação vigorosa.
Deixou-se repousar por trinta minutos e filtrou-se em seguida.
Solução de referência: pesou-se 0,005 g de dicloridrato de emetina padrão e
dissolveu-se em 20 ml de metanol.
As cromatoplacas foram reveladas sob luz ultravioleta (365 nm) e nebulizadas
com solução clorofórmica de iodo a 0,5% (p/V) aquecendo a 60°C por dez minutos.
Em seguida nebulizadas com o reativo de Dragendorff SR.
3.6 Doseamento de alcalóides (Farmacopéia Brasileira 4ª edição)
Realizou-se nas raízes de amostras das plantas nativas e cultivadas, secas
em estufa sob temperatura de 40°C por três dias. O esquema referente a esta
extração encontra-se no apêndice 1.
39
3.6.1 Alcalóides não fenólicos
Pesou-se exatamente cerca de 1g da droga dessecada (100-105°C),
finamente pulverizada (250µm) e transferiu-se para erlenmeyer de 100 ml,
previamente seco e tarado. Adicionou-se 20 ml de éter etílico e a mistura foi agitada
mecanicamente por cinco minutos. Adicionou-se 5 ml de hidróxido de amônio a 25%
SR, e manteve-se a agitação por mais uma hora. O volume original foi completado
com éter etílico. Procedeu-se a filtração sob chumaço de algodão e repetiu-se a
operação até reação de Mayer negativa. Os filtrados foram reunidos e uma alíquota
de 10 ml foi transferida para funil de separação. Extraiu-se com alíquotas de 5 ml de
hidróxido de sódio M até reação negativa com reativo de Mayer. Os extratos
alcalinos foram reunidos, transferidos para outro funil de separação e agitados com
15 ml de éter etílico. A solução alcalina foi transferida para balão volumétrico de 100
ml e reservada para o doseamento de alcalóides fenólicos. Reuniu-se a solução
etérea inicial à solução etérea da última extração e evaporou-se sob temperatura de
50-60°C. O resíduo isento de odor de éter foi dissolvido em 2 ml de etanol e
acidificado com 5 ml de ácido clorídrico 0,5 M, sendo posteriormente transferido para
balão volumétrico de 100,0 ml, completando o volume com água destilada. Retirouse dessa solução uma alíquota de 5 ml, e em seguida adicionou-se 5 ml de solução
tampão de acetato de sódio e 2 ml de solução aquosa de iodo 0,1 M. Essa mistura
foi aquecida em banho-maria durante quinze minutos, resfriada e adicionada de 3 ml
de solução aquosa de tiossulfato de sódio 0,1 M e 10 ml de etanol. Mediu-se a
absorbância dessa solução em cubeta de 1 cm a 437 nm, comparou-se com mistura
de 5 ml da solução amostra, retirada antes da adição do tampão e reagentes
subseqüentes, com 10 ml de água e 10 ml de etanol. Para solução de referência,
dissolveu-se 0,05 g de cloridrato de emetina anidro em 100 ml de água destilada.
Retirou-se 1 ml desta solução, adicionou-se 4 ml de água destilada e tratou-se de
maneira idêntica à solução amostra, com tampão e reagentes subseqüentes. Mediuse a absorbância em comparação com água destilada. Calculou-se o teor de
alcalóides não fenólicos, expressos em emetina, utilizando a expressão: A1 x
176,6/Te (100-α)A2 = % de alcalóides não-fenólicos em emetina, em que A1 =
absorvância da solução amostra; A2 = absorvância da solução comparativa; α =
40
perda por secagem da droga em % de massa e Te = tomada de ensaio da droga, se
diferente de 1 g.
3.6.2 Alcalóides Fenólicos
À solução alcalina armazenada no ensaio anterior adicionou-se 15 ml de
ácido clorídrico M e água q.s.p. 100 ml. Com alíquota de 5 ml desta solução
realizaram-se os mesmos ensaios utilizados para preparação da solução amostra
anterior. Para calcular a porcentagem de alcalóides fenólicos, expressos em emetina
empregou-se a mesma expressão anterior, substituindo o valor de A1 anterior pelo
obtido no presente ensaio.
3.7 Perfil cromatográfico do extrato alcaloídico e identificação da emetina por
CLAE
Foi realizado em raízes de duas amostras do material cultivado: G40L
(amostra 2) e G80E (amostra 17), secas em estufa sob temperatura de 40°C por três
dias. O aparelho utilizado foi um cromatógrafo Shimadzu, série LC – 10 A/VP, com
detector Shimadzu UV-VIS SPD 10 A/VP, em coluna de fase reversa C-18.
3.7.1 Preparação do extrato alcaloídico da poaia
Pesou-se cerca de 100 a 300 mg do pó da amostra, adicionaram-se gotas de
hidróxido de amônio 25% e extraiu-se com mistura de diclorometano e éter etílico
(1:1). Concentrou-se o extrato e ressuspendeu-se o resíduo em 1,0 ml de metanol.
Colocou-se em aparelho de ultra-som por trinta minutos, centrifugou-se a 10000
41
rotações por minuto (RPM) por 10 minutos e transferiu-se a fração solúvel para
frasco apropriado para injeção no cromatógrafo.
3.7.2 Preparação da solução padrão de emetina
Pesou-se cerca de 5,0 mg do dicloridrato de emetina (Aléxis USA),
adicionaram-se gotas de hidróxido de amônio 25% e extraiu-se com éter etílico.
Concentrou-se o extrato e ressuspendeu-se o resíduo em 1,0 ml de metanol.
Colocou-se em aparelho de ultra-som por trinta minutos, centrifugou-se a 10000
RPM por 10 minutos e transferiu-se a fração solúvel para frasco apropriado para
injeção no cromatógrafo. Concentração: 5 mg/ml.
3.7.3 Condições cromatográficas
Foram utilizados uma coluna de fase reversa C18 e gradiente com a seguinte
fase móvel: água acidificada com ácido hexanosulfônico e acetonitrila de 70 a 30%
em 30 minutos. O fluxo foi de 1 ml/min., temperatura de 30°C e detecção por UV a
285 nm. A identificação da emetina no extrato alcaloídico foi feita por comparação do
seu tempo de retenção com o do padrão sob condições idênticas.
3.8 Análise dos dados
À medida que a coleta de dados e os doseamentos eram processados,
procedeu-se a entrada no banco de dados do programa Epi-Info, versão 6.04b
(DEAN et al., 1995).
Para a análise das variáveis contínuas foram aplicados os testes
paramétricos, “t” de Student e “F” (ANOVA). Obedeceram-se os pressupostos de
42
homogeneidade nas variâncias e normalidade nas curvas padrões. Caso estes
pressupostos fossem quebrados, o teste não-paramétrico de Kruskall-Wallis poderia
ser utilizado.
Na presença de diferença estatisticamente significativa em mais de dois
grupos, o teste de comparação múltipla de Newman-Keuls foi aplicado. Em todos os
testes, considerou-se o valor de α = 5%, ou seja, p<0,05 para medida de
significância estatística (SIEGEL & CASTELLAN, 1988; VIEIRA, 1991).
43
4. RESULTADOS E DISCUSSÃO
4.1 Estudo morfológico
4.1.1 Descrição macroscópica da planta nativa
Na figura 2 vemos os aspectos da planta nativa coletada na Amazônia.
Sabe-se que possíveis variações morfológicas entre as populações vegetais
podem ocorrer (ASSIS, 1992; ASSIS & GIULIETTI, 1999; GARCIA, 2001). Na
tentativa de se verificar a ocorrência de variações significativas entre a planta nativa
e as cultivadas in vitro, submetidas aos diferentes tratamentos foram realizadas
análises dos principais caracteres morfológicos, a saber:
a) Simetria da folha (comprimento X largura), em centímetros (cm);
b) Simetria (comprimento X largura) cm, peso das raízes em gramas (g);
c) Comprimento do caule (cm);
d) Comprimento das estípulas (cm).
Para a realização das medidas tomou-se como base a maior folha, maior raiz
e o maior caule da planta. Para a planta nativa observou-se:
Folhas: elípticas, oblongas, ápice acuminado, base atenuada;
Pecíolos: glabros;
Estípulas: raramente persistentes;
Caule (parte aérea): cilíndrico, ereto a prostrado;
Caule (falso rizoma): curtos, unidos à raiz, cilíndricos, finamente enrugados no
sentido longitudinal;
Raiz: tortuosa, simples, ramificada, coloração marrom escuro. Externamente,
apresentou numerosos anéis rugosos separados entre si por sulcos arredondados
contornando completamente a raiz. Superfície lisa em corte transversal, com casca
espessa, uniformemente densa e a parte central muito dura.
44
a
b
Figura 2 - Aspectos da P. ipecacuanha coletada na Amazônia
a - parte aérea (folha, estipula, caule
b -raízes e caule tipo falso rizoma
45
A comparação dos dados obtidos com àqueles descritos por Assis (1992),
Farmacopéia Brasileira 4ª edição (1996), Lameira (2002) e Assis e Giulietti (1999)
confirmam a espécie e a descrição morfológica.
As dimensões dos caracteres analisados estão relacionadas abaixo:
Folhas (comp.): 3,1 - 12,0 cm, (larg.): 1,5 - 6,1 cm;
Caule (comp.): 21,5 - 30,0 cm;
Raiz (comp.): 1,0 - 16,0 cm;
Estípulas (comp.): 0,7 - 1,0 cm.
Assis (1992) realizou um extenso estudo comparativo de caracteres
morfológicos apresentados por exemplares de P. ipecacuanha que ocorrem na
Floresta Amazônica (Rondônia – RO e Mato Grosso – MT), América Central – AM,
Colômbia – C e Mata atlântica (Pernambuco – PE, Bahia – BA, Espírito Santo – ES,
Minas Gerais – MG, Rio de Janeiro – RJ e São Paulo – SP), usando nove caracteres
no seu estudo. Esta análise mostrou que todos os indivíduos, ao longo de toda a
distribuição geográfica, não apresentaram diferenças morfológicas significativas para
uma separação infra-específica. Mesmo assim, algumas diferenças são observadas
principalmente relacionadas à presença de acúmem na folha mais desenvolvida em
uma população fora do Brasil e também na pilosidade.
No quadro abaixo estão reunidas algumas informações deste trabalho em
relação aos caracteres observados, e respectivas medidas, que podem ajudar no
entendimento da questão morfológica do presente trabalho.
Folhas
comp. (cm)
Folhas
larg. (cm)
Caule
(cm)
Ramo
Estípula
superior
(cm)
População
RO e MT
2,3 - 16,0
1,7 - 8,0
19 - 61,5
Pubesc.
0,2 - 1,2
População
PE, BA, MG, RJ, SP
4,0 - 13,0
1,7 - 7,4
0,0 59,0
Pubesc.
0,2 - 0,7
População exterior
Am. Central e Colômbia
3,4 - 18,3
1,1 - 9,4
0,0 56,0
Glabro
0,2 - 1,5
Neste quadro, embora existam indivíduos com caule de 0,0 cm de altura
(acaule) a freqüência deste tipo de indivíduo é extremamente baixa.
Alem da extensa variação nas dimensões dos caracteres apontados, a autora
observou também uma grande variedade com relação às formas das folhas e
estípulas, que estão resumidas no quadro seguinte, para cada região estudada
respectivamente.
46
AC e C
RO e MT
PE, BA, ES,
MG, RJ, SP
Fonte: Assis (1992)
47
Mesmo com a grande variação nas dimensões e formas, para a autora o não
reconhecimento de taxa infra-específicos para a P. ipecacuanha foi devido à
ausência de variações morfológicas significativas, para um determinado conjunto de
populações. Considera que as populações estudadas (brasileiras e estrangeiras)
dificilmente estão trocando genes entre si. Portanto, estas populações estão
sofrendo um processo de especiação em taxas diferentes, que poderá levar
futuramente à formação de novas espécies.
Kay (1984) considera que a maioria das descontinuidades morfológicas das
plantas simpátricas é conseqüência de polimorfismo genético, enquanto que
descontinuidades morfológicas em plantas alopátricas comumente resultam de
barreiras ao fluxo gênico. Para o autor uma espécie geneticamente variável só pode
ter categorias infra-específicas reconhecidas, se seus padrões de variação
mostrarem descontinuidade clara em caracteres morfologicamente observáveis e
especialmente que tais subdivisões incluam também diferenças geográficas e/ou
ecológicas. E deve ser levado também em consideração às variações crípticas
incluindo aspectos citogenéticos, fisiológicos ou bioquímicos.
A descrição morfológica da planta nativa do presente estudo não apresentou
diferenças acentuadas em relação aos exemplares descritos por Assis (1992).
4.1.2 Descrição macroscópica da planta cultivada in vitro, submetidas aos
diferentes tratamentos
Na figura 3 são apresentados os aspectos da planta cultivada submetida aos
diferentes tratamentos.
48
Figura 3 - Aspecto da P. ipecacuanha, após serem submetidas aos diferentes tratamentos
Para as plantas cultivadas submetidas aos diferentes tratamentos observouse:
Folhas: elípticas, oblongas, ápice acuminado, base atenuada;
Pecíolos glabros;
Estípulas: raramente persistente;
Caule (parte aérea): cilíndrico, ereto a prostrado;
Caule (falso rizoma): curtos, unidos à raiz, cilíndricos, finamente enrugados no
sentido longitudinal;
Raiz: tortuosa, simples, ramificada, coloração marrom escuro. Externamente,
apresentou numerosos anéis rugosos separados entre si por sulcos arredondados
contornando completamente a raiz. Superfície lisa em corte transversal, com casca
espessa, uniformemente densa e a parte central muito dura.
49
No aspecto geral verificou-se que as plantas cultivadas, originadas por
processo biotecnológico e submetidas aos diferentes tratamentos, apresentaram
morfologia semelhante à planta nativa, observada através da descrição morfológica.
No entanto, constatou-se um maior número de raízes secundárias.
Lameira (2002) verificou que em plantas de 3 anos de idade, obtidas pelo
processo natural, podem produzir uma raiz primária contendo oito raízes
secundárias por planta, pesando de 30 a 40 g. Pela micropropagação, o número de
raízes obtidas pode chegar até 15 raízes secundárias por planta. Este aumento do
número de raízes já foi também observado em Curcuma longa L. obtida por
processo biotecnológico (PERÉT-ALMEIDA, 2006).
As dimensões dos caracteres analisados estão relacionadas abaixo:
Folhas (comp.): 0,7 – 9,0 cm, (larg.): 0,4 - 4,5;
Caule (comp.): 2,5 - 13,5 cm;
Raiz (comp.): 6,0 a 20,0 cm;
Estípulas (comp.): 0,3 - 1,4 cm.
Considerando os limites inferiores e superiores de Assis (1992) para o
comprimento das folhas (2,3 - 18,3 cm) observadas nas três regiões estudadas, o
valor encontrado neste experimento foi inferior (0,7 cm). O mesmo foi observado
com relação à largura, cujo limite é de 1,1 - 9,4 cm, segundo Assis (1992) e o
experimental é de 0,4 cm.
Todas as medidas e os pesos mensurados para as amostras nativas e
aquelas submetidas a diferentes tratamentos estão reunidos na Tabela 4.
50
Tabela 4 - Comprimentos de folhas, caules, raízes e estípulas e peso das raízes das diversas
amostras de P ipecacuanha
Folhas
Raiz Estípulas Raiz
compr. Caule
Ambientes Tratamentos Amostras
compr. compr. compr. peso
x
(cm)
(cm)
(cm)
(g)
largura
(cm)
a
12,0 x 6,0 30,0
10,0
0,7
1,51
b
4,7 x 2,2 29,0
16,0
0,6
1,35
c
11,9 x 6,1 21,5
6,0
0,5
1,40
Habitat
d
10,0 x 5,5 22,2
5,0
0,6
1,30
e
8,4 x 2,5 28,0
3,0
1,0
1,36
f
3,1 x 1,5 26,0
1,0
0,7
1,38
01
8,5 x 4,0 10,4
10,0
1,1
3,70
L
02
8,0 x 4,4
7,5
17,0
1,3
6,10
03
6,0 x 4,0
7,2
18,0
1,0
2,10
04
2,0 x 1,2
7,8
8,0
0,7
0,50
E
05
6,5 x 2,9
8,5
15,0
1,1
6,10
G40
06
7,5 x 3,0 11,5
18,0
1,4
4,80
07
4,7 x 2,4
5,2
8,0
0,5
1,10
08
6,5 x 2,9
9,5
12,0
0,8
2,90
N
09
7,0 x 3,4
5,0
17,0
1,1
4,40
10
5,0 x 2,9
6,0
12,0
1,1
1,80
11
1,0 x 0,5
6,0
6,0
0,3
1,10
12
6,5 x 4,5
8,5
15,0
0,7
3,10
L
13
9,0 x 4,5
9,0
11,0
1,1
1,20
14
4,0 x 1,8
3,9
10,0
0,7
2,50
8,5
12,0
0,9
1,50
15
2,7 x 1,7
E
16
4,4 x 1,9
2,5
8,0
0,6
0,90
G80
17
8,6 x 4,2 13,5
20,0
1,2
6,40
18
2,0 x 1,0
9,0
16,0
0,9
5,90
19
7,0 x 3,7 10,0
20,0
1,1
5,30
N
20
0,7 x 0,4
5,5
10,0
0,4
2,40
21
2,5 x 1,2
8,2
17,0
0,8
1,80
51
4.1.3 Tratamentos estatísticos
As médias e medidas dos desvios padrões estão indicadas na Tabela 5.
Tabela 5 - Análise descritiva da média e desvio-padrão das folhas (comprimento e largura),
caule (comprimento), raiz (comprimento), estípulas (comprimento) e raízes (peso) de amostras
de P ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis
de interceptação da radiação solar
Ambientes
Habitat
G40
G80
Tratamentos
Número Folhas Folhas Caule
Raiz Estípulas
compr. largura compr. compr. compr.
de
amostras (cm)
(cm)
(cm)
(cm)
(cm)
Raiz
peso
(g)
-
06
8,350 3,967 26,117 6,833
±3,729 ±2,116 ±3,567 ±5,419
1,383
±0,071
0,683
±0,172
L
03
7,500 4,133 8,367 15,000
±1,323 ±0,231 ±1,767 ±4,359
3,967
±2,013
1,133
±0,153
E
03
5,333 2,367 9,117 13,667
±2,930 ±1,012 ±1,711 ±5,132
3,800
±2,931
1,067
±0,351
N
05
4,840 2,420 6,340 11,000
±2,357 ±1,130 ±1,824 ±4,242
2,260
±1,405
0,760
±0,358
L
03
6,500 3,600 7,133 12,000
±2,500 ±1,559 ±2,811 ±2,646
2,267
±0,971
0,833
±0,231
E
03
5,233 2,600 8,167 13,333
±3,037 ±1,389 ±5,501 ±6,110
2,933
±3,017
0,900
±0,300
N
04
3,050 1,575 8,175 15,750
±2,740 ±1,457 ±1,929 ±4,193
3,850
±2,050
0,800
±0,294
52
Na Tabela 6 estão indicados os resultados da análise estatística para os
comprimentos das folhas (cm) de P ipecacuanha nativas e cultivadas sob a
influência de ambientes (G40 e G80) e três níveis de interceptação da radiação
solar.
Não há diferença estatisticamente significativa entre o comprimento das
folhas, seja em relação à nativa, seja entre aquelas submetidas aos tratamentos.
Tabela 6 - Análise comparativa das médias dos comprimentos das folhas de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e de três níveis de
interceptação da radiação solar
Ambientes
Tratamentos
Número
de
amostras
Habitat
-
06
8,350
±3,729
L
03
7,500
±1,323
E
03
5,333
±2,930
N
05
4,840
±2,357
L
03
6,500
±2,500
E
03
5,233
±3,037
N
04
3,050
±2,740
G40
G80
Folhas compr.
(cm)
Teste “t”/F
p
1,710
0,1702
53
Na Tabela 7 estão indicados os resultados da análise estatística para as
larguras das folhas (cm) de nativas e cultivadas sob a influência de ambientes (G40
e G80) e três níveis de interceptação da radiação solar.
Não há diferença estatisticamente significativa entre a largura das folhas, seja
em relação à nativa, ou seja, entre os tratamentos e entre si.
Tabela 7 - Análise comparativa das médias das larguras das folhas de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis de
interceptação da radiação solar.
Ambientes
Tratamentos
Número
de
amostras
Habitat
-
06
3,967
±2,116
L
03
4,133
±0,231
E
03
2,367
±1,012
N
05
2,420
±1,130
L
03
3,600
±1,559
E
03
2,600
±1,389
N
04
1,575
±1,457
G40
G80
Folhas larg.
(cm)
Teste “t”/F
p
1,64
0,1881
54
Na Tabela 8 estão indicados os resultados da análise estatística para os
comprimentos dos caules (cm) de amostras nativas e cultivadas sob a influência de
ambientes (G40 e G80) e três níveis de interceptação da radiação solar.
A espécie nativa apresentou maior comprimento para caule em relação aos
grupos tratados. E as tratadas entre si não apresentaram diferença.
Tabela 8 - Análise comparativa das médias dos comprimentos dos caules de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis de
interceptação da radiação solar
Ambientes
Tratamentos
Número de
amostras
Habitat
- (1)
06
26,117
±3,567
L (2)
03
8,367
±1,767
E (3)
03
9,117
±1,711
N (4)
05
6,340
±1,824
L (5)
03
7,133
±2,811
E (6)
03
8,167
±5,501
N (7)
04
8,175
±1,929
G40
G80
Caule
comp.
(cm)
Teste “t”/F
p
30,28
<0,001
Teste de Comparação Múltipla de Newman-Keuls: 1 > 4, 5, 6, 7, 2 e 3.
55
Na Tabela 9 estão indicados os resultados da análise estatística para os
comprimentos das raízes (cm) de amostras nativas e cultivadas sob a influência de
ambientes (G40 e G80) e três níveis de interceptação da radiação solar.
Não foram observadas diferenças estatisticamente significativa entre os
comprimentos das raízes, seja em relação à nativa, seja entre os tratamentos ou
entre si.
Tabela 9 - Análise comparativa das médias dos comprimentos das raízes de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis de
interceptação da radiação solar
Ambientes
Tratamentos
Número de
amostras
Habitat
-
06
6,833
±5,419
L
03
15,000
±4,359
E
03
13,667
±5,132
N
05
11,000
±4,242
L
03
12,000
±2,646
E
03
13,333
±6,110
N
04
15,750
±4,193
G40
G80
Raízes
comp.
(cm)
Teste “t”/F
p
1,94
0,1243
56
Na Tabela 10 estão indicados os resultados da análise estatística para os
comprimentos das estípulas (cm) de amostras nativas e cultivadas sob a influência
de ambientes (G40 e G80) e três níveis de interceptação da radiação solar.
Não
ocorreram
diferenças
estatisticamente
significativa
entre
os
comprimentos das estípulas, seja em relação à nativa, seja entre os tratamentos ou
entre si.
Tabela 10 - Análise comparativa das médias dos comprimentos das estípulas de amostras
de P ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis
de interceptação da radiação solar
Ambientes
Tratamentos
Número de
amostras
Habitat
-
06
1,383
±0,071
L
03
3,967
±2,013
E
03
3,800
±2,931
N
05
2,260
±1,405
L
03
2,267
±0,971
E
03
2,933
±3,017
N
04
3,850
±2,050
G40
G80
Estípula
comp.
(cm)
Teste “t”/F
p
1,30
0,3001
57
Na Tabela 11 estão indicados os resultados da análise estatística para os
pesos das raízes (g) de amostras nativas e cultivadas sob a influência de ambientes
(G40 e G80) e três níveis de interceptação da radiação solar.
Em relação ao peso seco das raízes e rizomas, não houve diferença
estatisticamente significativa entre os grupos.
Não foram verificados na literatura estudos semelhantes ao presente trabalho
e, impossibilitando, portanto, uma discussão mais ampla sobre o peso seco das
raízes e rizomas e os diferentes métodos de tratamento.
Tabela 11 - Análise comparativa das médias dos pesos das raízes de amostras de P
ipecacuanha nativas e cultivadas sob a influência de ambientes (G40 e G80) e três níveis de
interceptação da radiação solar
Ambientes
Tratamentos
Número de
amostras
Habitat
-
06
L
03
E
03
N
05
L
03
E
03
N
04
G40
G80
Raiz
Peso (g)
0,683
±0,172
1,133
±0,153
1,067
±0,351
0,760
±0,358
0,833
±0,231
0,900
±0,300
0,800
±0,294
Teste “t”/F
P
1,35
0,2818
Através da análise estatística realizada, a única diferença observada foi entre
os comprimentos de caule, mas apenas entre a planta nativa e as submetidas aos
tratamentos, mas não nas tratadas entre si.
Esta diferença morfológica em apenas um parâmetro pode ser explicada a
princípio pelo vigor da planta, que segundo Assis (1992) pode influenciar na variação
do comprimento da parte aérea, dos entrenós, diâmetro das raízes, comprimento e
largura das folhas.
58
Pelo estudo de Assis (1992) observa-se uma extensa variedade com relação
às formas das folhas, e uma grande variação nas dimensões dos caracteres
apontados, o que leva a admitir mudanças nestes caracteres, sem maiores
conseqüências fisiológicas ou bioquímicas.
No entanto, os processos fisiológicos das plantas estão sujeitos à
interferência dos fatores ambientais. Nas plantas medicinais, o ambiente, além de
interferir no desenvolvimento vegetativo e reprodutivo, ainda é um fator determinante
da composição química do vegetal, podendo limitar a presença ou concentração da
mesma (MELO et al., 2003).
Dentre os fatores ambientais a radiação solar e diferentes espectros de
radiação exercem uma grande influência nas plantas devido a sua interferência nos
processos fisiológicos e bioquímicos.
No entanto, se faz necessário avaliar a extensão destas interferências,
através do aprofundamento do estudo pela avaliação anatômica e da composição e
variação química neste processo.
4.2 Estudo anatômico
Visando contribuir para um maior conhecimento da P. ipecacuanha foram
feitos estudos anatômicos da raiz e caule (falso rizoma) com o intuito de verificar as
semelhanças e/ou diferenças anatômicas observadas em amostras nativas e
cultivadas por processo biotecnológico, submetidas a diferentes tratamentos, e suas
relações aos parâmetros farmacopêicos e literatura.
4.2.1 Descrição microscópica da planta nativa
A raiz, em secção transversal, possui o súber com três a quatro camadas de
células tabulares, achatadas, de paredes finas (Figuras 4, 5 e 10). O parênquima
59
cortical possui várias camadas de células, com numerosos grãos de amido e
algumas com ráfides de oxalato de cálcio (Figuras 5, 6 e 7).
Os grãos de amido são simples ou, mais freqüentemente de três (trigêmeos)
ou mais unidades, apresentando um diâmetro de 5 micrômetros quando isolados e
de 10 a 15 micrômetros quando associados (Figura 8). O cilindro vascular é
constituído de floema reduzido, desprovido de fibras, e xilema denso, na região
central da raiz, composto por fileiras radiais de vasos (Figura 6). Em secção
longitudinal da raiz observam-se traqueídes com numerosas pontoações nas
paredes laterais (Figura 9).
As características observadas para a raiz, rizomas e grãos de amido da planta
nativa confirmam as várias literaturas consultadas (METCALF & CHALK, 1950;
OLIVEIRA et al., 1998; ASSIS & GIULIETTI, 1999; FARMACOPÉIA BRASILEIRA,
1996).
O caule jovem (falso rizoma) em secção transversal apresenta um súber
estratificado com fileiras de células tabulares, colênquima com várias camadas de
células e parênquima cortical com espaços intercelulares (Figura 10). O cilindro
vascular constituído pelo xilema e floema é circundado por uma endoderme com
estrias de Caspary (Figura 11).
O caule (falso rizoma) com crescimento secundário apresenta um súber
desenvolvido, colênquima reduzido e periciclo com grupos de esclereídes (Figura
13). O cilindro vascular apresenta-se com um floema estreito e um xilema
desenvolvido. Na região central, observa-se a medula com células parenquimáticas
com numerosas pontoações (Figura 12).
Segundo Alencar & Santos (1980), as observações anatômicas de C.
ipecacuanha revelam características de espécies típicas de locais sombreados.
60
4
6
5
7
Figuras 4 a 7 - Raiz de Psychotria ipecacuanha. 4. secção transversal mostrando súber (s),
parênquima cortical (pc), floema (f) e xilema (x), (barra = 200µ
µm). 5. detalhe do súber (s) e
parênquima cortical (pc), (barra = 20µ
µm). 6. secção transversal mostrando células com grãos
de amido (cga), floema (f) e xilema (x), (barra = 20µ
µm). 7. detalhe das células com grãos de
amido (ga) e ráfides (rf), (barra = 10µ
µm).
61
8
9
10
11
Figuras 8 a 11 - Psychotria ipecacuanha. 8. grãos de amido simples (ga), trigêmeos (gat) e
quadrigêmeos (gaq), (barra = 10µ
µm). 9. secção longitudinal da raiz mostrando traqueídes com
numerosas pontoações (tp) nas paredes laterais (barra = 20µ
µm). 10. secção transversal da raiz
mostrando súber (s), colênquima (co) e parênquima cortical (pc), (barra = 20µ
µm). 11. detalhe
das estrias de Caspary (es), (barra = 15µ
µm).
62
12
13
Figuras 12 e 13 - Secção transversal do caule (falso rizoma) de Psychotria ipecacuanha. 12.
região medular mostrando células parenquimáticas com numerosas pontoações (p), (barra =
15µ
µm). 13. detalhe do súber (s) e esclereides (es) (barra = 20µ
µm).
63
4.2.2 Histolocalização dos alcalóides nas raízes da amostra nativa
A presença de alcalóides foi detectada através do teste com o reativo de
Dragendorff, na região que circunda o cilindro vascular, pela coloração marronavermelhada (Figuras 15 e 17). O teste foi confirmado através do controle que foi
submetido à extração de alcalóides com ácido tartárico e resultou em reação
negativa ao teste com o reativo de Dragendorff (Figuras 14 e 16).
A coloração preta no parênquima cortical da raiz corresponde à reação do
amido com o iodeto de potássio presente no reativo de Dragendorff (Figuras 14, 15,
16 e 17).
A histolocalização de alcalóides foi realizada também por Garcia (2001), na
raiz primária da P. ipecacuanha, indicando sua presença principalmente na região
do xilema. Este autor também constatou a presença de alcalóides em todas as
células da região cortical, na região periférica das células. Neste presente estudo
este fato não foi constatado, muito embora a reação concomitante do reativo de
Dragendorff com o amido, devido à presença de iodo, resultou em uma coloração
fortemente escura, que poderia estar mascarando os resultados observados.
64
15
14
16
17
Figuras 14 a 17 - Testes histoquímicos na raiz em secção transversal de Psychotria
ipecacuanha. 14. controle, (barra = 20µ
µm). 15. reativo de Dragendorff mostrando região com
alcalóides (a), (barra = 20µ
µm). 16. controle, (barra = 10µ
µm). 17. reativo de Dragendorff
mostrando detalhe da região com alcalóides (a), (barra = 10µ
µm).
65
4.2.3 Descrição microscópica da planta cultivada in vitro, submetida aos
diferentes tratamentos (G40L, G40E, G40N; G80L, G80E, G80N)
Um dos pilares da anatomia aplicada ao cultivo in vitro é a comparação com
um padrão in vivo. A anatomia pode auxiliar na compreensão dos vários fenômenos
relacionados ao corpo vegetal, dentre os quais as respostas ao cultivo in vitro. Nas
técnicas de cultivo in vitro, o estabelecimento de células, tecidos ou órgãos vegetais
sobre condições controladas tem como conseqüência a interrupção do controle
hormonal a que estas células estão submetidas. As células vegetais, sendo expostas
a uma nova condição ambiental, podem expressar um potencial morfogênico que
não se expressaria in vivo. As condições de cultivo podem tanto permitir a
continuidade
de
um
padrão
de
desenvolvimento,
quanto
promover
a
desdiferenciação e a neomorfogênese vegetal, e estas serem detalhadas pelo
emprego de técnicas de análise anatômica (RODRIGUES et al., 2004).
As características anatômicas observadas estão relacionadas a seguir.
A raiz em secção transversal apresenta um súber com três a quatro camadas
de células tabulares, achatadas e de paredes finas (Figuras 18 e 19). O parênquima
cortical possui várias camadas de células, com numerosos grãos de amido e
algumas com ráfides de oxalato de cálcio (Figuras 20 e 21).
O caule apresenta um súber estratificado com várias fileiras de células
tabulares e alguns tricomas (Figuras 22 e 23). O colênquima é mostrado com várias
camadas de células e o parênquima cortical com espaços intercelulares (Figura 23).
Os feixes vasculares, constituídos pelo xilema e floema são circundados por uma
endoderme com estrias de Caspary (Figura 24).
O caule apresenta periciclo com grupos de esclereídes (Figura 25). Os feixes
vasculares apresentam-se com uma camada de floema estreita e um xilema
desenvolvido. Na região central, temos a medula com células parenquimáticas com
numerosas pontoações (Figuras 26 e 27).
Todas as características anatômicas observadas para a planta nativa também
puderam ser observadas nas plantas cultivadas tratadas. Nenhuma diferença
marcante nas características microscópicas das plantas submetidas aos diferentes
tratamentos pôde ser constatada, em relação à planta nativa.
66
A histolocalização de alcalóides não foi realizada nestas amostras, já que a
presença destes compostos foi confirmada através de processos químicos.
67
18
19
20
21
Figuras 18 a 21 - Raiz de P. ipecacuanha. 18. secção transversal mostrando súber (s) e
parênquima cortical (pc), (barra = µm). 19. detalhe do súber (s) e parênquima cortical (pc),
(barra = µm). 20. secção transversal mostrando o cilindro vascular, região do floema (f) e
xilema (x), (barra = µm). 21. detalhe das células com grãos de amido (ga) e ráfides (rf), (barra =
10µ
µm).
68
22
23
24
Figuras 22 - 24 - Caule de P. ipecacuanha. 22. secção transversal mostrando súber (s),
parênquima cortical (pc), tricomas (tr) e parte do cilindro vascular com floema (f) e xilema (x),
(barra = µm). 23. secção transversal mostrando súber (s) e parênquima cortical (pc) (barra =
µm). 24. detalhe das estrias de Caspary (es), (barra = µm).
69
25
26
27
Figuras 25 a 27 - Secção transversal do caule de P. ipecacuanha. 25. grupos de esclereídes
(es), região do floema (f) e do xilema (x) (barra = µm) 26. região medular do caule mostrando
células parenquimáticas com numerosas pontoações (p), (barra = µm). 27. detalhe das
pontoações (p) (barra = µm).
70
4.3 Ensaios de pureza
Os ensaios de pureza foram realizados na amostra nativa com o objetivo de
verificar se a amostra apresentava os parâmetros farmacopêicos exigidos e estão
descritos na Tabela 12.
Nenhum trabalho foi realizado para esta espécie, com o intuito de estabelecer
estes parâmetros, sendo, portanto estes dados novos para a literatura. Estes
ensaios auxiliam na identificação de uma droga vegetal.
Tabela 12 - Ensaios de pureza para a amostra nativa e os respectivos limites farmacopéicos
Ensaios de pureza
Perda por dessecação
Cinzas totais
Cinzas insolúveis
Valores encontrados (%)
9,18
2,65
0,5
Limites farmacopêicos (%)
-6
3
4.4 Presença de alcalóides por CCD (Farmacopéia Brasileira 4ª edição)
Sob luz ultravioleta (365 nm) foram observadas manchas azuis fluorescentes,
correspondentes a emetina e a cefalina (Figura 28). Após nebulizar a cromatoplaca
com solução clorofórmica de iodo a 0,5% (p/V) foram observadas manchas de
coloração
amarelo
e
pardo
correspondentes
à
emetina
e
à
cefalina,
respectivamente, sob luz visível (Figura 29). Estas mesmas manchas apresentaramse, sob luz ultravioleta (365 nm) com coloração amarela intensa e azul fluorescente,
respectivamente.
71
Pa NT a
b
c
d
e
f
g
h
i
j
k
l
m n
o
p
q
r
s
t
u
Figura 28 - Análise em CCD de alcalóides de raízes da P. ipecacuanha, nativa da Amazônia.
Revelação: luz ultravioleta (365nm). (Pa: padrão emetina; NT: nativa; a - u: amostras 1 a 21).
Pa NT a
b
c
d
e
f
g
h
i
j
k
l
m n
o
p
q
r
s
t
u
Figura 29 - Análise em CCD de alcalóides de raízes da P. ipecacuanha, nativa da Amazônia.
Revelação: solução clorofórmica de iodo. (Pa: padrão emetina; NT: nativa; a - u: amostras 1 a
21).
72
4.5 Doseamento de alcalóides (Farmacopéia Brasileira 4ª edição)
A dosagem dos alcalóides não fenólicos, incluindo particularmente a emetina,
realiza-se graças à possibilidade de eliminar os fenólicos sob a forma de
combinações solúveis em água, com bases fortes (hidróxidos de potássio, sódio,
cálcio e bário), mas não com a amônia.
Pode considerar-se a diferença entre os alcalóides totais e os não fenólicos
como sendo o conteúdo de cefalina, dada a sua riqueza relativa no grupo doa
alcalóides fenólicos (COSTA, 1986).
4.5.1 Tratamentos estatísticos para os doseamentos de alcalóides nãofenólicos, fenólicos e totais.
Os resultados do cálculo da média e o desvio-padrão para o doseamento de
alcalóides fenólicos e não fenólicos nas raízes nativas e cultivadas sob a influência
de ambientes (G40 e G80) e três níveis de interceptação da radiação solar estão na
Tabela 13.
Tabela 13 - Valores da média e desvio-padrão dos teores de alcalóides fenólicos, não
fenólicos e totais (%) nas raízes de P. ipecacuanha
Ambientes
Tratamentos
Habitat
_
Teor de alcalóides (%)
Fenólicos
Não fenólicos
Totais
0,0643 ± 0,0188 1,3743 ± 0,2866 1,7086 ± 0,1141
L
0,3995 ± 0,4226
2,6520 ±0,3529
3,0500 ± 0,0700
E
0,4238 ± 0,1218
2,2156 ± 0,1446
2,6400 ± 0,0608
N
0,3184 ± 0,1683
2,0123 ± 0,2110
2,3320 ± 0,1215
L
0,5378 ± 0,1060
2,9223 ± 0,2341
3,4600 ± 0,1652
E
0,4316 ±0,2654
2,6847 ± 0,2163
3,1167 ± 0,0493
N
0,2998 ± 0,1657
1,6666 ± 0,2180
1,9675 ± 0,1323
G40
G80
73
Na Tabela 14 estão indicados os resultados da análise estatística para o
doseamento de alcalóides não fenólicos nas amostras nativas e cultivadas sob a
influência de ambientes (G40 e G80) e interceptação da radiação solar.
As médias e desvios-padrões dos teores de alcalóides estão no apêndice 2.
Os
teores
de
alcalóides
não
fenólicos
apresentaram
diferença
estatisticamente significativa (p<0,001) entre a amostra nativa em relação aos
tratamentos de interceptação da radiação solar.
Tabela 14 - Análise comparativa das variáveis “aluminete®” 80% e “aluminete®” 40% sob a
influência de três níveis de interceptação da radiação solar na concentração de alcalóides nãofenólicos (%) das amostras de P. ipecacuanha
Ambientes
Tratamentos
Número
de
amostras
Habitat
- (1)
03
1,3743 ± 0,2866
L1 (2)
03
2,6520 ±0,3529
E1 (3)
03
2,2156 ± 0,1446
N1 (4)
05
2,0123 ± 0,2110
L2 (5)
03
2,9223 ± 0,2341
E2 (6)
03
2,6847 ± 0,2163
N2 (7)
04
1,6666 ± 0,2180
G40
G80
Teor de alcalóides (%)
Não-Fenólicos
“t”/F
p
16,52
<0,001
Teste de Comparação Múltipla de Newman-Keuls: 5, 6 e 2 > 3 > 4 > 7 e 1.
Os teores de alcalóides não fenólicos foram iguais e maiores nas seguintes
amostras: G80L2 (2,9223%), G80E2 (2,6847%) e G40L1 (2,6520%). E em G40E1
(2,2156%) foi maior que G40N1 (2,0123%), que por sua vez, foi maior que G80N2
(1,6666%) e que a nativa (1,3743%).
74
Esquematicamente, poderíamos resumir a situação:
G80 L2 = G80 E2 = G40 L1
> G40 E1 >
G40 N1
>
G80 N2 = nativa
A presença de alcalóides não-fenólicos representa bem a presença de
emetina.
Hatfield e cols. (1981), em amostras do Panamá, avaliaram o conteúdo de
emetina, que variou de 0,42% a 1,60%. Sahu & Mahato, (1982) analisaram por
CLAE raízes de poaia cultivadas na Índia e encontraram 1,28% de emetina. Martins
(2000) quantificou por CLAE os alcalóides da poaia (região sudeste em floresta
estacional decidual), encontrando concentrações médias de 1,41% para a emetina.
Os teores em alcalóides não fenólicos na amostra nativa foram próximos aos
valores observados na literatura. No entanto, nas plantas originadas de processos in
vitro foram maiores.
Com relação ao G40:
- o estresse de luminosidade é favorável à produção de alcalóides não
fenólicos;
- a interceptação de 100% de radiação solar embora menos eficaz, é
também favorável;
É interessante observar que a condição G40L1 favorece igualmente aos
outros tratamentos.
Com relação ao G80:
- tanto o estresse de luminosidade (0% de interceptação), quanto a
interceptação de 100% são igualmente favoráveis;
G40N1 e G80N2 e nativa:
- condição onde se observou os menores teores;
A interceptação da radiação solar (0% e 100%) é favorável à presença de
alcalóides não-fenólicos.
75
Na Tabela 15 estão indicados os resultados da análise estatística para o
doseamento de alcalóides fenólicos em amostras de P. ipecacuanha nativas e
cultivadas sob a influência de ambientes (G40 e G80) e três níveis de interceptação
da radiação solar.
Os
teores
de
alcalóides
fenólicos
não
apresentaram
diferença
estatisticamente significativa entre a amostra nativa em relação aos tratamentos de
interceptação da radiação solar.
Tabela 15 - Análise comparativa das variáveis “aluminete®” 80% e “aluminete®” 40% sob a
influência de três níveis de interceptação da radiação solar na concentração de alcalóides
fenólicos (%) das amostras de P. ipecacuanha
Ambientes
Tratamentos
Número
de
amostras
Habitat
-
03
0,0643 ± 0,0188
L1
03
0,3995 ± 0,4226
E1
03
0,4238 ± 0,1218
N1
05
0,3184 ± 0,1683
L2
03
0,5378 ± 0,1060
E2
03
0,4316 ±0,2654
N2
04
0,2998 ± 0,1657
G40
G80
Os
teores
de
alcalóides
Teor de alcalóides (%)
Fenólicos
fenólicos
não
“t”/F
p
1,16
0,3736
apresentaram
diferença
estatisticamente significativa para todas as amostras: nativa (0,0643%), G40L1
(0,3995%), G40E1 (0,4238%), G40N1 (0,3184%), G80L2 (0,5378%), G80E2
(0,4316%) e G80N2 (0,2998%).
A presença de alcalóides fenólicos representa bem a presença de cefalina.
Hatfield e cols. (1981) avaliaram em amostras do Panamá, o conteúdo de
cefalina, que variou de 0,76% a 1,82%. Sahu & Mahato, (1982) analisaram por
CLAE raízes de poaia cultivadas na Índia e encontraram 0,53% de cefalina. Martins
(2000) quantificou por CLAE os alcalóides da poaia (região sudeste em floresta
estacional decidual), encontrando concentrações médias de 0,32% (cefalina).
76
Na Tabela 16 estão indicados os resultados da análise estatística para o
doseamento de alcalóides totais nas amostras nativas e cultivadas sob a influência
de ambientes (G40 e G80) e três níveis de interceptação da radiação solar.
Os teores de alcalóides totais apresentaram diferença estatisticamente
significativa entre a amostra nativa em relação aos tratamentos de interceptação da
radiação solar.
Tabela 16 - Análise comparativa das variáveis “aluminete®” 80% e “aluminete®” 40% sob a
influência de três níveis de interceptação da radiação solar na concentração de alcalóides
totais (%) das amostras de P. ipecacuanha
Ambientes
Tratamentos
G80
Totais
- (1)
03
1,7086 ± 0,1141
L1 (2)
03
3,0500 ± 0,0700
E1 (3)
03
2,6400 ± 0,0608
N1 (4)
05
2,3320 ± 0,1215
L2 (5)
03
3,4600 ± 0,1652
E2 (6)
03
3,1167 ± 0,0493
N2 (7)
04
1,9675 ± 0,1323
Habitat
G40
Teor de alcalóides (%)
Número de
amostras
“t”/F
p
95,16
<0,001
Teste de Comparação Múltipla de Newman-Keuls: 5 > 6 e 2 > 3 > 4 > 7 > 1
Os teores de alcalóides totais foram iguais e maiores nas seguintes amostras:
G80L2 (3,4600%) e G80E2 (3,1167%). E em G40L1 (3,0500 %) foi maior que
G40E1 (2,6400%), que foi maior que G40N1 (2,3320 %), que por sua vez, foi maior
que G80N2 (1,9675%) e este maior que a nativa (1,7086 %).
Esquematicamente, poderíamos resumir a situação:
G80 L2
> G80 E2
= G40 L1
>
G40 E1
>
G40 N1
>
G80 N2
> nativa
77
Em relação ao G40:
− estresse de luminosidade (0% de interceptação da radiação solar) mais
favorável que 100% de interceptação
Em relação ao G80:
− estresse luminoso (0%) é mais favorável que estresse de interceptação total
(100%).
G40N1 e G40N2 e nativa:
− condição onde se observou os menores teores.
A interceptação da radiação solar (0% e 100%) é favorável a presença de
alcalóides totais.
Observa-se claramente que as plantas obtidas por processo biotecnológico
apresentarem maiores teores de alcalóides, que a planta nativa.
É importante salientar que as plântulas iniciais originárias partiram da planta
nativa da Amazônia.
A planta nativa apresentou teor menor que o especificado pela Farmacopéia
em alcalóides totais (1,71%). As plantas cultivadas e tratadas atenderam a estas
condições.
A radiação, dentre outros fatores do ambiente, desempenha um papel
relevante no controle dos processos associados ao acúmulo de biomassa e é um
dos fatores responsáveis pela produção vegetal. Os níveis de luz podem influenciar
a translocação de assimilados dos órgãos fotossintéticos de diferentes maneiras. As
espécies respondem diferentemente aos níveis de luminosidade. Maior ou menor
plasticidade adaptativa das espécies às diferentes condições de radiação solar
depende do ajuste de seu aparelho fotossintético, de modo a garantir maior
eficiência na conversão de energia radiante em carboidratos e, conseqüentemente,
maior crescimento (MELO et al., 2003).
Segundo Engel & Poggiani (1991) a eficiência fotossintética está ligada ao
teor de clorofila das plantas, afetando o crescimento e influenciando a
adaptabilidade das mesmas aos diversos ambientes. Sob o efeito da luminosidade,
a clorofila é constantemente sintetizada e destruída pelo processo de foto-oxidação,
sendo sua velocidade de decomposição diretamente proporcional à elevada
intensidade luminosa prejudicando o processo de assimilação de carbono e em
conseqüência os processos fisiológicos relacionados (MELO et al., 2003).
78
Nas plantas medicinais, o ambiente, além de interferir no desenvolvimento
vegetativo e reprodutivo, ainda é um fator determinante da composição química do
vegetal, podendo limitar a presença ou concentração da mesma (MELO et al., 2003).
Dentre os fatores ambientais a radiação exerce uma grande influência nas
plantas devido a sua importância nos processos fisiológicos e biossíntese. As
plantas superiores respondem de maneira específica aos estímulos luminosos em
relação a alguns eventos bioquímicos, fisiológicos e anatômicos, embora possa estar
relacionada também aos fatores genéticos e ecológicos (BROW JÚNIOR, 1988).
Melo e cols. (2003) tentaram verificar o que ocorre no interior de um ambiente
criado, com relação a mudanças em diferentes aspectos climáticos, de ambiente
protegido, quanto a radiação total incidente em diferentes níveis de interceptação de
luz, associado ao potencial fotossintético. Esses autores utilizaram espécies de
Mikania, conhecida como Guaco. Os ambientes foram controlados por meio de tela
refletora “aluminete®” (40% e 80%) e 0% de interceptação da radiação solar. Estas
plantas são consideradas como de “sombra”. No experimento os autores
observaram que a fotossíntese não sofreu considerável influência entre os
tratamentos sombreados e a pleno sol. No entanto, o vigor vegetativo das plantas
cultivadas sob sombra era superior àquelas cultivadas em pleno sol. Essas
observações já foram relatadas por outros autores (PONS & PEARCY, 1994). No
trabalho de Melo e cols. (2003) foi medida a radiação global recebida nos diferentes
ambientes, sendo verificado que as plantas a pleno sol receberam maior incidência
de
radiação
solar,
seguida
das
plantas
sob
“aluminete®”
40%
e
80%
respectivamente. E, quando se compara o valor de umidade relativa do ar nos
ambientes sob “aluminete®” 40% com o ambiente sob “aluminete®” 80%, foi
verificado que o primeiro é maior em relação ao último.
A poaia é conhecida por ser planta de “sombra”.
O clima de um fragmento de mata favorável para o desenvolvimento da poaia
deve ser quente e úmido no verão, com abundância de precipitação pluviométrica,
em torno de 1500 mm, intercalado com período seco e quente, recebendo algumas
ondas de frio, podendo chegar a cinco graus, segundo Barros (1942). Mostra-se
neste caso a necessidade de correlação ambiental complexa entre os aspectos de
luminosidade e umidade.
79
Neste estudo, o “aluminete®” 80% mostrou ser favorável à produção e síntese
dos principais alcalóides, os não fenólicos, bem como de alcalóides totais,
confirmando desta forma, os resultados já observados na literatura com relação à
plantas de sombra.
No entanto, sob “aluminete®” 40%, em alguns tratamentos foi observado
também situação favorável. Este fato pode estar associado às observações
constatadas no experimento de Melo e cols. (2003), onde as melhores condições de
umidade foram observadas sob o “aluminete®” 40%, e não sob o “aluminete®” 80%.
Vale salientar que resultados diferentes foram observados no comportamento
de Bauhinia Forficata Link. (ATORCH, 1999), nos aspectos abordados mostrando
que outros estudos se fazem necessários para responder e controlar favoravelmente
cada espécie à sua necessidade e conseguir o melhor desempenho da mesma.
4.6 Perfil cromatográfico do extrato alcaloídico e identificação da emetina por
CLAE
Empregou-se esta metodologia para confirmar a presença de emetina, o
principal
alcalóide
presente,
bem
como
a
comparação
entre
os
perfis
cromatográficos das amostras. Os perfis obtidos estão nas Figuras 30, 31, 32 e 33.
A quantidade de material disponível esteve limitada, às duas amostras
possíveis de serem trabalhadas foram: G40L (amostra 2) e G80E (amostra 17). As
demais, submetidas aos mesmos tratamentos não estavam disponíveis em
quantidades suficientes.
Nos cromatogramas das Figuras 30 e 31, observa-se um pico majoritário,
aparentemente comum nas duas amostras com tempo médio de retenção de 11,2 e
outros que não puderam ser identificados.
Nas amostras G40L(2) e G80E(17) observam-se tempos de retenção
próximos para a emetina, de 8,5 e 8,3 respectivamente (Figura 30 e 31). A figura 32
apresenta o perfil cromatográfico para a emetina padrão, com tempo de retenção de
8,5 semelhante àqueles dos extratos. Na figura 33 os perfis cromatográficos estão
superpostos, para facilitar a identificação da emetina nos extratos.
80
30
31
Figura 30 a 31 - Cromatogramas obtidos por CLAE do extrato bruto de raízes de P.
ipecacuanha. 30. G40L (amostra 2) 31. G80E (amostra 17). Gradiente com a seguinte fase
móvel: água acidificada com ácido hexanosulfônico (pH 2,6) e acetonitrila de 70 a 30% em 30
minutos. O fluxo foi de 1 ml/min., temperatura de 30°C e detecção por UV a 285 nm.
81
32
33
Figura 32 a 33 - Cromatogramas obtidos por CLAE do extrato bruto de raízes de P.
ipecacuanha. 32 - Padrão emetina; 33 - Sobreposição das amostras G40L (amostra 2), G80E
(amostra 17) e Padrão emetina. Gradiente com a seguinte fase móvel: água acidificada com
ácido hexanosulfônico (pH 2,6) e acetonitrila de 70 a 30% em 30 minutos. O fluxo foi de 1
ml/min., temperatura de 30°C e detecção por UV a 285 nm.
82
5 CONCLUSÃO
Nas condições em que este trabalho foi conduzido pode-se concluir que:
(1) No estudo morfológico
Não houve diferença estatisticamente significativa entre o comprimento e
largura das folhas, entre os comprimentos de raízes, comprimentos de estípulas,
peso das raízes e rizomas, seja em relação à planta obtida da mata nativa, seja
entre as submetidas aos tratamentos, ou entre ambas.
Existe diferença estatisticamente significativa entre os comprimentos do
caule, entre a planta nativa e as submetidas aos tratamentos.
Ocorreu um maior número de raízes secundárias nas amostras tratadas em
relação à planta nativa.
A única diferença significativa observada foi entre os comprimentos de caule,
mas apenas entre a planta nativa e as submetidas aos tratamentos, mas não nas
tratadas entre si.
(2) No estudo anatômico
Não ocorreram diferenças nas características anatômicas de raiz, rizomas e
grãos de amido entre a planta nativa e as submetidas aos tratamentos.
83
(3) Ensaios de pureza
Os valores encontrados nos ensaios de pureza para a nativa foram: perda por
dessecação: 9,18%; cinzas totais: 2,65%; cinzas insolúveis: 0,5%.
(4) CCD
A presença dos alcalóides emetina e cefalina, Rf = 0,24 e Rf = 0,13
respectivamente, da poaia, foi detectada através da CCD.
(5) Doseamento de alcalóides não-fenólicos
Os
teores
de
alcalóides
não-fenólicos
apresentaram
diferença
estatisticamente significativa entre a amostra nativa e as submetidas aos
tratamentos.
Os teores em alcalóides não-fenólicos na amostra nativa foram menores do
que nas amostras tratadas.
As melhores condições para produzir alcalóides não-fenólicos são: G80L2 =
G80E2 = G40L1.
A interceptação da radiação solar (0% e 100%) é favorável a presença destes
alcalóides, tanto na condição G40 ou G80.
(6) Doseamento de alcalóides fenólicos
Os teores observados não foram alterados através dos tratamentos
empregados.
(7) Doseamento de alcalóides totais
O teor de alcalóides totais apresentou diferença estatisticamente significativa
entre a amostra nativa e as submetidas aos tratamentos.
O teor em alcalóides totais na amostra nativa foi menor do que nas amostras
tratadas.
84
As melhores condições para produzir alcalóides totais são: G80L2 superior às
G80E2 = G40L1.
A interceptação da radiação solar (0% e 100%) foi favorável a presença
destes alcalóides. O estresse luminoso (0% de interceptação solar) foi mais
favorável do que 100% de interceptação.
(8) Processo biotecnológico
Observou-se que as plantas obtidas por processo biotecnológico apresentam
maiores teores em alcalóides não-fenólicos e totais do que a planta nativa.
(9) CLAE
O perfil cromatográfico por CLAE confirmou a presença de emetina nas
amostras G40L(2) e G80E(17).
85
REFERÊNCIAS BIBLIOGRÁFICAS
ADDOR, A. A.; Considerações acerca da poaia. Boletim do Ministério da
Agricultura (Rio de Janeiro), v.34, n.5, p.1-28, 1945, apud ASSIS, M. C.; GIULIETTI,
A. M. Diferenciação morfológica e anatômica em populações de “ipecacuanha”
- Psychotria ipecacuanha (Brot.) Stokes. (Rubiaceae). Revista Brasileira de
botânica, v.22, n.2, p.205-216, 1999.
ALENCAR, B. M. C. M.; SANTOS, A. V. P. Contribuição ao conhecimento da
anatomia foliar de Ipeca (Cephaelis ipecacuanha Rich.). Ciência e Cultura, v.32,
n.7, p. 868-872, 1980.
ALMEIDA, E. M.; ALVES, M. A. S. Fenologia de Psychotria nuda e P. brasiliensis
(Rubiaceae) em uma área de floresta atlântica no sudeste do Brasil. Acta
Botânica Brasílica, v.14 n.3 p.335-346, 2000.
AMARAL, C. L. F.; SILVA, A. B. Melhoramento Biotecnológico de Plantas
Medicinais. Revista Biotecnologia Ciência e Desenvolvimento. Edição nº30,
janeiro/julho, p.55-59, 2003.
ASSIS, M. C.; Aspectos taxonômicos, anatômicos e econômicos da “ipeca”
Psychotria ipecacuanha (Brot.) Stokes. (Rubiaceae). 1992. 132p. (dissertação de
mestrado em botânica) - Instituto de Biociências - Universidade de São Paulo, São
Paulo, 1992.
ASSIS, M. C.; GIULIETTI, A. M., Diferenciação morfológica e anatômica em
populações de “ipecacuanha” - Psychotria ipecacuanha (Brot.) Stokes.
(Rubiaceae). Revista Brasileira de botânica, v.22, n.2, p.205-216, 1999.
ATROCH, E. A. C. Aspectos fisiológicos, anatômicos e biossíntese de
flavonóides em plantas jovens de Bauhinia forficata Link. Submetidas a
diferentes níveis de irradiancia. 1999. 62p. (Dissertação de mestrado em fisiologia
vegetal). Universidade Federal de Lavras, Lavras, 1999.
BARBOSA, M. C.; CAMPOS, J. A.; CABRAL, M. F. E.; BEIER, M.; OLIVEIRA, J. S.;
COSTA, D. M. Eficácia do xarope de ipeca no tratamento das intoxicações
agudas: uma necessidade do controle de qualidade em nosso meio. Revista de
Farmácia e Bioquímica, v.7, n.único, p.23-27, 1986.
86
BARROS, P. P. A ipecacuanha. Sua extração, cultura e comércio. Boletim do
Ministério da Agricultura, p.1-21, 1942.
BARTSCHERER, D. J. Syrup of ipecac: apropriate use in the emergency
department. J. Emerg. Nurs. v.23, p.251-253, 1997.
BASE DE DADOS TROPICAL (BDT) Espécies Arbóreas da Mata Atlântica. O
Ecossistema Mata Atlântica. Arquivo capturado em maio de 2005. Disponível em:
http://www.bdt.org.br/mataatlantica/flora/
BATISTINE A. P.; MORO J. R.; FRANCA S. C.; PEREIRA A. M. S. Avaliação de
diferentes sistemas de cultivo in vitro para micropropagação de Psychotria
ipecacuanha (Brot.) Stokes Revista Brasileira de Plantas Medicinais, v.5 n.1, p.2735, 2002.
BOLETIM FARMACOTERAPÊUTICA. Atualizando a Relação Nacional de
Medicamentos Essenciais. Informativo do Centro Brasileiro de Informação Sobre
MEDICAMENTOS - CEBRIM - ano X, n.2, 2005. Disponível em:
<http://www.cff.org.br/cebrim.html> Arquivo capturado em junho de 2007.
BOTELHO, E. A Cultura de Plantas Medicinais Como Fonte de Riqueza. Rio de
Janeiro: Imprensa Nacional, 1942.
BRITSH PHARMACOPOEIA 2005. London: The Station Nary Office, 2005, v.4.
BROTERO, F. A. Description of Callicocca ipecacuanha. Trans. Linn. Soc. 6: 137141, 1802, apud ASSIS, M. C.; GIULIETTI, A. M. Diferenciação morfológica e
anatômica em populações de “ipecacuanha” - Psychotria ipecacuanha (Brot.)
Stokes. (Rubiaceae). Revista Brasileira de botânica, v.22, n.2, p.205-216, 1999.
BROWN JUNIOR, K. S. Engenharia ecológica novas perspectivas de seleção ee
manejo de plantas medicinais. Acta Amazônica, v.18, n.1, p.291-303, 1988.
BUCARETCHI, F.; BARACAT, E. C. E. Exposições tóxicas agudas em crianças:
um panorama. J. Pediatr. v.81, n.5, p.S212-S222, 2005.
CEDEIRA, R. M. M.; KRANS, J. V.; FRANCA, S. C.; PEREIRA, A. M.S. Evaluation
of emetine production in ipecac callus. Ciência e Cultura São Paulo, v.47 n.1-2,
p.76-78, 1995.
87
COPAM. Deliberação COPAM nº 85, 30 de outubro de 1997. Conselho Estadual de
Política Ambiental, Belo Horizonte, 1 cad., p.10-12, 1997
CORREIA, M. P. Dicionário das plantas úteis do Brasil. Rio de Janeiro: Ministério
da agricultura, v.4, 1969, p.320-324.
COSTA, A. F. Farmacognosia, 4ª edição, Lisboa: Fundação Calouste Gulbenkian,
1986, v.3.
COSTA, M. P.; PINTO, J. E. B. P.; FRANCA, S. C.; LAMEIRA, O. A.; CONCEIÇÃO,
H. O.; SANTIAGO, E. J. A.; COSTA, M. P.; SANTIAGO, E. J. A. Crescimento e teor
de emetina em plantas de ipeca (Cephaelis ipecacuanha A. Richard.) obtidas in
vitro e submetidas as condições de soluções nutritivas em casa-de-vegetação.
Ciência e Agrotecnologia, v.24 n.1, p.46-53, 2000.
CRONQUIST, A. An integrate systen of classification of flowering plants.
Columbia University Press. New York, 1981.
DANTAS-BARROS, A. M.; DUBREUIL-JACQUIN, A. Obtención de cultivos de
células vegetales in vitro de Thevetia neriifolia Juss. y presencia de
compuestos cadiotónicos. Acta Farm. Bonaerense, Buenos Aires, v.13, n.3, p.145149, 1994.
DEAN, A. G. Epi-Info, version 6.04b: a word-processing, database, and statistics
program for public health on IBM-compatible computers. Altanta: Centers for
Disease Control and Prevention, 1995.
Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA). Estratégias para
conservação e manejo de recursos genéticos de plantas medicinais e
aromáticas. Resultados da 1ª reunião técnica. Brasília: Embrapa, 2002.
ENGEL, V. L.; POGGIANI, F. Estudo da concentração de clorofila nas folhas e
seu espectro de absorção de luz em função do sombreamento de mudas de
quatro espécies florestais nativas. Revista Brasileira de Fisiologia Vegetal, v.3,
n.1, p.39-45, 1991.
FARMACOPÉIA BRASILEIRA, São Paulo: Indústria Gráfica Siqueira. 2ª ed., v.2,
1959.
FARMACOPÉIA BRASILEIRA, Organização Andrei editora S.A. Parte II, 3ª ed. 1977.
88
FARMACOPÉIA BRASILEIRA, São Paulo: Atheneu Editora. 4a. ed., Parte II, 1996.
FOSTER, A. S. Pratical plant anatomy. 2 ed. Princeton: D. Van Nostrand Company
Inc., 1949, p.213-218.
FRANÇA, S. C. Abordagens biotecnológicas para a obtenção de substâncias ativas.
In: SIMÕES, C. M. O.; SCHENKEL, E. P.; GOSMANN, G.; MELLO, J. C. P.; MENTZ,
L. A; PETROVICK, P. R. Farmacognosia da Planta ao Medicamento.
Florianópolis: Editora da Universidade Federal de Santa Catarina, 5ª Ed., 2003,
p.123-146.
GARCIA, E. S.; SILVA, A. C. P.; GILBERT, B.; CORRÊA, C. B.; CAVALHEIRO, M. V.
S.; SANTOS, R. R.; TOMASSINI, T. Biodiversidade: Perspectivas e
Oportunidades Tecnológicas - Fitoterápicos, Base de Dados Tropical - BDT,
Fundação André Tosello, 1998. Arquivo capturado em outubro de 2006. Disponível
em: http://www.bdt.fat.org.br
GARCIA, R. M. A. Variação sazonal do conteúdo de alcalóides e anatomia de
raiz e caule de Psychotria ipecacuanha (Brot.) Stokes (Rubiaceae) em
populações nativas. 2001. 73p. (Dissertação de mestrado) Universidade Federal de
Viçosa, Viçosa 2001.
GARCIA, R. M. A.; OLIVEIRA, L. O.; MOREIRA, M. A.; BARROS, W. S. Variation in
emetine and cephaeline contents in roots of wild Ipecac (Psychotria
ipecacuanha). Biochemical Sistematics and Ecology, v.33 p.233-243, 2005.
GORDON, G. Ipecacuanha induced emesis in the treatment of self - poisoned
adults. Archives of Emergency Medicine, v. 2 n. 4 p. 203-208, 1985.
GRANDI, T. S. M. Espécies medicinais da mata atlântica: aspectos botânicos,
educacionais e conservacionistas, Relatório técnico - Fundação Biodiversitas,
1993.
GREGÓRIO, J. Contribuição indígena ao Brasil. ed. Esdeva empresa gráfica, v.3
1980 p.1315.
HASEGAWA M, SASAKI T, SADAKANE K, TABUCHI M, TAKEDA Y, KIMURA M,
FUJII Y. Studies for the emetic mechanisms of ipecac syrup (TJN-119) and its
active components in ferrets: involvement of 5-hydroxytryptamine receptors.
Japanese Journal of Pharmacology, v. 89, n. 2, p.113-119, 2002.
89
HATFIELD, G. M.; ARTEAGA, L.; DWYER, J. D.; ARIAS, T. D.; GUPTA, M. P. An
investigation of panamanian ipecac: botanical source and alkaloid analysis.
Journal of Natural Products, v.44 n.4 p.452-456, 1981.
HIDALGO, N.; GUEVARA-BERGER E.; HERRERA, J. Prodution of Psychotria
ipecacuanha trough in vitro cultivation of roots. Tecnologia en Marcha, v.11, n.3,
p.17-22, 1992.
IBAMA - INSTITUTO BRASILEIRO DO MEIO AMBIENTE E DOS RECURSOS
NATURAIS RENOVÁVEIS. Portaria nº 83, de 15 de outubro de 1996 - Dispõe
sobre exportação de produtos da flora. Arquivo capturado em junho de 2007.
Disponível em: http://www.ibama.gov.br/flora/portarias/083_96.pdf
IBAMA - INSTITUTO BRASILEIRO DO MEIO AMBIENTE E DOS RECURSOS
NATURAIS RENOVÁVEIS. Plantas medicinais ameaçadas de extinção. Arquivo
capturado
em
junho
de
2007.
Disponível
em:
http://www.ibama.gov.br/flora/divs/plantasextincao.pdf
ITOH, A.; TANAHASHI, T.; NAGAKURA, N. Six tetrahydroisoquinolinemonoterpene glucosides from Cephaelis ipecacuanha. Phytochemistry, v.30, n.9
p.3117-3123, 1991.
ITOH,
A.;
TANAHASHI,
T.;
NAGAKURA,
N.;
NAYESHIRO,
H.
tetrahydroisoquinoline-monoterpene glucosides from Alangium lamarckii and
Cephaelis ipecacuanha. Phytochemistry, v.36, n.2 p.383-387, 1994.
ITOH, A.; IKUTA, Y.; BABA, Y.; TANAHASHI, T.; NAGAKURA, N. Ipecac alkaloids
from Cephaelis acuminata. Phytochemistry, v.52, p.1169-1176, 1999.
JHA, S.; SAHU, N. P.; MAHATO, S. B. Production of the alkaloids emetine and
cephaeline in callus cultures of Cephaelis ipecacuanha. Planta Médica, v.54, n.6,
p.504-506. 1988.
JHA, S.; JHA, T. B. Micropropagation of Cephaelis ipecacuanha Rich. Plant Cell
Reports, v.8, p.437-439, 1989.
JHA, T. B.; JHA, S.; YAMUNA, P.; BOSE, I. Direct organogenesis from internodal
segments of in vitro grown shoots of ipecac, Cephaelis ipecacuanha Rich.
Indian Journal of Experimental Biology, v.31, n.11, p.926-929, 1993.
90
JOHANSEN, D. A. Plant microtechnique, New York: McGraw Hill, p.523, 1940.
KAY, Q. O. N. Variation, polymorphism and gene-flow within species. In: HEYWOOD,
V. H.; MOORE, D. M. Current concepts in plant taxonomy. London: Academic
Press, 1984.
KEINÄNEN, M.; OLDHAM, N. J.; BALDWIN, I. T. Rapid HPLC screening of
jasmonate-induced increases in tobacco alkaloids, phenolics and diterpene
glycosides in Nicotiana attenuata. J. Agrig. Food Chem., v.49, p.3553-3558, 2001.
KRENZELOK, E. P. New developments in the therapy of intoxications.
Toxicology Letters v.127, p.299-305, 2002.
KLAASSEN, C. D. Princípios de toxicologia e tratamento do envenenamento. In:
GOODMAN e GILMAN. As bases farmacológicas da terapêutica. 11.ed. Rio de
Janeiro: Mac GrawHill, 2006.
Kursinszki, L.; Hank, H.; László I.; Szöke, É. Simultaneous analysis of
hyoscyamine, scopolamine, 6β-hydroxyhyoscyamine and apoatropine in
Solanaceous hairy roots by reversed-phase high-performance liquid
chromatography. Journal of chromatography A, v.1091, p. 32-39, 2005.
LAMEIRA, O. A.; COSTA M. P.; PINTO J. E. B. P. The efficiency of shoot and
plantlet formation of Cephaelis ipecacuanha after three subcultures in vitro.
Ciência Rural, Santa Maria, v.24, n.3, p.523-526, jun. 1994.
LAMEIRA, O. A. Cultivo da Ipecacuanha [Psychotria ipecacuanha (Brot.)
Stokes]. EMBRAPA, Circular técnica, 28. p. 1-4, 2002.
LEONI, L. S.; SOUZA, V. C. Espécies Endêmicas Ocorrentes no Parque Nacional
do Caparaó - Minas Gerais PABSTIA - Boletim do herbário Guido Pabst, GFJP
Universidade Estadual de Minas Gerais, v. X, n.1, 13p. 1999.
LEONI, L. S. Catálogo Preliminar das Fanerógamas Ocorrentes no Parque
Nacional do Caparaó - MG. PABSTIA - Boletim do herbário Guido Pabst,
Universidade Estadual de Minas Gerais. v. VIII, n.2, 28p., 1997.
LORENZI, H.; MATOS, F. J. A. Plantas medicinais do Brasil nativas e exóticas.
Nova Odessa, SP. Instituto Plantarum, 2002, p.411-412.
91
MARTINS, E. R. Conservação da poaia (Psychotria ipecacuanha): coleta,
ecogeografia, variabilidade genética e caracterização reprodutiva. Universidade
Estadual do Norte Fluminense, (Tese doutorado), 109p., 2000.
MELO, H. C.; BARBOSA, J. P. R. A. D.; BONOME, L. T. S.; DEUNER, S.
Caracterização ambiental e aspectos fotossintéticos em cultivo sombreado de
guaco. Relatório de aula prática de ecofisiologia vegetal, setor de fisiologia vegetal departamento de biologia - Universidade Federal de Lavras. p.1-12, 2003.
METCALF, C. R.; CHALK, L. Anatomy of the dicotyledons: leaves, stem and
wood in relation to taxonomy with notes on economic uses. Oxford: Claredon,
v.1, 1950.
MURASHIGE, T.; SKOOG F. A Revised Médium for Rapid Growth and Bioassays With Tabaco Tissue culture. Physiologia Plantarum, v.15, p.473-497, 1962.
NAGAKURA, N.; ITOH, A.; TANAHASHI, T. Four tetrahydroisoquinolinemonoterpene glucosides from Cephaelis ipecacuanha. Phytochemistry, v.32, n.3
p.761-765, 1993.
NETO, G. G.; MORAIS, R. G. Recursos medicinais de espécies do cerrado de
mato grosso: um estudo bibliográfico. Acta Bot. Bras. v.17, nº4, p.561-584, 2003.
OLIVEIRA, L. O.; MARTINS, E. R. O desafio das plantas medicinais brasileiras I o caso da poaia (Cephaelis ipecacuanha) Campos dos Goytacazes: Fundação
Estadual do Norte Fluminense, UENF, 1998, 72 p.
OLIVEIRA, F.; AKISUE, G.; AKISUE, M. K., Farmacognosia. 1ª ed., São Paulo:
Ateneu, 1998. 412p.
PARIS, R. R.; MOYSE, H. Matière médicale. Paris: Masson, 1971, v. 3, 509p.
PARIS, M. E. Intoxicaciones en Pediatría: Manejo General. Revista chilena de
pediatría, v.70, n 4, p.351-353, 1999.
PEREIRA, M. G. Epidemiologia – teoria e prática. Rio de Janeiro: Guanabara
Koogan, 1995. 596 p.
92
PERES, L. E. P. Bases fisiológicas e genéticas da regeneração de plantas in
vitro. Revista Biotecnologia Ciência e Desenvolvimento. Edição nº25, março/abril,
p.44-48, 2002.
PERÉT-ALMEIDA, L. Curcuma longa L. – Caracterização, separação, avaliação
da atividade antimicrobiana, morfogênese in vitro e produção de pigmentos
curcuminóides. 2006. 136p. (tese de doutorado em Ciências Farmacêuticas) –
Departamento de Alimentos – Faculdade de Farmácia, Universidade Federal de
Minas Gerais, Belo Horizonte, 2006.
PINTO, C. M. D., A ipecacuanha In: Simpósio Internacional Sobre Plantas de
Interesse Econômico de la Flora Amazônica. IICA. Trópicos. Informes de
conferências, cursos y reuniones nº 93. Costa Rica, 1976, apud ASSIS, M. C.;
Aspectos taxonômicos, anatômicos e econômicos da “ipeca” Psychotria
ipecacuanha (Brot.) Stokes. (Rubiaceae). 1992. 132p. (dissertação de mestrado
em botânica) - Instituto de Biociências - Universidade de São Paulo, São
Paulo,1992.
PLETSCH, M. Compostos naturais biologicamente ativos. Biotecnologia: Ciência
e Desenvolvimento. Brasília, DF, n.4, p.12-15, 1998.
PONS, T. L.; PEARCY, R. W. Nitrogen rellocation and photosynthetic
acclimation in response to partial shading in soybean plants. v.92, p.636-644,
1994.
RAETHER, W.; HANEL, H. Nitroheterocyclic drugs with broad-spectrum activity.
Parasitol. Res., v.90 n. supplement 1, p.19-39, 2003.
REIS, E. S.; PINTO, J. E. B.; CORRÊA, R. M.; BERTOLUCCI, S. K. V.; LAMEIRA, O.
A. Tamanhos e posições de explantes e volumes de meio de cultivo na
multiplicação de ipeca (Psychotria ipecacuanha (Brot.) Stokes) in vitro. Ciênc.
agrotec., v.28, n.3, p.703-709, 2004.
RENNÓ, L. R. Plantas medicinais que ocorrem no estado de Mina Gerais para
um programa de proteção. Revista Brasileira de Farmácia, v. 50, p. 205-212, 1969.
ROBBERS J. E.; SPEEDIE M. K.; TYLER V. E. Farmacognosia
Farmacobiotecnologia. São Paulo: Editorial Premier, 1997, 372p.
ROBBRECHT, E. Tropical woody Rubiaceae. Characteristics features and
progressions. Contribution to a new subfamilial classification. Nationale
Plantentuim van Belgie, v.1, p.11, 1998.
93
RODRIGUES, L. R.; OLIVEIRA, J. M. S.; MARIATH, J. E. A. Anatomia vegetal
aplicada ao estudo de sistemas androgênicos in vitro. Revista Brasileira de
Biociências. v.2, p.159-167, 2004.
ROSSI, A. A. B.; OLIVEIRA L. O.; VIEIRA, M. F. Distilia e variação das
características florais em populações naturais de Psychotria ipecacuanha
(Brot.) Stokes (Rubiaceae). Revista Brasileira de Botânica, v.28, n.2, p.285-294,
2005.
ROUT, G. R.; MALLICK, U. C.; DAS, P. In vitro plant regeneration from leaf callus
of Cephaelis ipecacuanha A. Richard. Advances in Plant Sciences, v.5, n.2, p.608613, 1992.
ROUT, G. R., SAMANTARAY, S., DAS, P., in vitro somatic embryogenesis from
callus cultures of Cephaelis ipecacuanha A. Richard. Scientia Horticulture, v.86,
n.único, p.71-79, 2000.
ROUT, G. R.; SAXENA, C.; DAS, P. Somatic embryogenesis in Cephaelis
ipecacuanha A. Richard: effect of growth regulators and culture conditions.
Journal of Herbs, Spices and Medicinal Plants, v.8, n.1, p.59-67, 2001.
SICK, H. Birds in Brazil. New Jersey: Princeton University Press, 1993.
SIEGEL, S.; CASTELLAN, N. J. Non parametric statistics for behavior and
science. 2ªnd ed. New York: McJeaw-Book, 1988. 399p.
SILVA, A. F. Floresta atlântica. In: MENDONÇA, M. P.; LINS, L. V. Lista vermelha
das espécies ameaçadas de extinção da flora de Minas Gerais. Belo Horizonte:
Fundação Biodiversitas, Fundação Zôo-Botânica de Belo Horizonte, 2000. p.45-53.
SILVA, R. A. D. Pharmacopéia dos Estados Unidos do Brasil. São Paulo:
Companhia Editora Nacional, 1929. 1149 p.
SIMÕES, C. M. O.; SCHENKEL, E. P.; GOSMANN, G.; MELLO, J. C. P.; MENTZ, L.
A; PETROVICK, P. R. Farmacognosia da Planta ao Medicamento. Florianópolis:
Editora da Universidade Federal de Santa Catarina, 5ª Ed., 2003, 1102p.
SKORUPA, L. A.; ASSIS, M. C. Collecting and conserving ipecac (Psycotria
ipecacuanha, Rubiaceae) Germplasm in Brazil. Economic Botany v. 52 n. 2, p.
209-210, 1998.
94
STEYERMARK, J. A. The botany of the Guayana Highland part IX. Rubiaceae. Men.
New York Bot. Gard. 23:227-832. 1972 apud ASSIS, M. C.; GIULIETTI, A. M.
Diferenciação morfológica e anatômica em populações de “ipecacuanha” –
Psychotria ipecacuanha (Brot.) Stokes. (Rubiaceae). Revista Brasileira de
botânica, v.22, n.2, p.205-216, 1999.
STÖCKIGT, J.; SHELUDKO, Y.; UNGER, M.; GERASIMENKO, I.; WARZECHA, H.;
STÖCKIGT,
D.
High-performance
liquid
chromatographic,
capillary
electrophoretic and capillary electrophoretic-electrospray ionization mass
spectrometric analysisof selected alkaloid groups. Journal of chromatography A,
v.967, p. 85-113, 2002.
TESHIMA, D.; TSUCHIYA, T.; AOYAMA, T.; HORIOKA, M. Quantitative
determination of main emetic components (emetine and cephaeline) in ipecac.
Iyakuhin Kenkyu, v.15, p.63-71, 1984 apud YOSHIMATSU, K.; SHIMOMURA, K.
Cephaelis ipecacuanha A. Richard (Brazilian Ipecac): Micropropagation and the
Production of Emetine and Cephaeline. Journal Plant Physiology, v.144, p.87-103,
1994.
Tikhomiroff, C.; Jolicoeur, M. Screening of Catharanthus roseus secondary
metabolites by high performance liquid chromatography. Journal of
Chromatography A, v.955, p.87-93, 2002.
UNITED STATES PHARMACOPEIA, USP29 NF24, 2005. Rockville: The United
States Pharmacopeia Convention 2005.Official Monographs/Ipecac, p.1173-1176.
VASCONSUELO, A.; BOLAND, R. Molecular aspects of early stages of elicitation of
secondary metabolites in plants. Plant Science, v.172, p.861-875, 2007.
VEERESHAM, C.; KOKATE, C.; VENKATESHWARLU, V. Influence of precursors
on production of isoquinoline alkaloids in tissue cultures of Cephaelis
ipecacuanha. Phytochemistry, v.35, n.4, p.947-949, 1994.
VIEIRA, S. Introdução à bioestatística. 2ed. Rio de Janeiro: Campus, 1991. 203 p.
VIEIRA, R. F. Conservation of Medicinal and Aromatic Plants in Brazil. 1999.
Arquivo
capturado
em
maio
de
2007.
Disponível
em:
http://www.hort.purdue.edu/newcrop/proceedings1999/pdf/v4-152.pdf
95
YOUNG, W. F.; BIVINS, H. G. Evaluation of gastric emptying using
radionuclides: gastric lavage versus ipecac-induced emesis. Ann. Emerg. Med.
v.22, p.1423-1427, 1993.
YOSHIMATSU, K.; SHIMOMURA, K. Efficient shoot formation on internodal
segments and alkaloid formation in the regenerates of Cephaelis ipecacuanha
A. Richard. Plant Cell Reports, v.9, n.10, p.567-570, 1991.
YOSHIMATSU, K.; SHIMOMURA, K. Emetic alkaloid formation in root culture of
Cephaelis ipecacuanha. Phytochemistry, v.30, n.2, p.505-507, 1991.
YOSHIMATSU, K.; SHIMOMURA, K. Cephaelis ipecacuanha A. Richard (Brazilian
Ipecac): Micropropagation and the Production of Emetine and Cephaeline.
Journal Plant Physiology, v.144, p.87-103, 1994.
YOSHIMATSU, K.; SHIMOMURA, K. Plant Regeneration on Cultured Root
Segments of Cephaelis ipecacuanha A. Richard. Plant Cell Reports, v.14, n.2-3,
p. 98-101, 1994.
ZENK, M. H.; EL-SHAGI, H.; SCHULTE, V. Anthraquinone production by cell
suspension cultures of Morinda citrifolia. Planta Medica Supplied, Stuttgard, 79101, 1975.
ZHONG, J. J. Plant cell culture for production of paclitaxel and other taxanes.
Journal of Bioscience and bioengineering, v.94, n.6, p.591-599, 2002.
96
ANEXO – Reagentes gerais
Reagentes para microscopia
- FAA 70
Formaldeído 37%, Ácido Acético, etanol 70% (5:5:90) (JOHANSEN, 1940).
- Safrablau
Safranina e azul de astra (2:8) (JOHANSEN, 1940).
- Reativo de Dragendorff
(I) Solução estoque (armazenada em frasco âmbar):
Água destilada ................................................................ 50 ml
Carbonato de bismuto ..................................................... 5 g
HCl .................................................................................. 12 ml
Iodeto de potássio ........................................................... 25 g
Misturar os três primeiros ingredientes com cuidado até a completa dissolução.
Em seguida misturar o iodeto de potássio e completar com água até o volume
final de 100 ml.
(II) Reagente para histoquímica:
Solução estoque ...............................................................25 ml
Ácido acético ....................................................................18 ml
Água destilada q.s.p. ....................................................... 100 ml
(III) Controle:
Ácido tartárico 5% em etanol 95% (3 dias) - lavar - Submeter ao reativo de
Dragendorff (JOHANSEN, 1940).
97
Reagentes utilizados em CCD e doseamento
- Reagente de Dragendorff SR (Farmacopéia Brasileira 4ª edição, 1996)
Solução A: dissolver 17 g de subnitrato de bismuto e 200 g de ácido tartárico em 800
ml de água. Solução B: dissolver 160 g de iodeto de potássio em 400 ml de água.
Solução estoque: solução A + B.
Solução para nebulização: 50 ml da solução estoque + 500 ml de água + 100g de
ácido tartárico.
- Reagente de Mayer SR (Farmacopéia Brasileira 4ª edição, 1996)
1,35 g de cloreto de mercúrio + 60 ml de água e, separadamente, 7 g de iodeto de
potássio em 20 ml de água. Misturar as duas soluções, agitar, filtrar e completar a
100 ml com água.
- Tampão acetato de sódio
40 g de acetato de sódio + água q.s.p. 100 ml. Adicionar 1,8 ml de ácido acético e
filtrar.
98
APÊNDICE A – Esquema de extração de alcalóides não-fenólicos e fenólicos
(FARMACOPÉIA BRASILEIRA, 1996)
Material vegetal 1 g
Erlenmeyer 100 ml
tarado
20
ml de éter etílico
Agitação 5 min.
5 ml NH4OH 25% SR
Agitação 1 hora
Completar com éter
Filtrar em algodão
Filtrado 1
Filtrados reunidos
Repetir a operação até Mayer -
Alíquota de 10 ml
Funil de separação
5 ml NaOH
Repetir a operação até Mayer -
Extratos alcalinos reunidos
Solução etérea
inicial
Solução etérea
Funil de separação
15 ml de éter etílico
Descartar
Soluções etéreas reunidas
Solução alcalina
Solução etérea
Evaporar 50-60°C
2 ml de etanol
5 ml de HCl 0,5 M
Balão vol. 100 ml
Balão (100 ml) - reservar
para doseamento de
alcalóides não fenólicos
Completar com água
Solução
aquosa
Alíquota de 5 ml
Alíquota de 5 ml
5 ml tampão acetato de sódio
10 ml etanol
2 ml de iodo 0,1 M
10 ml água
Aquecer b.m. 15 min.
Resfriar
BRANCO
3 ml Na2S2O3
10 ml etanol
ABSORVÂNCIA
Alcalóides fenólicos
99
Solução alcalina reservada
15 ml de HCl
Água q.s.p. 100 ml
Solução ácida
Alíquota de 5 ml
Alíquota de 5 ml
5 ml tampão acetato de sódio
10 ml etanol
2 ml de iodo 0,1 M
Aquecer b.m. 15 min.
resfriar
3 ml Na2S2O3
10 ml etanol
10 ml água
ABSORVÂNCIA
BRANCO
Alcalóides não fenólicos
100
APÊNDICE B – Média e desvio-padrão dos teores de alcalóides (%) das amostras de P.
ipecacuanha
Ambientes Tratamentos
Habitat
L
E
G40
N
L
G80
E
N
Amostras
Nativa
(3 amostras)
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
21
Teor de alcalóides (%)
Fenólicos
Não fenólicos
Totais
0,0643 ± 0,0194 1,6442 ± 0,0841
1,71
0,8874 ± 0,1608
0,1494 ± 0,0166
0,1618 ± 0,0242
0,4200 ± 0,0524
0,3039 ± 0,1204
0,5474 ± 0,0153
0,3263 ± 0,0397
0,5405 ± 0,0021
0,2163 ± 0,0294
0,4049 ± 0,0192
0,1039 ± 0,0201
0,4261 ± 0,0382
0,5503± 0,0210
0,6370 ± 0,0898
0,6001 ± 0,0236
0,5691 ± 0,1466
0,1257 ± 0,0011
0,4747 ± 0,0083
0,0941 ± 0,0713
0,3822 ± 0,0139
0,2480 ± 0,0560
3,13
3,02
3,00
2,71
2,61
2,60
2,24
2,42
2,20
2,31
2,49
3,47
3,62
3,29
3,15
3,14
3,06
1,97
2,07
2,05
1,78
2,2449 ± 0,0069
2,8700 ± 0,0459
2,8412 ± 0,0633
2,2908 ± 0,0432
2,3070 ± 0,0095
2,0489 ± 0,0310
1,9098 ± 0,1708
1,8812 ± 0,1404
1,9845 ± 0,2256
1,9026 ± 0,1363
2,3832 ± 0,0984
3,0481 ± 0,0418
3,0667 ± 0,0042
2,6522 ± 0,0890
2,5517 ± 0,0112
2,5681 ± 0,0299
2,9343 ± 0,2152
1,4930 ± 0,0979
1,9750 ± 0,0658
1,6634 ± 0,0851
1,5351 ± 0,1867
101
Livros Grátis
( http://www.livrosgratis.com.br )
Milhares de Livros para Download:
Baixar livros de Administração
Baixar livros de Agronomia
Baixar livros de Arquitetura
Baixar livros de Artes
Baixar livros de Astronomia
Baixar livros de Biologia Geral
Baixar livros de Ciência da Computação
Baixar livros de Ciência da Informação
Baixar livros de Ciência Política
Baixar livros de Ciências da Saúde
Baixar livros de Comunicação
Baixar livros do Conselho Nacional de Educação - CNE
Baixar livros de Defesa civil
Baixar livros de Direito
Baixar livros de Direitos humanos
Baixar livros de Economia
Baixar livros de Economia Doméstica
Baixar livros de Educação
Baixar livros de Educação - Trânsito
Baixar livros de Educação Física
Baixar livros de Engenharia Aeroespacial
Baixar livros de Farmácia
Baixar livros de Filosofia
Baixar livros de Física
Baixar livros de Geociências
Baixar livros de Geografia
Baixar livros de História
Baixar livros de Línguas
Baixar livros de Literatura
Baixar livros de Literatura de Cordel
Baixar livros de Literatura Infantil
Baixar livros de Matemática
Baixar livros de Medicina
Baixar livros de Medicina Veterinária
Baixar livros de Meio Ambiente
Baixar livros de Meteorologia
Baixar Monografias e TCC
Baixar livros Multidisciplinar
Baixar livros de Música
Baixar livros de Psicologia
Baixar livros de Química
Baixar livros de Saúde Coletiva
Baixar livros de Serviço Social
Baixar livros de Sociologia
Baixar livros de Teologia
Baixar livros de Trabalho
Baixar livros de Turismo