QUÍMICA - 1o ANO
MÓDULO 07
PROPRIEDADES
PERIÓDICAS
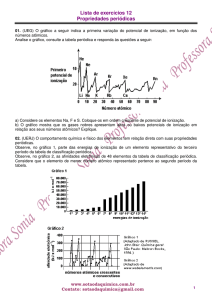
elétron mais
externo
raio
núcleo
d1
d2
r = _d1 + d2 _
2
Sucessivas energias de ionização ( eV )
100
80,1
80
71,6
60
47,3
40
20
7,6
Na
15
Mg
5,1
Mg
0
1ª E.I.
2ªE.I.
Na
3ªE.I.
Fixação
F
1) (PUC) Considere as afirmações sobre elementos do grupo IA da Tabela Periódica:
I) São chamados metais alcalinos.
II) Seus raios atômicos crescem com o número atômico.
III) Seu potencial de ionização aumenta com o número atômico.
IV) Seu caráter metálico aumenta com o número atômico.
Dentre as afirmações, são verdadeiras:
a) I e II
b) III e IV
c) I, II e IV
d) II, III e IV
e) I, II, III e IV
2
e
N
a
b
c
d
e
Fixação
2) (UFF) Dois ou mais íons ou, então, um átomo e um íon que apresentam o mesmo número de
elétrons denominam- -se espécies isoeletrônicas. Comparando-se as espécies isoeletrônicas F –,
Na+, Mg2+ e Al3+, conclui-se que:
a) a espécie Mg2+ apresenta o menor raio iônico;
b) a espécie Na+ apresenta o menor raio iônico;
c) a espécie F – apresenta o maior raio iônico;
d) a espécie Al3+ apresenta o maior raio iônico;
e) a espécie Na+ apresenta o maior raio iônico.
Fixação
F
3) (UFPA) Sobre o processo de ionização de um átomo A, mostrado a seguir:
+
A(g) + energia → A (g) + e
_
4
d
p
m
São feitas as seguintes afirmativas:
I) A energia de ionização aumenta à medida que o raio atômico diminui; sendo assim, é necessária uma quantidade de energia maior para remover elétrons de átomos menores.
d
II) O cátion formado possui um raio maior que o raio do átomo pelo fato de a perda do elétrons
deixar o átomo carregado mais positivamente e assim diminuir a atração entre os elétronsq
resultantes e o núcleo, o que promove a expansão da nuvem eletrônica.
C
III) A primeira energia de ionização é sempre a maior e, consequentemente, a remoção dea
elétrons sucessivos do mesmo átomo se torna mais fácil.
e
IV) A energia de ionização em átomos localizados no mesmo período da tabela periódica au-b
menta no mesmo sentido do aumento da carga nuclear.
e
Estão corretas as afirmativas:
c
á
a) I e III
d
b) II e IV
e
c) II e III
b
d) I e IV
e) I, II e IV
Fixação
4) (UFF) Após os trabalhos de Lavoisier, Dalton e outros, o estudo dos elementos químicos
desenvolveu-se de tal forma que se tornou necessário classificá-los de acordo com suas propriedades. A observação experimental tornou evidente que certos elementos têm propriedades
muito semelhantes, o que permite reuni-los em grupos.
Desde o século XIX, várias tentativas foram feitas, sem grande sucesso. O trabalho mais
detalhado foi feito em 1869 por Mendeleev. Ele ordenou os elementos em função de suas massas atômicas crescentes, respeitando suas propriedades químicas. O trabalho foi tão importante
que ele chegou a prever a existência de elementos que ainda não haviam sido descobertos.
Com base na tabela periódica, pode-se constatar que:
a) a energia de ionização de um elemento é a energia máxima necessária para remover um
elétron do átomo desse elemento no estado gasoso.
b) os elementos de transição interna são aqueles cujo subnível de maior energia da distribuição
eletrônica de seus átomos é f.
c) a afinidade eletrônica ou eletroafinidade é a energia associada à saída de um elétron num
átomo do elemento no estado gasoso.
d) as propriedades dos elementos são funções aperiódicas de seus números atômicos.
e) os elementos representativos são os elementos cujo subnível de menor energia da distribuição eletrônica de seus átomos é s ou p.
Fixação
5) (UFF) Existem metais que, na forma de
compostos, dão colorações características à
chama azul do bico de Bunsen. Essa propriedade é usada em laboratórios no reconhecimento de metais.
Com o calor da chama do bico de Bunsen,
os elétrons dos íons metálicos absorvem energia e saltam para níveis mais externos e,
ao retornarem para os níveis internos, emitem
radiações coloridas típicas de cada metal.
cálcio
estrônico
bário
sódio
composto
de
lítio
cobre
Observe a figura e assinale a opção correta.
a) Os elementos Li, Na, Cu, Sr, Ca e Ba, nessa
ordem, estão colocados em ordem crescente
de energia de ionização.
b) A configuração eletrônica do cobre é: [Ar]
4s2 3d10.
c) Elementos Ba, Sr e Ca pertencem ao grupo
dos alcalinos terrosos.
d) O elemento de transição interna é o Cu, já
que seu subnível de maior energia é o f.
e) Os elementos Li, Cu, Ba, Sr, Na e Ca, nessa
ordem, estão colocados em ordem crescente
de raio atômico.
aProposto
1) Descargas elétricas em um tubo contendo um gás sob baixa pressão (gás rarefeito) provocam a ionização desse gás pela retirada de elétron. Nesse caso, a força de atração do núcleo
sobre os elétrons restantes:
a) diminui, e, portanto, a primeira energia de ionização é sempre maior que a segunda;
b) aumenta, e, portanto, a primeira energia de ionização é sempre menor que a segunda;
c) diminui, e, portanto, a primeira energia de ionização é sempre menor que a segunda;
ad) aumenta, e, portanto, a primeira energia de ionização é sempre maior que a segunda;
e) permanece constante se o segundo elétron a ser retirado estiver no mesmo nível de energia
que o primeiro.
Proposto
2) (UFV) A seguir são apresentadas algumas informações sobre os elementos da coluna 2 da
tabela periódica. Sobre esses elementos, assinale a afirmativa INCORRETA:
a) O íon Ca2+ tem raio iônico menor que o raio atômico do Ca.
b) O íon Ca2+ tem raio iônico menor que o raio iônico do Sr2+.
c) O átomo de Ca tem raio atômico maior que o raio atômico do Mg.
d) O átomo de Ca é menos eletronegativo que o átomo de Ba.
Proposto
3) (CESGRANRIO) Uma das utilizações da Classificação Periódica dos Elementos é o estudo
comparativo de suas propriedades. Dos elementos a seguir, aquele que, ao mesmo tempo, é
mais denso que o BROMO e tem maior potencial de ionização do que o CHUMBO é o:
a) N
b) O
c) Ge
d) Fe
e) Kr
P
Proposto
4) (UFRJ) Desde o primeiro trabalho de Mendeleiev, publicado em 1869, foram propostas mais5
de quinhentas formas para apresentar uma classificação periódica dos elementos químicos.n
A figura a seguir apresenta um trecho de uma destas propostas, na qual a disposição dosn
elementos é baseada na ordem de preenchimento dos orbitais atômicos. Na figura, alguns
elementos foram propositadamente omitidos.
LINHAS
1
2
3
4
B
C
H
Li
He
Be
?
?
?
?
F
?
a
a) Identifique os elementos químicos da quarta linha da figura apresentada.
h
b) Identifique o elemento químico de maior potencial de ionização dentre todos os da terceira
b
linha da figura apresentada.
p
Proposto
s5) (UFRJ) Um professor decidiu decorar seu laboratório com um “relógio de Química” no qual,
no lugar das horas, estivessem alguns elementos, dispostos de acordo com seus respectivos
números atômicos, como mostra a figura.
Na
Ne
Mg
F
H
He
Li
O
N
C
Be
B
Indique a hora que o relógio do professor marca quando:
a) O ponteiro dos minutos aponta para o elemento de menor número atômico e o ponteiro das
horas aponta para o elemento mais eletronegativo.
b) O ponteiro dos minutos aponta para o metal alcalino terroso de menor raio atômico e o
ponteiro das horas aponta para o gás nobre do segundo período.
Proposto
P
6) (UFRJ) As tintas são feitas com base na combinação de pigmentos inorgânicos, materiais7
formadores de película e solventes. A mistura de diferentes pigmentos é responsável pela
grande variedade de tons e cores existentes.
Na composição dos pigmentos, podemos encontrar diversos elementos químicos tais como
Pb, Fe, Al, Si, Hg, Cr e Ba.
a) Qual, dentre esses elementos, apresenta menor potencial de ionização?
b) Quais desses elementos são metais de transição?
a
b
c
d
Proposto
7) (UFF) Dão-se as configurações eletrônicas dos seguintes átomos neutros:
Elemento
Configuração eletrônica
A
1s2 2s2 2p6 3s2
B
1s2 2s2 2p6 3s1
C
1s2 2s2 2p6
D
1s2 2s2 2p5
E
1s2 2s2 2p3
Identifique nominalmente:
a) os elementos químicos simbolizados de A até E.
b) o de maior raio atômico.
c) o de maior potencial de ionização.
d) o gás nobre.
Proposto
8) (UNIRIO) Exames químicos realizados por arqueólogos e um médico-legista comprovaram
que o Rei Dom João VI, pai de Dom Pedro I, morreu envenenado com arsênio. As análises
das vísceras do monarca permitiram detectar uma quantidade de veneno quase quatro vezes
maior do que a necessária para matá-lo, ou seja, Dom João VI não morreu de complicações
digestivas como se pensava, ele foi assassinado.
(Adaptado da Revista Veja, 2000)
O arsênio, o chumbo e o mercúrio encabeçam a lista das substâncias mais tóxicas e venenosas para o organismo humano.
a) Dentre os elementos químicos citados, indique o que contém maior número de prótons.
b) De acordo com a tabela de classificação periódica, qual dos dois elementos químicos devem
apresentar maior raio atômico, mercúrio ou arsênio?
Proposto
9) (IME) Considerando os elementos químicos Be, B, F, Ca e Cs, classifique-os em ordem
crescente de acordo com as propriedades periódicas indicadas:
a) raio atômico;
b) primeira energia de ionização.
Proposto
10) (UFRJ) Vamos preencher as quatro primeiras quadrículas a seguir com símbolos de elementos químicos.
S
1
2
3
4
5
O elemento da quinta quadrícula é o enxofre. Os outros são:
Quadrícula 1:
O elemento de transição interna cuja configuração eletrônica é:[Rn] 5f2 6d1 7s2.
Quadrícula 2:
O metal alcalinoterroso com maior raio atômico.
Quadrícula 3:
O elemento do bloco s, do segundo período, com maior eletronegatividade.
Quadrícula 4:
O elemento do grupo 15 cujo estado físico de ocorrência natural é gasoso.
Preencha as quadrículas correspondentes em seu caderno de respostas.
Proposto
kJ x mol
-1
-11) (UERJ - Adaptada) O comportamento químico e físico dos elementos tem relação direta
com suas propriedades periódicas.
Observe, no gráfico, parte das energias de ionização de um elemento representativo do
terceiro período da tabela de classificação periódica:
80.000
70.000
60.000
50.000
40.000
30.000
20.000
10.000
1ª
2ª
3ª
4ª
5ª
6ª
7ª
8ª
9ª
10ª
11ª
12ª
13ª
14ª
energias de ionização
Nomeie o elemento que corresponde ao gráfico 1, justificando sua resposta.
Proposto
12) (UFF) Considere a tabela abaixo, onde estão apresentados valores de energia de ionização
(E.I.).
Elemento
Valores de E.I. em kJ x mol-1
1a E.I.
2a E.I.
11Na
491,5
4526,3
12Mg
731,6
1438,6
Responda:
a) Por que a 1a E.I. do Na é menor do que a 1a E.I. do Mg?
b) Por que a 2a E.I. do Na é maior do que a 2a E.I. do Mg?