Processos catalíticos mediados por enzimas que contém metais
Shriver e Atkins, cap 26
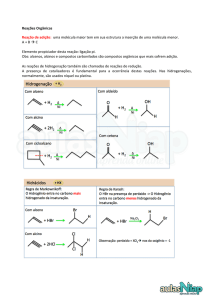
Catálise ácido-base
Pense: muitas reações catalisadas por ácidos ou bases requerem
concentrações de H+ ou de OH- da ordem de 0,1 mol/L, ou maiores.
Seria possível para as células empregar estes catalisadores
convencionais em suas reações?
Pense: se a catálise ácido-base convencional não é possível nos
sitemas biológicos, qual a outra alternativa para se acelerar uma
determinada reação?
Revendo energia de ativação
e as reações catalisadas
Ao diminuir a energia de
ativação, os catalisadores
permitem que a reação
ocorra com maior
facilidade (mais vezes
em um espaço de tempo
definido)
Enzimas que contém Zinco e a catálise ácido-base
Na maioria das enzimas que contém zinco (e apresentam
capacidade de catálise ácido-base), o Zn está na forma
Zn2+ e se coordena com 3 ligantes nitrogenados da
proteína (normalmente histidinas) e água
Pense: Porque o Zn2+ aparece
frequentemente em proteínas
na estrutura com 4 ligantes
(usualmente tetraédrico) e
não octaédrico como os íons
Fe2+ e Fe3+?
slide da aula 9 (dedos de Zn)
O metal Zn
Fe
1s2
2s2
3s2
4s2
>>
30 elétrons
2p6
3p6
4p0
3d10
No Zn2+ >> 3d10
4s0
Não há energia
de estabilização
pelo
desdobramento
de orbitais "d"
4 ligantes (tetraédrico) são melhor acomodados do que 6
(octaédrico) devido a ausência de estabilização de orbitais "d" e
menor repulsão elétron-elétron
Mecanismo de ação "Zn-hidróxido"
Neste caso, a molécula de água complexada com o íon Zn2+ tem
seu pka alterado em cerca de 3 unidades a menos
H2O
H+ + OHpKa = 7
HO
H+ + OHpKa 4
2 (coord.)
A alteração no pka da água significa, na prática, que ocorre a
formação de íon hidróxido no sítio ativo da enzima. O íon OH- é um
nucleófilo forte (base de Lewis eficiente para transferir elétrons),
ou seja, um bom doador de elétrons e pode atacar, por exemplo ,
grupos carbonílicos
H2O
H2O(coord.)
H+ + OHH+ + OH-
Mecanismo de ação "Zn-hidróxido"
pKa = 7
pKa 4
Exemplo: Anidrase carbônica - enzima presente nas células vermelhas
do sangue >>> fundamental para o transporte de CO2 (baixa
solubilidade) na forma de HCO3- (elevada solubilidade)
Em pH 7,0:
CO2 + H2O H2CO3 HCO3- + H+
ANIDRASE CARBÔNICA
CO2 + H2O H2CO3 HCO3- + H+
K = 10-3 s-1
K = 106 s-1
Sítio catalítico da
Anidrase carbônica
- enzima
fundamental para
o transporte de
CO2 na forma de
HCO3Note que há a
participação dos
ácidos glutâmico
e do triptofano
no sítio catalítico
CO2 se acopla ao sítio
catalítico e o Carbono recebe
a adição de OH-.
Posteriormente, o HCO3deixa o sítio catalítico sendo
substituído por água
Mecanismo de ação "Zn-carbonila"
Neste caso, a molécula de um substrato que contém um grupo
carbonila se liga ao sítio catalítico com o íon Zn2+ , tornando a
ligação C=O ainda mais polarizada e susceptível ao ataque de
um nucleófilo fraco, como a água, por exemplo
Exemplo: a enzima carboxipeptidase - uma protease, pois catalisa a
hidrólise de uma ligação peptídica (função amida)
+
Pense: Como seria a correspondente hidrólise de uma ligação
peptídica catalisada por ácidos e não por enzimas. Consulte um livro
de química orgânica se necessário. Faça um contraponto entre os
dois tipos de reação Hidrólise alcalina de proteínas 6 mol/L e 120oC:
Porque a reação só ocorrem em condições
severas
Fosfatase alcalina
- hidrólise de
ésteres orgânicos
de fosfato
(ex: ATP)
H2O
-CH2OH
+
HO-PO32-
Pense: porque o pH ótimo de ação desta fosfatase é na região
alcalina (normalmente acima de 7,5)
Álcool desidrohenase - Uma enzima
que oxida os álcoois a aldeídos, mas
depende da redução simultânea de
NAD+ à NADH (enzima comum no
fígado)
CH3CH2OH + NAD+ CH3CHO + NADH + H+
CH3CH2OH CH3CHO CH3COOH Acetyl-CoA
3H2O+2CO2
Em leveduras, a álcool
desidrogenase tem função de
catálise inversa >> crucial na síntese
de etanol durante a fermentação.
A enzima converte acetaldeído em
etanol, através da regeneração de
NAD+
Álcool desidrohenase - Mecanismo de ação: Oxi-redução na
molécula de NADH/NAD+
Álcool desidrohenase -Mecanismo de ação: No sítio catalítico
contendo Zn2+, o álcool se coordena com o Zn2+, e a molécula de
NAD se aproxima
HORSE LIVER ALCOHOL
DEHYDROGENASE COMPLEXED WITH
2,3,4,5,6-PENTA-FLUOROBENZYL
ALCOHOL AND NAD
Active site residues (His67,Cys174,Cys46)
shown as sticks (green);
Part of NAD shown as sticks (red);
Zn shown as sphere (magenta);
Atoms colored by atom type:
(carbon-gray/green/red, nitrogen-blue,
oxygen-firebrick, sulfur-orange, hydrogenwhite);
Zinc coordination shown as dashed lines
(yellow)
Mecanismo de ação: No sítio catalítico contendo Zn2+, antes do
acoplamento do álcool a água substitui um ácido glutâmico. Logo a
seguir o álcool se coordena com o Zn2+, e a molécula de NAD+ é
reduzida a NADH
Enzimas de Magnésio (Mg2+): Exemplo: Rubisco (Ribulose-1,5bisphosphate carboxylase/oxygenase) - a enzima mais abundante
na biosfera: catalisa a incorporação de CO2 em uma molécula de
ribulose-1,5-difosfato
Existe em todas as
plantas e é
fundamental na
fotossíntese
Consiste de 2
subunidades:
cadeia longa (L, 55 kDa) e
cadeia curta (S, 13 kDa)
As cadeias se unem em 8
(4 dímeros) com uma
massa molar aparente de
540 kDa
Mg2+ octaédrico na
rubisco
Parte orgânica da
molécula de ribulose1,3-difosfato
Substituição
de 2 águas
pelo enol e
migração
do proton
da lisina
Quebra da
ribulose
com uma
nova
ligação C-C,
(ribuloseCO2)
Adição de
água ao enol
e
CO2 à dupla,
que abre. O
intermediário
desloca outra
água
Próxima aula: Enzimas de Ferro - oxi-redução
Shriver e Atkins, e cap. 26