Química
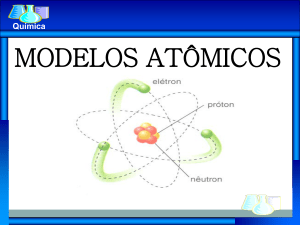
MODELOS
ATÔMICOS
Química
Modelo Grego
Leucipo e Demócrito (400 a.C)
A matéria é descontínua e formada por
partículas indivisíveis os átomos.
(A = não ; tomo = parte).
ÁTOMO = não + divisível
Química
Modelo Grego
Leucipo e Demócrito:
A matéria é constituída por partículas minúsculas e
indivisíveis
Átomo
Química
Aristóteles
Aristóteles rejeita o modelo de Demócrito
Aristóteles acreditava que a matéria
era contínua e composta por:
Ar
Terra
(384 a.C. - 322 a.C.)
Água
Fogo
Química
Modelo de Dalton
JOHN DALTON
“Bola de bilhar”
(1808)
Química
Modelo de Dalton
Baseado nas “Leis Ponderais” (1775 e 1799).
Esfera maciça;
Indivisível;
Indestrutível;
Sem carga elétrica;
“Bola de bilhar”
(1808)
John Dalton
Química
Modelo de Dalton
JOHN DALTON
1. Átomos com as mesmas características são do mesmo
elemento químico;
2. Átomos de um mesmo elemento químico têm o mesmo
tamanho e a mesma massa;
3. As substâncias simples são formadas por átomos iguais e as
substâncias compostas são formadas por átomos diferentes;
4. Nas reações químicas os átomos não são criados nem
destruídos, apenas se recombinam formando uma nova
substância;
Química
Descoberta do elétron
(Joseph John Thomson)
1897
Química
Ampola de Crookes
Química
Química
Química
Química
Química
Sendo os raios catódicos um fluxo de
elétrons, podemos concluir finalmente
que:
- os elétrons se propagam em linha reta
- os elétrons possuem massa
- os elétrons possuem carga elétrica de
natureza negativa.
Química
Modelo de Thomson
Thomson
“Pudim de passas”
(1898)
Química
Modelo deModelo
Thomson
de Thomson
Experiências com “Raios Catódicos” (1875).
Esfera maciça;
Divisível;
Indestrutível;
Com carga elétrica;
Esfera positiva
•“Pudim de passas”
(1898)
J.J.Thomson
Química
Radioatividade
Radioatividade
Química
Modelo de Rutherford
ERNEST RUTHERFORD
Química
Modelo de Rutherford
Experiência da “Lâmina de ouro” (1911)
Química
Modelo de
Rutherford
Modelo de Rutherford
Experiência da “Lâmina de ouro” (1911)
Química
Modelo deModelo
Rutherford
de Rutherford
Experiência da “Lâmina de ouro”
“Planetário”
(1911)
Núcleo e eletrosfera
Planetas em volta do sol
Núcleo pequeno e denso
Eletrosfera de 10.000 à 100.000 vezes
maior que o núcleo e vazia.
Ernest Rutherford
Química
Modelo de Rutherford
Rutherford
“ Planetário”
(1911)
Química
Modelo de Rutherford
- Bohr
Modelo
de Bohr
“Modelo com Níveis de energia” (1913)
K
L M
N
O
P Q
)))))))
Núcleo
Eletrosfera
)))
Niels Bohr
Efeito Fotoelétrico
Fóton
Química
Modelo de Bohr
Postulados de Bohr
1. Os elétrons, movimentam-se ao redor do núcleo em trajetórias
circulares, chamadas de camadas, níveis ou órbitas circulares.
2. Cada uma dessas órbitas possui um valor determinado de energia.
3. Não é permitido a um elétron permanecer entre duas camadas.
4. Um elétron pode passar de uma camada de menor energia para
outra de maior energia, desde que absorva energia externa (salto
quântico), dizemos que o elétron foi excitado.
5. O retorno do elétron ao nível inicial se faz acompanhar da liberação
de energia na forma de ondas eletromagnéticas.
Química
Modelo de Bohr
Niels Bohr
Química
Modelo de Bohr
Salto Quântico
1s2 2s2 2p6
1s2 2s2 2p5 3s1
Química
Modelo de Bohr
Espectro completo das ondas
Química
Salto Quântico