L.E.
Semana 1 – Segunda Feira
Modelos Atômicos II
- A evolução científica e os modelos atômicos
Experiência de Rutherford
Bombardeamento de uma lâmina de ouro com partículas alfa.
Pb
Po
ZnS
Au
Experiência de Rutherford (Conclusões)
Uma pequena parte das
partículas
alfa
não
atravessa a lâmina de
ouro.
Algumas partículas alfa
sofrem
desvios
ao
atravessarem a lâmina de
ouro.
A maioria das partículas
alfa atravessam livremente
a lâmina de ouro.
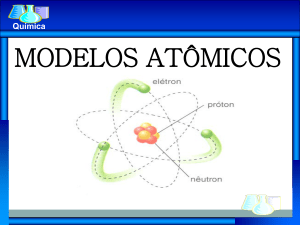
Modelo de Rutherford - 1911
Eletrosfera
Região periférica onde os
elétrons giram como planetas
ao redor do sol.
Núcleo
Rutherford
Modelo Planetário
Região central positivamente
carregada e de tamanho
desprezível,
onde está
concentrada praticamente toda
a massa do átomo.
Modelo de Rutherford – Considerações importantes
Eletrosfera
• Cerca de 10.000 a 100.000
vezes maior que o núcleo.
• A eletrosfera é comparada
com um grande espaço vazio.
Núcleo
• Primeiro modelo nucleado.
• Possui
uma
densidade
incompatível com nossos
padrões cotidianos.
• Núcleo (p.p.p.)
Modelo de Bohr - 1913
Energia
O físico dinamarquês Niels Bohr modificou o
modelo de Rutherford elaborando um novo
modelo atômico, baseado em observações
experimentais, cujos postulados são:
Postulados de Bohr
1º Postulado:
“Os elétrons se movem, ao redor de um átomo, somente em certas órbitas
circulares, com quantidades fixas de energia.”. (órbitas estacionárias )
2º Postulado:
“As órbitas são chamadas camadas eletrônicas, representadas pelas letras K, L,
M, N, O, P e Q a partir do núcleo, ou níveis de energia representados pelos
números 1, 2, 3, 4, 5, 6, 7 ...”
Postulados de Bohr
3º Postulado:
“ Os elétrons ao se movimentarem numa camada eletrônica não absorvem nem
emitem energia.”
4º Postulado:
“É emitida radiação eletromagnética se um elétron, que se move inicialmente
sobre uma órbita de energia total Ei , muda seu movimento descontinuamente de
forma a se mover em uma órbita de energia total Ef. A freqüência da radiação
emitida é igual à quantidade (Ei – Ef ) dividida pela constante de Planck h, ou
𝐸𝑖 −𝐸𝑓
seja: 𝑓 = ℎ ”.
Energia recebida
E2-E1
Energia
Energia liberada
Núcleo
e
E2-E1
Energia Crescente
Ondas eletromagnéticas em um espectro descontínuo
Modelo de Bohr
Modelo Rutherford - Bohr
Aplicações práticas
Fogos de artifício
Teste de chama
Exercício 1
Observações experimentais podem contribuir para a formulação ou adoção de um modelo
teórico, se este as prevê ou as explica. Por outro lado, observações experimentais imprevistas
ou inexplicáveis por um modelo teórico podem contribuir para sua rejeição.
Em todas as alternativas, a associação observação – modelo atômico está correta, exceto em:
Observação experimental
Implicação em termos de
modelo atômico
a)
Conservação da massa em reações químicas.
Adoção do modelo de Dalton.
b)
Proporções entre massas de reagentes e produtos.
Adoção do modelo de Dalton.
c)
Espectros atômicos descontínuos.
Adoção do modelo de Rutherford.
d)
Trajetórias de partículas alfa que colidem com uma lâmina
metálica.
Adoção do modelo de Rutherford.
e)
Emissão de elétrons em tubos de raios catódicos.
Rejeição do modelo de Dalton.