Escola estadual braz sinigáglia
Evolução dos modelos atômicos
Nome:Kenedy,Guilherme mota
Jhon Dalton
• Dalton afirmava que o atomo era a particula
elementar, a menor das particulas que
constituiam a matéria. John Dalton apresentou
seu modelo atômico em 1808.Ele comparava o
atomo com uma minuscula esfera
maciça,impenetravel,indestrutivel,indivisivel e
sem carga.Todos os átomos de um mesmo
elemento químico são idênticos.
• Este modelo atômico ficou conhecido
como"Modelo Da Bola De Bilhar".
Thomson
• Thomson foi um físico inglês que ao
pesquisar os raios catódicos demonstrou
que estes podem ser interpretados como um
feixe de partículas de carga negativa.E então
os deu o nome de elétrons.
• Após varias experiências utilizando campos
magnéticos e elétricos(Ampola De Cocker),
Thomson, determinou a relação entre carga e
massa do elétron.
• Assim Thomson conclui que os elétrons
deveriam ser constituintes de todos os tipos
de matéria.
Rutherford
• Rutherford baseia seu modelo atômico na
experiência realizada junto com seus
colaboradores.Onde uma lamina de ouro,
muito fina , foi bombardeada por partículas
alfa(que eram positivas) Assim, ele observou
que para cada 10.000 partículas que incidiam
na lamina, aproximadamente uma era
desviada, refletida ou algo do gênero.
• Com isso, puderam concluir que o raio do
átomo era 10.000 vezes maior que o do
núcleo.
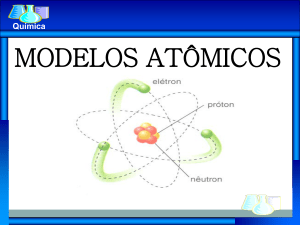
Bohr
• Niels Bohr, físico dinamarquês conseguiu corrigir
esses equívocos tendo como base a seguinte idéia:
• Um elétron adquire somente determinadas
energias.E cada energia tem sua órbita particular,
portanto quando um elétron ganha energia ele pula
de órbita e vai se afastando cada vez mais do
núcleo.E quando este elétron perde energia ele pula
de órbita se aproximando do núcleo.Não podendo
então ficar entre duas órbitas definidas.
• Assim pode-se concluir que quanto maior é a
energia do elétron, mais afastado do núcleo ele deve
estar.
Rutherford e bohr
• Bohr, baseando-se nos estudos feitos em relação ao espectro do
átomo de hidrogênio e na teoria proposta em 1900 por Planck
(Teoria Quântica), segundo a qual a energia não é emitida em forma
contínua, mas em ”blocos”, denominados quanta de energia, propôs
os seguintes postulados:
• 1. Os elétrons nos átomos descrevem sempre órbitas circulares ao
redor do núcleo, chamadas de camadas ou níveis de energia.
• 2. Cada um desses níveis possui um valor determinado de energia
(estados estacionários).
• 3. Os elétrons só podem ocupar os níveis que tenham uma
determinada quantidade de energia.
• 4. Os elétrons podem saltar de um nível para outro mais externo,
desde que absorvam uma quantidade bem definida de energia
(quantum de energia).