MEDICAMENTOS NOVOS E
ESTUDOS DE BIODISPONIBILIDADE
RELATIVA
Camila Fracalossi Rediguieri
UABBE/GGMED/ANVISA
Biodisponibilidade indica a velocidade e a
extensão em que uma substância é liberada de
sua forma farmacêutica e absorvida, tornando-se
disponível na circulação sistêmica.
Biodisponibilidade absoluta é a medida que compara a
biodisponibilidade de um fármaco administrado por via
extravascular com o mesmo fármaco administrado pela
via intravenosa.
100 %
X
Biodisponibilidade relativa é a medida que compara a
biodisponibilidade de um fármaco contido em dois
medicamentos distintos administrados por uma via
extravascular.
X
A Biodisponibilidade Relativa é determinada por meio
de Estudos Farmacocinéticos.
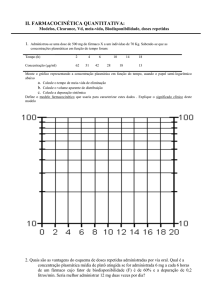
C o n c e n t ra ç ã o p la s m á tic a (n g /m L )
250
AUC
200
Referência
150
Cmax
Teste
100
50
0
0
5
10
15
Tempo (horas)
20
25
RDC 136/2003
“ f)...
1. ...
2. Os resultados dos estudos de Fase II e III para as empresas
que descobrirem uma nova concentração, e/ou forma
farmacêutica, e/ou via de administração no País para a
mesma indicação terapêutica para um fármaco registrado por
uma outra empresa. Estes estudos estão dispensados, sendo
substituídos pela prova de biodisponibilidade relativa
quando estiverem dentro da faixa terapêutica já aprovada; ”
RDC 210/2004
“ II - DO REGISTRO
2...
e) No caso de medicamentos que consistam em:
- combinações de princípios ativos diferentes em uma mesma
forma farmacêutica, doravante denominados combinações em
dose fixa;
- duas ou mais apresentações em uma mesma embalagem,
para uso concomitante ou seqüencial;
além dos demais itens o proponente deve apresentar justificativa de
sua racionalidade e, quando aplicável, o resultado dos seguintes
estudos:
biodisponibilidade relativa entre a combinação em dose fixa
e cada princípio ativo isolado que a componha;
ensaios clínicos controlados para cada indicação terapêutica, ...”
Desenho do estudo
Para uma nova concentração, e/ou forma
farmacêutica, e/ou via de administração:
Randomizado, realizado em dois períodos e cruzado
Voluntário Período 1 Período 2
x
A
B
y
B
A
Desenho do estudo
Para uma nova associação:
?
Food and Drug Administration (FDA)
Guidance for Industry – Fixed Dose Combinations, CoPackaged Drug Products, and Single-Entity Versions of
Previously Approved Antiretrovirals for the Treatment of HIV
“ VI. Farmacologia clínica
Para aprovação de uma nova Combinação em Dose Fixa, é
importante determinar que a velocidade e a extensão da
absorção de cada princípio ativo na combinação são iguais
às dos princípios ativos isolados administrados
concomitantemente.”
European Medicines Agency (EMEA)
Note for Guidance on the Investigation of Bioavailability and
Bioequivalence
“ 5.1.5. Combinação em dose fixa
Deve-se avaliar a biodisponibilidade relativa a cada princípio
ativo administrado isoladamente (no caso de uma nova
combinação) ou a uma combinação já existente. No caso de
nova combinação, o estudo deverá ser conduzido de modo a
permitir a detecção de interações farmacocinéticas.”
World Health Organization (WHO)
Guidelines for registration of fixed-dose combination medicinal
products
(WHO Technical Report Series, Nº 929, 2005, Annex 5)
Classifica as Combinações em Dose Fixa em 4 cenários.
Cenário 1: A nova combinação contém os mesmos ativos nas
mesmas dosagens de uma combinação já existente.
Trata-se de um genérico.
World Health Organization (WHO)
Cenário 2: A nova combinação contém os mesmos ativos nas
mesmas dosagens de um regime estabelecido com monodrogas.
Os perfis de segurança e eficácia estão bem caracterizados e as
interações farmacocinéticas são conhecidas.
Cenário 3: A nova combinação contém ativos com segurança
e eficácia estabelecidas mas que nunca foram associados. As
interações farmacocinéticas não são conhecidas.
Cenário 4: A nova combinação contém uma ou mais moléculas
novas.
World Health Organization (WHO)
Cenário 1
Cenário 2
Cenário 3 Cenário 4
√
√
Às vezes
Às vezes
Estudos pré-clínicos
Não
Não
Às vezes
√
Estudos clínicos
Não
Não
√
√
Estudo de BDR
Desenho do estudo
Combinação em dose fixa
Cenário 1
(produto genérico)
Cenário 2
(interação conhecida)
Cenários 3 e 4
(interação desconhecida)
Regime 1
Regime 2
AB
AB
AB
Regime 3
B
A
AB
A
AB
AB
B
ou
Desenho do estudo
Kits
Regime 1
Cenário 1
(produto genérico)
Cenário 2
(interação conhecida)
Cenários 3 e 4
(interação desconhecida)
Regime 2
A
B
A
B
A
B
A
B
A
B
A
B
A
A
Regime 3
B
B
ou
Exemplos
Cenário 2 : ATRIPLA®
EFV, Efavirenz; FTC, Emtricitabina; TDF, Tenofovir
Exemplos
Cenário 2 : AVANDAMET®
Exemplos
Cenário 2 : AVANDAMET®
Exemplos
Cenário 3 : CADUET®
Exemplos
Cenário 3 : CADUET®
Estudos de BDR para registro de
medicamentos novos (2004 a 2007*)
Cenário 3
2
Novas associações
Nova concentração/
forma farmacêutica/
via administração
8
Cenário 2
* Dados de janeiro a maio
18
Estudos em jejum ou alimentação?
Estudo
BDR em
jejum
Jejum
Bula
Modo
de uso:
Adm.
Consistente
Não
Após as
refeições
Não
Estudo
BDR em
jejum
Farmacocinética
influenciada por
alimentos?
Sim
Farmacocinética
influenciada por
alimentos?
Estudo
BDR em
jejum
Estudo
BDR com
alimentação
Sim
Estudo BDR
em jejum e
alimentação
Lista 1 - Forma de
Administração,
Resolução – RE
nº397, de 12 de
novembro de 2004
Racionalidade de uma nova associação
• Maior eficácia
• Menos efeitos adversos
• Simplificação do regime terapêutico
• Menor custo
• Melhor adesão do paciente ao tratamento
Missão da Agência
Proteger e promover a saúde da
população garantindo a segurança sanitária
de produtos e serviços e participando da
construção de seu acesso
OBRIGADA
Camila Fracalossi Rediguieri
UABBE/GGMED/ANVISA
[email protected]