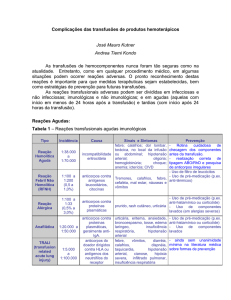
Consenso de Refratariedade Plaquetária
Mônica Veríssimo – Centro Infantil Boldrini
Definição
Refratariedade plaquetária (RP) é definida como o aumento (incremento) plaquetário
inadequado após a transfusão, em pelo menos duas transfusões, preferencialmente
consecutivas, com plaquetas recentes (≤48 horas) ABO compatíveis. O incremento
inadequado deve ser definido por critério mensurado sendo o CCI (corrected count
increment - contagem do incremento corrigida) o cálculo adotado para essa definição,
que é o mais amplamente utilizado na literatura.
O cálculo do CCI é realizado com base na fórmula:
CCI = IP x SC x 1011
n
onde:
IP = incremento na contagem de plaquetas (x 10 9/L) (contagem pós-transfusional –
contagem pré-transfusional)
SC = superfície corpórea (m2)
n = número de plaquetas transfundidas (x 10 11/L) (contagem do “pool” ou da unidade
de plaquetaférese x volume do componente)
Exemplo:
Paciente com 1,8 m2 de SC, apresentando contagem de plaquetas inicial de 5 x 10 9/L,
recebe uma transfusão de 4 x 10 11/L plaquetas, apresenta contagem de plaquetas
pós-transfusional de 30 x 109/L.
CCI = 25 x 1,8 = 11,25 plaquetas/L
4
A refratariedade plaquetária é definida por CCI-1 (contagem pós-transfusional de 1
hora - colhida entre 15 minutos e 1 hora após o término da transfusão) menor que
5000 plaquetas por mL (5,0 plt/L) ou CCI-24 contagem pós-transfusional de 24 horas colhida entre 18 e 24 horas após o término da transfusão) menor que 2500 plaquetas
por mL (2,5 plt/L).
CCI-1 ≥ 5000
CCI-24 ≥ 2500
NÃO REFRATÁRIO
A necessidade de dois resultados consecutivos se justifica pela grande quantidade de
fatores clínicos ou farmacológicos capazes de causar um incremento plaquetário
insatisfatório.
Classificação
Muitos fatores podem interferir no incremento plaquetário adequado após a transfusão
e podem ser assim divididos:
Tabela 1. Fatores envolvidos no resultado da transfusão plaquetária
Qualidade da plaqueta
Causas imunológicas
Causas não imunológica
Quantidade transfundida
Anticorpos HLA classe I
Febre/Infecção
No. Leucócitos
Anticorpos HPA
CIVD
Tempo de armazenamento
Anticorpos ABO
TMO
Tipo
Imunocomplexos
Esplenomegalia
de
bolsa
para
armazenamento
Temperatura
de
armazenamento
Anticorpos relacionados a
drogas
Autoanticorpos
Adaptado de Novotny (1999)
Os fatores não imunes são os responsáveis pela grande maioria (≈80%) dos casos de
Refratariedade Plaquetária (RP).
Os fatores aloimunes respondem por menos de 20% das RP e são relacionados ao
desenvolvimento de anticorpos que reagem contra as plaquetas do doador, reduzindo
sua função e sobrevida in vivo.
O uso repetido de plaquetas alogênicas resulta frequentemente, no aparecimento de
anticorpos direcionados ao antígeno leucocitário humano (HLA) classe I em pacientes
politransfundidos, variando de incidência conforme a condição de base do paciente, o
tipo de componente transfundido e a exposição prévia a antígenos HLA por transfusão
ou gravidez. Em pacientes não imunossuprimidos transfundidos com componentes
não leucodepletados, esses anticorpos (Ac-HLA) podem ser detectados em
aproximadamente 80 a 100% dos casos, enquanto em pacientes recebendo terapia
imunossupressora, sua ocorrência é de 40 a 70% dos casos. É importante ressaltar
que a presença de anticorpos anti-HLA não implica necessariamente em
Refratariedade Plaquetária (somente em torno de 30% dos Ac-HLA são
considerados “patogênicos”).
Em cerca de 10 a 20% dos casos de refratariedade plaquetária, os anticorpos são
direcionados contra os antígenos plaquetários humanos (HPAs), associados ou não a
anticorpos anti-HLA.
Os anticorpos anti-ABO podem desempenhar um papel importante na RP. Este fator
pode, no entanto, ser contornado pelo uso de plaquetas ABO - compatíveis.
Apesar de sua menor prevalência, o estudo e manejo dos fatores imunes são
fundamentais pela possibilidade de prevenção de formação de aloanticorpos e seleção
de plaquetas compatíveis para receptores aloimunizados. Dentre as medidas para a
prevenção e suporte à aloimunização estão a leucorredução e o uso de plaquetas
HLA/HPA compatíveis.
É importante salientar que o diagnóstico de RP em um determinado momento não
implica em RP em todos os ciclos do tratamento, sendo necessária sua confirmação
em caso de novas suspeitas no mesmo paciente em momentos distintos.
É importante salientar que em casos de suspeita
Refratariedade plaquetária é contra-indicado
ou com confirmação de
a transfusão profilática de
plaquetas.
Fatores não imunes devem ser afastados, sempre que possível para tentar melhorar o
rendimento transfusional. Por exemplo, tratar os processos infecciosos, controlar
CIVD, suspensão ou troca de medicamentos, etc...
Manejo da Refratariedade Plaquetária
Os componentes de painel compatível e crossmatch (“prova cruzada”) serão colhidos
por aférese. O método para realização do crossmatch será o PIFT (avalia anticorpos
anti-plaquetários e anti-HLA classe I) e o crossmatch-HLA. Somente devem ser
liberados para transfusão os componentes com ambos os testes com resultados
negativos!
A utilização de plaquetas com compatibilidade HLA parcial (match parcial) é
frequentemente necessária, dado o grande polimorfismo HLA particularmente em
populações com grande miscigenação, como a brasileira.
É importante salientar que quando há compatibilidade parcial e trata-se de doadora
com história de gestação ou doador/a com histórico transfusional, é realizada na
primeira doação de painel a prova de reatividade (PRA-HLA), a fim de se avaliar a
possibilidade de reatividade do anticorpo contra o antígeno não compatível do
receptor. Havendo essa reatividade, o componente proveniente desta doação não
deverá ser utilizado, pelo risco de TRALI (lesão pulmonar aguda associada a
transfusão).
A amostra de soro do paciente para realização da compatibilidade deve ser de no
máximo 7 dias antes do teste (Checar a necessidade de nova amostra sempre).
É importante a realização do CCI após a transfusão do componente com
compatibilidade negativa para avaliar o impacto dos fatores não imunes da
Refratariedade Plaquetária (quando há baixo rendimento com componentes
compatíveis).
Caso o uso de componentes compatíveis continue resultando em baixo
rendimento (causas não imunes de RP, que não puderam ser corrigidas) e haja
sinais de sangramento maior (risco de vida do paciente), deverá ser realizada
transfusão de plaquetas com maior frequência (10mL/kg em intervalos de tempo
menores, variando de 12/12h a 4/4h horas, enquanto persistirem sinais de
sangramento maior)
Bibliografia
Leukocyte reduction and ultraviolet B irradiation of platelets to prevent alloimmunization
and refractoriness to platelet transfusions. The Trial to Reduce Alloimmunization to
Platelets Study Group. N Engl J Med 1997; 337(26):1861-1869.
Detection of platelet-reactive antibodies in patients who are refractory to platelet
transfusions, and the selection of compatible donors. Vox Sang 2003 ;84(1):73-88.
Guidelines for the use of platelet transfusions. Br J Haematol 2003; 122(1):10-23.
Davis KB, Slichter SJ, et al. (1999). Corrected count increment and percent platelet
recovery as measures of posttransfusion platelet response: problems and a solution.
Transfusion 39(6):586-92.
Duquesnoy
RJ
(2008).
Structural
epitope
matching
for
HLA-alloimmunized
thrombocytopenic patients: a new strategy to provide more effective platelet transfusion
support? Transfusion 48(2):221-227.
Duquesnoy R J (2011). Antibody-reactive epitope determination with HLAMatchmaker
and its clinical applications. Tissue Antigens 77(6):525-534.
Engelfriet CP, Reesink WH et al. (1997). Management of alloimmunized, refractory
patients in need of platelet transfusions. Vox Sang 73(3):191-8.
Heal JM and Blumberg N (2004). Optimizing platelet transfusion therapy. Blood Rev
18(3):149-65.
Hod E and Schwartz J (2008). Platelet transfusion refractoriness. Br J Haematol
142(3):348-360.
Jimenez TM, Patel SB, et al. (2003). Factors that influence platelet recovery after
transfusion: resolving donor quality from ABO compatibility. Transfusion 43(3):328-34.
Metcalfe P (2004). Platelet antigens and antibody detection. Vox Sang 87 Suppl1:82-6.
Metcalfe P, Watkins NA, et al. (2003). Nomenclature of human platelet antigens. Vox
Sang 85(3):240-245.
Novotny VM (1995). Platelet transfusion refractoriness--prevention and therapeutical
approaches. Transfus Clin Biol 2(1):47-9.
Novotny VM (1999). Prevention and management of platelet transfusion refractoriness.
Vox Sang 76(1):1-13.
Novotny VM, van Doorn R, et al. (1995). Occurrence of allogeneic HLA and non-HLA
antibodies after transfusion of prestorage filtered platelets and red blood cells: a
prospective study. Blood 85(7):1736-41.
Pai SC, Lo SC, et al. (2010). Epitope-based matching for HLA-alloimmunized platelet
refractoriness in patients with hematologic diseases. Transfusion 50(11):2318-2327.
Pappalardo PA, Secord AR, et al. (2001). Platelet transfusion refractoriness associated
with HPA-1a (Pl(A1)) alloantibody without coexistent HLA antibodies successfully
treated with antigen-negative platelet transfusions. Transfusion 41(8):984-7.
Pavenski K, Freedman J, et al. (2012). HLA alloimmunization against platelet
transfusions: pathophysiology, significance, prevention and management. Tissue
Antigens 79(4):237-245.
Petz LD, Garratty G, et al. (2000). Selecting donors of platelets for refractory patients
on the basis of HLA antibody specificity. Transfusion 40(12):1446-56.
Phekoo KJ, Hambley H, et al. (1997). Audit of practice in platelet refractoriness. Vox
Sang 73(2):81-6.
Rebulla P (2002). Refractoriness to platelet transfusion. Curr Opin Hematol 9(6):51620.
Rebulla P (2005). A mini-review on platelet refractoriness. Haematologica 90(2):24753.
Rozman P (2002). Platelet antigens. The role of human platelet alloantigens (HPA) in
blood transfusion and transplantation. Transpl Immunol 10(2-3):165-81.
Sanz C, Freire C, et al. (2001). Platelet-specific antibodies in HLA-immunized patients
receiving chronic platelet support. Transfusion 41(6):762-5.
Sintnicolaas
K
and
Lowenberg
B
(1996).
A
flow
cytometric
platelet
immunofluorescence crossmatch for predicting successful HLA matched platelet
transfusions. Br J Haematol 92(4):1005-10.
Slichter SJ, Fish D, et al. (2005). Evaluation of different methods of leukoreduction of
donor platelets to prevent alloimmune platelet refractoriness and induce tolerance in a
canine transfusion model. Blood 105(2):847-54.
Slichter SJ, Davis K, et al. (2005). Factors affecting posttransfusion platelet increments,
platelet refractoriness, and platelet transfusion intervals in thrombocytopenic patients.
Blood 105(10):4106-14.
Vassallo RR (2009). Recognition and management of antibodies to human platelet
antigens in platelet transfusion-refractory patients. Immunohematology 25(3):119-124.
Marwaha N, Sharma RR (2009). Consensus and controversies in platelet transfusion.
Transfus Apher Sci 41:127–133
Pavenski K, Rebulla P, Duquesnoy R, Saw CL, Slichter SJ, Tanael S, Shehata N
(2013) .International Collaboration for Guideline Development, Implementation and
Evaluation for Transfusion Therapies (ICTMG) Collaborators. Efficacy ofHLA-matched
platelet transfusions for patients with hypoproliferative thrombocytopenia: a systematic
review. Transfusion. Apr 3. [Epub ahead of print]
Heikal NM, Smock KJ.(2013) Laboratory testing for platelet antibodies. Am J
Hematol.;88(9):818-21. Epub 2013 Jul
Wiita AP, Nambiar A. (2012) Longitudinal management with crossmatch-compatible
platelets for refractory patients: alloimmunization, response to transfusion, and clinical
outcomes (CME). Transfusion:52(10):2146-54.
Rioux-Massé B, McCullough J (2011). The role of the pretransfusion platelet count in
platelet refractoriness. Transfusion. Oct;51(10):2258-9.