Química Analítica Qualitativa Experimental - QMC 1006 - Profa Mara Braibante
QUÍMICA LICENCIATURA
UNIDADE 2- ANÁLISE DE CÁTIONS
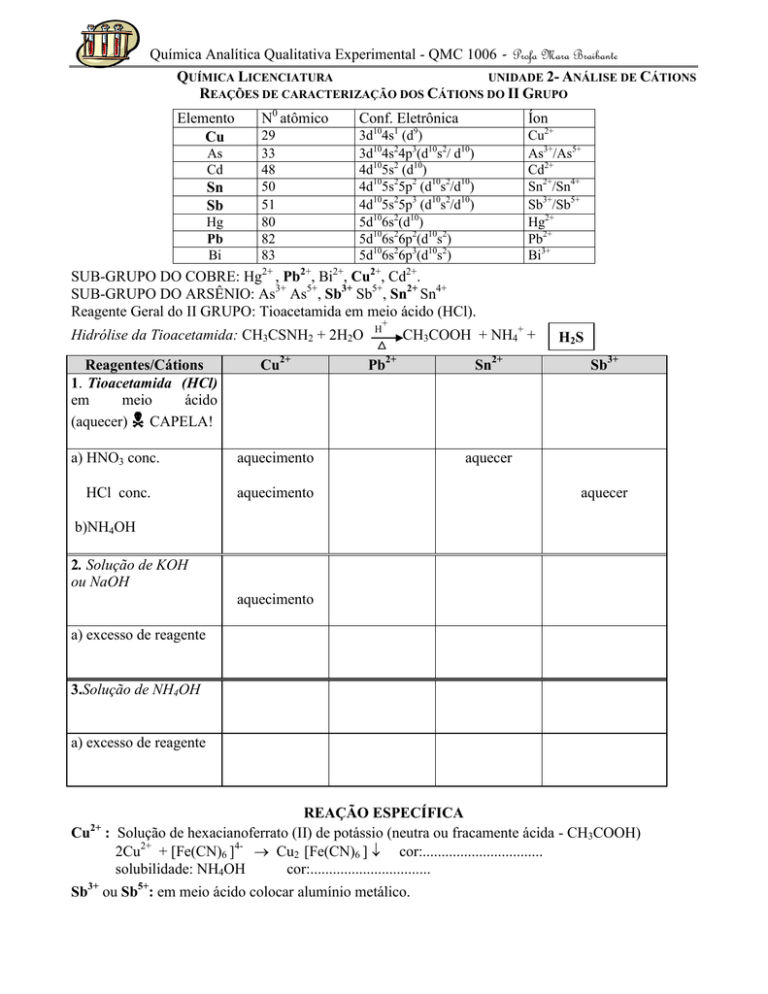
REAÇÕES DE CARACTERIZAÇÃO DOS CÁTIONS DO II GRUPO
Elemento
Cu
As
Cd
Sn
Sb
Hg
Pb
Bi
N0 atômico
Conf. Eletrônica
Íon
29
33
48
50
51
80
82
83
3d104s1 (d9)
3d104s24p3(d10s2/ d10)
4d105s2 (d10)
4d105s25p2 (d10s2/d10)
4d105s25p3 (d10s2/d10)
5d106s2(d10)
5d106s26p2(d10s2)
5d106s26p3(d10s2)
Cu2+
As3+/As5+
Cd2+
Sn2+/Sn4+
Sb3+/Sb5+
Hg2+
Pb2+
Bi3+
SUB-GRUPO DO COBRE: Hg2+ , Pb2+, Bi2+, Cu2+, Cd2+.
SUB-GRUPO DO ARSÊNIO: As3+ As5+, Sb3+ Sb5+, Sn2+ Sn4+
Reagente Geral do II GRUPO: Tioacetamida em meio ácido (HCl).
Hidrólise da Tioacetamida: CH3CSNH2 + 2H2O
Reagentes/Cátions
1. Tioacetamida (HCl)
em
meio
ácido
(aquecer) CAPELA!
Cu2+
a) HNO3 conc.
aquecimento
HCl conc.
aquecimento
+
H
CH3COOH + NH4+ +
Pb2+
Sn2+
H2 S
Sb3+
aquecer
aquecer
b)NH4OH
2. Solução de KOH
ou NaOH
aquecimento
a) excesso de reagente
3.Solução de NH4OH
a) excesso de reagente
REAÇÃO ESPECÍFICA
Cu2+ : Solução de hexacianoferrato (II) de potássio (neutra ou fracamente ácida - CH3COOH)
2Cu2+ + [Fe(CN)6 ]4- Cu2 [Fe(CN)6 ] cor:................................
solubilidade: NH4OH
cor:................................
Sb3+ ou Sb5+: em meio ácido colocar alumínio metálico.