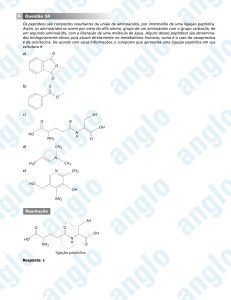
REAÇÕES ORGÂNICAS CLÁSSICAS
PROF: Jorge Roberto
01) ALCANOS
REAÇÃO TÍPICA: Substituição radicalar
Ordem de reatividade dos hidrogênios:H(CH4) < HPRIMÁRIO < HSECUNDÁRIO < HTERCIÁRIO
Ex.
CH4 + Cl2 luz/calor CH3Cl + HCl
02) ALCENOS
REAÇÃO TÍPICA: Adição eletrofílica
MECANISMO: iônico (regra de Markownikov)
ESTEREOQUÍMICA: antiestérea
Ex.
Cl
HCL
EXCEÇÃO:EFEITO KHARASCH PROVOCADO POR PERÓXIDOS(MECANISMO DE ADIÇÃO RADICALAR)
HBr
peróxidos
Br
3)ALCINOS
REAÇÃO TÍPICA:ADIÇÃO ELETROFÍLICA
HC
CH
2
H/Hg
H2O
O
H3C
C
H
EXCEÇÃO:ADIÇÃO NUCLEOFÍLICA DE HCN EM MEIO ÁCIDO
ALCINOS VERDADEIROS TÊM LEVE CÁRATER ÁCIDO
CH3
C
Na
CH
CH3
C
CNa
4)DIENOS
REAÇÃO TÍPICA:ADIÇÃO ELETROFÍLICA DO TIPO 1,4(DIENOS CONJUGADOS)
A REAÇÃO MAIS IMPORTANTE DESSE GRUPO É A DE DIELS-ALDER
O
O
H
H
5) CICLANOS
REATIVIDADE DEPENDE DO TAMANHO DO CICLO.
;
ANÉIS PEQUENOS(
) REAÇÕES DE ADIÇÃO COM RUPTURA DO CICLO
ANÉIS MAIORES:REAÇÕES DE SUBSTITUIÇÃO
I
HI
Br
Br2
HBr
;
6)AROMÁTICOS
REAÇÃO TÍPICA :SUBSTITUIÇÃO ELETROFÍLICA AFETADA POR GRUPOS PRESENTES NO NÚCLEO
OH
OH
OH
CH3
CH3Br AlCl3
HBr
CH3
NO 2
NO 2
SO 3
H
SO 3H
7)HALETOS
REAÇÃO TÍPICA:SUBSTITUIÇÃO NUCLEOFÍLICA QUE PODE SER SN1 OU SN2 DEPENDENDO DO HALETO.
HALETOS PRIMÁRIOS E METÍLICOS:SN2 COM INVERSÃO DE CONFIGURAÇÃO(INVERSÃO DE WALDEN)
HALETOS TERCIÁRIOS E SECUNDÁRIOS:SN1
Cl
CN
CN
CH3Br + OH
Cl (SN )
1
CH3OH + Br (SN2)
8) ÉTERES
REAÇÃO TÍPICA:BASES DE LEWIS
H
CH
3
O
HCl
frio
CH3
O
Cl
Cl
CH
3
O
HCl
calor
CH3OH
OBS:OS EPÓXIDOS SÃO ÉTERES MUITO REATIVOS DEVIDO Á TENSÃO ANGULAR.
O
CH3MgCl
H/H2O
OH
Mg(OH)Cl
9)FENÓIS
REAÇÃO TÍPICA:CARÁTER ÁCIDO
OH
NaOH
ONa + H2O
REAÇÃO DE SUBSTITUIÇÃO ELETRÓFILA AROMÁTICA É FÁCIL, PORQUE A HIDROXILA É GRUPO ATIVANTE DO NÚCLEO
BENZÊNICO.
REAÇÃO DE SUBSTITUIÇÃO NUCLEOFÍLICA OCORRE COM SOCl2,PCl3 OU COM PCl5
OH
Cl
SOCl2
+ HCl + SO 2
10) ÁLCOOIS
REAÇÃO TÍPICA:SÃO ANFÓTEROS
[H]
(CH3)3OH + Na
(CH3)3CONa
CARÁTER ÁCIDO:
.ORDEM DE REATIVIDADE:METANOL>ÁLCOOL 1º>ÁLCOOL 2º>ÁLCOOL 3º
(CH3)3OH + HCl ZnCl2 (CH3)3Cl + H2O
CARÁTER BÁSICO:
ORDEM DE REATIVIDADE:METANOL<ÁLCOOL 1º<ÁLCOOL 2º<ÁLCOOL 3º
REAÇÃO DE DESIDRATAÇÃO:
ORDEM DE REATIVIDADE:ÁLCOOL 1º<ÁLCOOL 2º<ÁLCOOL 3º
INTRAMOLECULAR PRODUZ ALCENO DE ACORDO COM A REGRA DE SAYTZEV
OH
H SO
H 170°C
2
H
4
(principal)
INTERMOLECULAR GERA ÉTER
2(CH3CH2OH)
H2SO4
CH3CH2OCH2CH3
140°C
OBS:AS REAÇÕES DE ELIMINAÇÃO TEM ESTEREOQUÍMICA ANTI
REAÇÕES DE OXIDAÇÃO
ÁLCOOL 1º + [O]
ÁLCOOL 2º + [O]
ÁLCOOL 3º + [O]
ALDEÍDO + [O]
CETONA
NÃO HÁ REAÇÃO
ÁCIDO CARBOXÍLICO
REAÇÃO DE BERTHELOT(REDUÇÃO)
CH3CH2OH + HI(concentrado) calor
CH3CH3
I2 + H2O
11)COMPOSTOS CARBONILADOS(ALDEÍDOS E CETONAS)
REAÇÃO TÍPICA:ADIÇÃO NUCLEOFÍLICA
O
HCN
H ou
OH
OH
CN
FATORES ESTÉRICOS E ELETRÔNICOS EXPLICAM A MAIOR REATIVIDADE DOS ALDEÍDOS EM RELAÇÃO ÀS CETONAS.
REAÇÕES DE Hα
I)TAUTOMERIA
O
O
CH2
C
CH2
H
H
H
C
H
II)CONDENSAÇÃO ALDÓLICA
O
CH2
OH
O
C
C
H
H
CH3
CH3
O
CH2
C
H
C
H
H
III) TESTE DO IODOFÓRMIO(CHI3)
OCORRE COM COMPOSTOS DO TIPO:
OH
CH3
C
(metil-álcoois)
O
CH3
(acetaldeído)
C
H
CH3
C
(metil-cetonas)
O
O
Ex. CH3
O
C
3 I2 + 4 NaOH
CHI3
+
HC
O Na
H
+ 3 H2O + 3 NaI
IV)REAÇÃO DE CANNIZZARO:SÓ PARA ALDEÍDOS SEM Hα.A REAÇÃO É UMA AUTO-REDOX OU
DESPROPORCIONAMENTO.
O
Ex.
O
NaOH
H
H H
O
OH
H
H
H
H
ONa
H
12)ÁCIDOS CARBOXÍLICOS
REAÇÃO TÍPICA:CARÁTER ÁCIDO
I)NEUTRALIZAÇÃO:
Ex. CH3COOH + KOH
CH3COOK + H2O
II)HELL-VOLHARD-ZELINSKY: É A HALOGENAÇÃO DE ÁCIDOS COM Hα CATALISADA POR PVERMELHO.
Ex. CHCOOH + Cl2
Pvermelho
CH2ClCOOH + HCl
III)FORMAÇÃO DOS DERIVADOS DOS RCOOH
IIIa)ÉSTERES(FISCHER)
COOH
COOCH2CH3
+
IIIb)ANIDRIDOS
CH3CH2OH H/OH
+
H2O
P2O5
calor
Ex. 2 CH3COOH
CH3COOOCCH3
+
H2O
IIIc)CLORETOS DE ÁCIDOS
CH3COCl + SO2 +HCl
Ex. CH3COOH + SOCl2
IIId)AMIDAS
Ex. CH3COOH + NH3
calor
CH3COONH4
CH3CONH2 +H2O
13) DERIVADOS DOS ÁCIDOS CARBOXÍLICOS
REAÇÃO TÍPICA:SUBSTITUIÇÃO NUCLEOFÍLICA
ORDEM DE REATIVIDADE:
O
O
R
C
O
C
< R
Cl
O
O
C
R < R
O
C
< R
OR
C
NH2
A HIDRÓLISE BÁSICA DE ÉSTERES É A REAÇÃO DE SAPONIFICAÇÃO.
O
Ex.
H C
O
C
O
R
H O
HC
O
C
O
R
H O
HC O C R
triacilglicerídio
(óleo ou gordura)
H O
2
2
NaOH
H C
2
CH
CH2
3R
COONa
2
OH
2
OH OH
glicerina
sabão
A ALCOÓLISE DE ÉSTERES É A REAÇÃO DE TRANSESTERIFICAÇÃO.
Ex.
H3CCOOC2H5
+
OHCH3
H3CCOOCH3 + OHC2H5
14) AMINAS
REAÇÃO TÍPICA:CARÁTER BÁSICO
NH2
NH3Cl
Ex.
+ HCl
anilina
cloreto de anilônio
(sal de amina)
O NH2 é um poderoso ativante , por isso não gera reações de Friedel-Crafts,pois ataca os catalisadores(ácidos de Lewis).
15)AMIDAS
REAÇÃO TÍPICA:SUBSTITUIÇÃO NUCLEOFÍLICA
O
H2N
C
COOH
H
H2O
benzamida
NH3
ácido benzóico
SÃO COMPOSTOS NEUTROS DEVIDO À RESSONANCIA ABAIXO:
O
R
C
NH2
REDUÇÃO: PRODUZ AMINAS
O
Ex.
H3CC
NH2
acetamida
LiAlH4
4[H]
+
H3CCH2NH2
etilamina
H2O
+
16)NITROCOMPOSTOS
O GRUPO NO2 É UM PODEROSO GRUPO RETIRADOR DE ELÉTRONS ,POR ISSO DESATIVA O NÚCLEO AROMÁTICO NAS
SUBSTITUIÇÕES ELETRÓFILAS.
NO2
NO2
H2SO4
HNO3
Ex.
H2O
NO2
REDUÇÃO:GERA AMINAS PRIMÁRIAS
NO2
NH2
Ex.
Fe/HCl
6[H]
2H O
2
nitrobenzeno
anilina
17)NITRILAS E ISONITRILAS
A RESSONÂNCIA DAS ISONITRILAS TORNA ESSAS SUBSTÂNCIAS MAIS REATIVAS QUE AS NITRILAS
R
C
N
R
N
C
R
C
R
N
N
C
REDUÇÃO
R
C
N
4[H] LiAlH
R
N
C
4[H] LiAlH4 R
4
R
CH2 NH2
amina 1ª
NH CH3
amina 2ª
HIDRÓLISE DE NITRILAS EM MEIO ÁCIDO
O
O
R
C
N
H2O
H
R
C
NH2
H2O
H
R
REAÇÃO COM RMgX
O
R
C
N
RMgX H
R
C
R
NH3
Mg(OH)X
O
R
N
C
RMgX
H
R
C
H
RNH2
Mg(OH)X
C OH