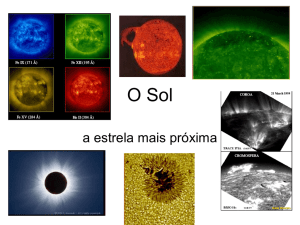
Trabalho 2:
Resolução do Ácido Fenilsuccínico
Racémico com (-)-Prolina
Lígia Figueiredo
Gustavo Lopes
2 de Maio de 2006
Resumo
Efectuámos a resolução de uma mistura racémica de ácido fenilsuccínico. Para o efeito, fizemos reagir a mistura com (-)-prolina
(ácido (S)-pirrolidina-2-carboxílico) em propan-2-ol. Formou-se um
precipitado, o sal (+)-bis prolina, e filtrámos a solução (o filtrado conteria o enantiómero (R)-(-)). O ácido (S)-(+)-fenilsuccínico foi obtido
do sal por tratamento com ácido clorídrico; no caso da obtenção do
enantiómero (R)-(-), este passo foi precedido da solução, em etanol
puro, de (-)-prolina e do resíduo obtido pela evaporação do filtrado.
A pureza dos produtos foi avaliada por medição do ponto de fusão
(186,4-189,5 o C para o ácido (S)-(+) e 177,0-180,0 o C para a conformação (R)-(-)) e do poder rotatório específico (+136,6o para o ácido
(S)-(+) e -104,4o para o ácido (R)-(-)). Concluímos que os isómeros
foram separados em grande extensão.
1
Introdução
Dois compostos dizem-se enantiómeros se forem a imagem no espelho
um do outro – trata-se de um tipo de estereoisomeria e requer que os compostos apresentem uma propriedade denominada quiralidade1 .
Os enantiómeros são especialmente difíceis de separar devido a possuírem propriedades químicas iguais. Uma excepção (que não é, no entanto, particularmente útil no que se refere à resolução, i.e., a separação da
1
Uma figura diz-se quiral se for distinta da sua imagem no espelho. Em três dimensões, uma condição necessária (mas não suficiente) para a existência de quiralidade é a
figura não apresentar um plano ou centro de simetria[1].
1
1
INTRODUÇÃO
2
mistura de enantiómeros) é o facto de, quando presentes num ambiente
simétrico, rodarem o plano da luz polarizada segundo ângulos simétricos.
Alguns enantiómeros, como o ácido tartárico, formam cristais que são
a imagem no espelho um do outro e podem ser separados manualmente2 .
Esta abordagem, embora simples, é pouco prática de realizar e apenas possível em casos raros. Uma estratégia melhor consiste em converter o par
de enantiómeros em diastereómeros (estereoisómeros que não são a imagem no espelho um do outro) que difiram em propriedades chave como a
solubilidade em dado solvente, por exemplo[3]. Por outro lado, um outro
método, a resolução biológica, tem como ideia base a utilização de dado
microorganismo que metabolize somente um dos enantiómeros.
Neste trabalho, é levada a cabo uma reacção enantioselectiva, i.e., uma
reacção em que um enantiómero específico é escolhido para reagir em detrimento do outro – esta selectividade requer que um solvente ou reagente
quiral ou dado enzima exerçam algum tipo de influência na reacção[3].
Em particular, o sucesso da resolução deve-se à formação preferencial
e precipitação do sal ácido (+)-fenilsuccínico-bis (-)-prolina ((S)-fenilsuccinato de bis((S)-2-carboxipirrolidínio)), na figura 1) em propan-2-ol. Uma
vez removido o precipitado da solução (por filtração), esta é evaporada.
Obtém-se ácido (-)-fenilsuccínico impuro (já que este não reagiu em grande extensão com a prolina). A obtenção de ácido (-)-fenilsuccínico opticamente puro é conseguida com novo tratamento com prolina (usando o
etanol como solvente). Forma-se, então, um sal de (-)-mono prolina[4].
Ambos os enantiómeros são obtidos através dos respectivos sais mediante
a protonização dos aniões fenilsuccinato com ácido clorídrico. Note-se
que este processo de obtenção é eficaz porque o ácido fenilsuccínico neutro é pouco solúvel em água, enquanto o aminoácido prolina protonado é
muito solúvel no mesmo solvente[5].
Avanços nos processos industriais químicos têm permito à indústria
farmacêutica, quando útil, passar a incluir apenas um dos enantiómeros
em drogas que eram originalmente comercializadas como misturas racémicas (com os isómeros presentes em igual proporção). Como muitas reacções realizadas no nosso corpo são enantioselectivas, frequentemente
apenas um dos isómeros é eficaz. Por vezes, como no caso da talidomida,
2
Foi o que fez Louis Pasteur em 1843, enquanto investigava um sedimento cristalino
que se acumulava em pipas de vinho (uma forma de ácido tartárico chamada ácido racémico). Pasteur usou uma pinça pequena para separar os dois tipos de cristais, com
formas semelhantes, mas imagens no espelho um do outro. Ambos os tipos tinham todas
as propriedades químicas do ácido tartárico, mas um rodava a luz para a esquerda (levorotatório) e outro para a direita (dextrorotatório). Pasteur não sabia, no entanto, que tipo de
arranjo assimétrico estes enantiómeros apresentavam[2].
2
PARTE EXPERIMENTAL
3
HO
O
+H N
2
-O
O
O
-O
HO
NH2+
O
Figura 1: Fórmula de estrutura do sal ácido (S)-fenilsuccínico-bis (S)prolina.
um dos isómeros é tóxico. Aí, todavia, o problema não pode ser mitigado
por qualquer processo de síntese enantioselectivo, já que os enantiómeros
se convertem um no outro in vivo[6].
2
2.1
Parte Experimental
Aparelhagem e Montagens
Para evaporar o propan-2-ol e o etanol, em dadas etapas relativas ao
isolamento do ácido (-)-fenilsuccínico, utilizámos um evaporador rotativo
da German Webber SA. A determinação dos pontos de fusão foram efectuadas com uma precisão de 0,1 o C, usando um medidor de pontos de
fusão Stuart Scientific. O ângulo de rotação do plano da luz polarizada
causado pelas soluções de ácido fenilsuccínico opticamente purificado foi
determinado com um polarímetro Atago Polax-L, distribuído por Emídio
Azevedo Campos & Ca Lda, o qual apresentava uma precisão de 0,01o .
A fim de dissolver a prolina e causar a precipitação do sal (+)-bis prolina, empregou-se um método denominado refluxo, cuja respectiva mon-
2
PARTE EXPERIMENTAL
4
4
5
6
7
3
2
1
11
4
8
3
9
2
5
6
7
8
9
1
10
Figura 2: Esquema da montagem usada para o refluxo.
tagem está representada na figura 2. O refluxo é uma técnica para aplicar
energia a reacções durante períodos de tempo longos (no nosso caso, durante 30 m) sem que seja necessário adicionar mais solvente, já que qualquer vapor é imediatamente condensado no condensador. Ademais, como
um dado solvente entra em ebulição a uma temperatura fixa, podemos ter
a certeza de que a reacção ocorrerá sempre a essa mesma temperatura – inclusivamente, em certos casos, pode controlar-se essa temperatura através
da escolha de um solvente apropriado[7].
As protonizações com ácido clorídrico foram realizadas a zero graus –
o ácido foi colocado previamente num alguidar contendo uma mistura de
gelo e água (a 0 o C e pressão ambiente, a água existe nas duas fases). Após
se juntar o sólido, a solução era apenas retirada do alguidar para a agitar.
Por fim, realizaram-se, tal como no trabalho anterior, várias filtrações à
trompa, cujos detalhes não explicaremos novamente.
2.2
Reagentes
Ao longo da actividade experimental usaram-se, como reagentes: Lprolina, C5 H9 NO2 , 99%, da Aldrich; ácido fenilsuccínico, C10 H10 O4 , mis-
2
PARTE EXPERIMENTAL
5
tura racémica, 98%, da Aldrich; propan-2-ol, C3 H8 O, 99,8%, da Panreac
Química S.A.; acetona, CH3 COCH3 , 100%, da Higilim; ácido clorídrico,
HCl, 6 M e, por fim, etanol, C2 H6 O, 99,5%, da Panreac Química S.A.
2.3
Método Experimental
A experiência, nas linhas indicadas a seguir, foi iniciada Terça-feira, dia
28 de Março de 2006.
Começámos por pesar 1,94 g de ácido fenilsuccínico racémico e 1,152
g de (-)-prolina e medir 50 ml de propan-2-ol; dissolvemos, então, os primeiros no último. Desta forma obteve-se uma mistura de cor branca que,
em primeiro lugar, foi agitada durante cerca de 5 minutos, e de seguida,
refluxada por pouco mais de 30 minutos, findos os quais, arrefecemos a
solução colocando-a sob água corrente. Esta foi, então, filtrada à trompa
(guardámos o filtrado) e lavada duas vezes com 15 ml de acetona.
De modo a isolar o isómero (-), evaporámos o filtrado (que apresentava, sensivelmente, uma tonalidade amarelada) através de um evaporador rotativo. O sólido resultante foi deixado no exsicador durante 15 dias.
Para isolar o isómero (+), colocámos 10 ml de HCl num banho de gelo e
juntámos-lhe o sal branco obtido na filtração. Agitámos a mistura, dentro
do banho de gelo, durante cerca de 5 minutos. Esta foi, nesse momento,
filtrada à trompa e lavada duas vezes com 15 ml de água. Apesar de termos secado a amostra, esta ainda apresentava um aspecto húmido quando
a guardámos no frasco, que foi então também colocado no exsicador.
Nove dias mais tarde, foi medida a massa do ácido (+)-fenilsuccínico
e, de seguida, medido o ponto de fusão do mesmo.
O resto da actividade experimental, que passamos a descrever de seguida, ocorreu 15 dias após o início, a 11 de Abril de 2006.
Por forma a purificar o ácido (-)-fenilsuccínico, a amostra que fora colocada a secar no exsicador no dia 28 de Março foi dissolvida, junto com 0,40
g de (-)-prolina, em 40 ml de etanol absoluto. Esta mistura, antes de ser
levada ao evaporador rotativo, de modo a evaporar o etanol, foi agitada
durante cerca de 35 minutos, apresentando no final um aspecto leitoso.
Depois de retirar o sólido branco das paredes do balão, o procedimento foi semelhante àquele realizado na sessão experimental anterior –
adicionou-se o sólido a 10 ml de ácido clorídrico (num banho de gelo),
agitou-se durante 5 m, filtrou-se a solução, lavou-se o sólido branco resultante com duas vezes 15 ml de água e deixou-se a secar. Mais uma vez,
quando se passou o sólido para o copo, este ainda apresentava um aspecto
um pouco húmido. A amostra foi pesada e uma porção retirada para outro
3
RESULTADOS
6
copo a fim de se lhe medir o ponto de fusão.
Ao mesmo tempo que se foi processando a amostra de ácido (-)-fenilsuccínico, juntámos a nossa amostra do isómero (+) à de outro grupo3 .
Pesámos a nova amostra e preparámos, com esse grupo, uma solução rigorosa de 25 ml de ácido (+)-fenilsuccínico em acetona (solução transparente). Infelizmente, a solução foi mal preparada – juntou-se demasiada
acetona e excedeu-se a marca dos 25 ml. Uma vez obtido o ácido (-)fenilsuccínico puro, este foi sujeito a passos semelhantes.
Preparadas as soluções rigorosas, estas foram transferidas para dois
tubos do polarímetro. Mediu-se, então, a rotação que causavam ao plano
de luz polarizada.
Por fim, cerca de duas semanas mais tarde (dia 24 de Abril), medimos
o ponto de fusão do ácido (-)-fenilsuccínico.
Note-se que alguns passos da técnica, como as recristalizações e a mistura das amostras das conformações (+) e (-) com éter dietílico e acetona,
respectivamente, foram omitidos.
3
Resultados
3.1
Quantidades de Reagentes e Produtos
Na tabela 1 encontram-se as quantidades de reagentes realmente utilizadas. As massas de ambos os isómeros obtidos pelo nosso grupo estão
expressas na tabela 2. Na tabela 3, estão quantificadas as massas após nós
e o outro grupo termos retirado algum produto para medir o ponto de fusão e juntado os nossos produtos. A precisão da balança usada em todas
as medições era 0,01 g, excepto a primeira pesagem de (-)-prolina, na qual
foi usada uma balança com uma precisão de 0,001 g.
É importante salientar que as amostras de ácido (-)-fenilsuccínico pesadas não foram sujeitas à secagem no exsicador.
3.2
Rendimento
Usámos nesta experiência 1,94 g de ácido fenilsuccínico racémico (tabela 1). Dado ser uma mistura racémica, possuíamos à partida 1,94/2 =
0,97 g de cada um dos enantiómeros. De acordo com a tabela 2, obtivemos
0,47 g e 0,68 g dos isómeros (+) e (-), respectivamente. Isto implica que o
3
Grupo constituído pela Ângela Chan e pela Ana Rita Simões.
3
RESULTADOS
7
Substância
(-)-prolina
ác. fenilsuccínico rac.
propan-2-ol
acetona
ác. clorídrico
etanol
água
Quantidade
1,152 g; 0,40 g
1,94 g
50 ml
2 × 15 ml; ≈ 2 × 25 ml
2 × 10 ml
40 ml
4 × 15 ml
Tabela 1: Quantidades de reagentes usados.
Substância
ác. (+)-fenilsuccínico
ác. (-)-fenilsuccínico
Quantidade
0,47 g
0,68 g
Tabela 2: Quantidades de produtos obtidos.
rendimento foi 0,47/0,97 = 48,4% para o isómero (+) e 0,68/0,97 = 70,1%
para o (-).
3.3
Poder Rotatório Específico
Na tabela 4, encontram-se os valores do ângulo de rotação do plano da
luz polarizada induzido pelas nossas amostras, conforme lidos no polarímetro4 . O solvente foi acetona, usou-se a risca D do sódio (λ = 589 nm)
e a medição realizou-se à temperatura ambiente. As concentrações das
soluções estão indicadas na tabela 5.
O poder rotatório específico, [α]D , pode então ser calculado a partir da
expressão
α
[α]D =
c×l
onde α é a rotação observada, c a concentração da solução em g/ml e l o
comprimento do tubo em dm (o tubo usado tinha 2 dm).
Dado o volume das soluções preparadas ser 25 ml, podemos facilmente
determinar as concentrações a partir dos dados da tabela 3.
Os resultados obtidos para a concentração e poder rotatório específico
das soluções estão expressos na tabela 5.
4
Na verdade, no caso do isómero (-), a máquina mostrou -7,10o ; a este valor foi necessário aplicar uma correção de -0,75o .
3
RESULTADOS
8
Substância
ác. (+)-fenilsuccínico
ác. (-)-fenilsuccínico
Quantidade
0,97 g
0,94 g
Tabela 3: Quantidades de produtos obtidos (os dois grupos).
Soluto
ác. (+)-fenilsuccínico
ác. (-)-fenilsuccínico
Rotação
+10,60o
-7,85o
Tabela 4: Rotações induzidas pelas soluções dos isómeros.
3.4
Pureza Óptica
O excesso enantiomérico (ee) é definido segundo a expressão
ee =
[α]obs
[α]max
(1)
onde [α]obs é o poder rotatório específico da amostra e [α]max o poder rotatório específico máximo (aquele de uma solução pura do enantiómero em
causa). O valor de ee ser positivo significa que o enantiómero está em excesso na amostra, ser negativo significa que está em défice (o enantiómero
em causa roda a luz no sentido oposto à amostra) e ser nulo implica que
o poder rotatório específico da amostra é nulo, i.e., que a amostra é uma
mistura racémica.
O poder rotatório específico publicado para o ácido (+)-fenilsuccínico
é [α]D = +173,3o (c 1,8235; acetona)[4]. Tomando este valor para o poder
rotatório específico máximo da nossa amostra do isómero (+), [α]+
max , e o
simétrico para [α]−
,
obtém-se
um
excesso
enantiomérico
ee
=
78,8%
+
max
para a amostra do isómero (+) e ee− = 60,2% para o (-).
Denotemos a proporção de um dado composto x face ao conjunto deste
com o seu enantiómero y, numa dada amostra, por px (e definição análoga
para py ). Estes valores podem ser determinados a partir do excesso enan-
3
RESULTADOS
Soluto
ác. (+)-fenilsuccínico
ác. (-)-fenilsuccínico
9
Concentração
0,0388 g/ml
0,0376 g/ml
Pod. Rot. Esp.
+136,6o
-104,4o
Tabela 5: Concentração e poder rotatório específico das soluções.
tiomérico do composto x, eex , resolvendo o sistema de equações5
px + py = 1
⇒
px − py = eex
1 1
⇒ px = + eex
2 2
(2)
(3)
Para a amostra de ácido (+)-fenilsuccínico, substituindo em (3), obtémse que a proporção do enantiómero (+) face à soma dos dois é p+
x = 89,4%;
para o amostra do outro enantiómero tem-se p−
=
80,1%.
y
Os resultados obtidos nesta subsecção estão sumariados na tabela 6.
Amostra
ác. (+)-fenilsuccínico
ác. (-)-fenilsuccínico
Exc. Enant.
(+): 78,8%
(-): 60,2%
Prop. dos enant.
(+): 89,4%; (-): 10,6%
(+): 19,9%; (-): 80,1%
Tabela 6: Excesso e proporção dos enantioméricos das amostras.
3.5
Pontos de Fusão
O ponto de fusão da amostra de ácido (+)-fenilsuccínico, medido nove
dias depois de ter sido colocado a secar no exsicador, situou-se na região
dos 186,4-189,5 o C. A fusão da amostra de ácido (-)- fenilsuccínico, que
secou durante aproximadamente duas semanas, deu-se entre os 177,0 e os
180,0 o C.
5
Segue-se a prova de que px − py = eex . Seja px função proporcional a [α]obs (esta hipótese, assumida em toda esta secção do relatório, introduz, na verdade, um erro). Dado
que acabámos de assumir que a relação entre px e [α]obs é linear, bastam-nos dois pontos
para a descrevermos completamente. Dadas as hipóteses sobre px e py (são as proporções
de cada enantiómero face ao conjunto dos dois), então px (0) = 1/2 (mistura racémica) e
px ([α]xmax ) = 1 (amostra opticamente pura). Então px ([α]obs ) = 1/2 + (1/2)([α]obs /[α]xmax ).
Pela definição de excesso enantiomérico, esta equação é equivalente à da equação (3).
Uma vez que px + py = 1 (segue-se também da definição das quantidades envolvidas),
temos que py = 1 − px = 1/2 − (1/2)([α]obs /[α]xmax ), donde px − py = [α]obs /[α]xmax = eex .
4
DISCUSSÃO
4
10
Discussão
A melhor medida para avaliar os resultados deste trabalho são aqueles publicados por Stephani et al.[4], os quais estão sumariados a par dos
nossos na tabela 7.
Amostra
ácido (+) (Steph)
ácido (+) (nosso)
ácido (-) (Steph)
ácido (-) (nosso)
Massa (Rend.)
0,39 g (40%)
0,47 g (48%)
0,57 g (59%)
0,68 g (70%)
P. Rot. Esp. (Prop.)
+151o (94%)
+136,6o (89%)
-160o (96%)
-104,4o (80%)
Pto. Fusão
N/D
186,4-189,5 o C
176-179 o C
177,0-180,0 o C
Tabela 7: Comparação com os resultados de Stephani et al.[4]
Note-se que os valores referidos no artigo de Stephani são valores médios e não há qualquer informação acerca da dispersão dos mesmos. Além
disso, o método a que se referem os valores inclui um passo que não realizámos – a solução do (-)-sal em acetona (o que só deverá, naturalmente,
afectar a amostra de ácido (-)-fenilsuccínico).
Temos muitas reservas em relação aos valores obtidos para o poder
rotatório específico (e, portanto, também para o excesso enantiomérico e
proporções) dos enantiómeros. Em primeiro lugar, referem-se à mistura
dos nossos produtos com os de outro grupo, cuja extensão da aderência ao
protocolo e rigor na execução desconhecemos. Ademais, estão ambos provavelmente abaixo da realidade porque as massas usadas para o cálculo
da concentração das soluções rigorosas estão sobreavaliadas. No caso do
enantiómero (+), juntou-se solvente a mais na preparação da solução rigorosa; no caso do (-), a amostra estava ainda claramente húmida quando foi
pesada e de seguida dissolvida na acetona, i.e., este composto não foi submetido ao mesmo processo de secagem do outro enantiómero. A última
objecção aplica-se também à massa de ácido (-)-fenilsuccínico indicada e
ao correspondente rendimento. Teria sido interessante medir a massa do
ácido (+)-fenilsuccínico também antes da secagem (e não apenas depois).
A comparação dos dois ter-nos-ia fornecido uma indicação sobre o erro
introduzido na avaliação da massa do ácido (-)-fenilsuccínico.
A nossa amostra de ácido (+)-fenilsuccínico possui uma massa um pouco superior à apontada por Stephani et al. (o qual recomenda que se deixe
secar completamente o sal, algo que não fizemos). Ao analisarmos o valor do poder rotatório específico, devemos ter as conta as considerações já
tecidas. Acrescenta-se que a medição no polarímetro tem um grau de subjectividade e causa cansaço rapidamente. Para mais, o ângulo medido no
4
DISCUSSÃO
11
polarímetro é muito inferior ao poder rotatório específico – o mesmo erro
relativo em ambos os valores causa um erro absoluto bastante maior6 no
poder rotatório específico. Tudo isto implica que não possamos afirmar
que existe uma diferença entre os nossos resultados e os publicados por
Stephani et al.
No caso do ácido (-)-fenilsuccínico, os valores são ainda menos fiáveis
(e, portanto, mais inconclusivos). O único resultado fiável é o ponto de
fusão, que se encontra muito próximo do valor apontado por Stephani
et al. Note-se que, mesmo assim, este valor se situa ainda um pouco
longe daquele que os autores indicam para uma amostra opticamente pura
dos compostos (obtida após recristalização de água), os 185-186 o C7 . Para
esta diferença contribuirá essencialmente alguma contaminação da amostra com prolina (que, além do mais, é opticamente activa e terá afectado
também a rotação que a amostra induziu ao plano de luz polarizada – consequentemente, terá afectado também os nossos resultados concernentes
à proporção dos dois enantiómeros). Por fim, refira-se que ambos os pontos de fusão apresentaram intervalos com amplitude de vários graus, o
que aponta também para alguma contaminação (espera-se que amostras
puras registem um intervalo muito curto para o ponto de fusão).
Uma boa parte da explicação para a obtenção destes rendimentos está
no facto de, por diversas vezes, ser difícil transferir na totalidade as amostras entre recipientes. Esta dificuldade fez-se sentir principalmente quando se retiravam sólidos do balão após evaporação ou resíduos húmidos de
funis.
Entre outros factores, considerem-se ainda as reacções de formação dos
sais, o ponto crítico do método, que determinará a qualidade da separação
enantiomérica. A (-)-prolina reage preferencialmente com o isómero (+),
mas parte também reagirá com o outro isómero (é aliás o que é feito na segunda parte da experiência, após aumentar a concentração de prolina, se
bem que num solvente diferente). Isto acabará por contaminar a amostra
de ácido (+)-fenilsuccínico. Por outro lado, a reacção ácido-base de formação dos sais não será completa. No caso do (+)-sal, isto significa que parte
do enantiómero (+) ficará na solução, contaminará a amostra de ácido (-)fenilsuccínico e diminuirá o rendimento da obtenção da amostra de ácido
6
Neste caso, cerca de 13 vezes maior.
O ponto de fusão do ácido fenilsuccínico está geralmente listado em cerca de 167 o C.
Este foi, aliás, o valor que colocámos no pré-relatório. No entanto, este ponto de fusão
diz respeito à mistura racémica. Uma vez que os enantiómeros possuem formas distintas,
interferirão com a organização cristalina um do outro, o que causará uma depressão do
ponto de fusão da mistura. Após a separação, a formação de uma rede cristalina regular
é mais fácil[5].
7
5
CONCLUSÃO
12
(+)-fenilsuccínico. No caso da formação do (-)-sal, que é feita posteriormente, isto significa que haverá uma diminuição do rendimento da obtenção do enantiómero (-). No caso das protonizações com ácido clorídrico,
a extensão incompleta das reacções causará simplesmente uma perda de
rendimento. Outro factor poderá ser o de todos os compostos em causa
não serem totalmente solúveis ou insolúveis nos respectivos solventes.
5
Conclusão
O principal objectivo desta experiência era a resolução da mistura racémica de ácido (-)-fenilsuccínico. As reservas que temos em relação aos
dados disponíveis para avaliar a pureza óptica das amostras impedem-nos
de apresentar uma conclusão forte relativamente ao sucesso do trabalho.
Os valores de que dispomos para o poder rotatório específico devem pecar
por defeito8 ; ainda assim, estes apontam para proporções do enantiómero
desejado superiores a 80%, o que indica a existência de uma separação
significativa. Os pontos de fusão e rendimentos obtidos estão próximos
daqueles indicados por Stephani et al.[4] e são bastante satisfatórios.
Referências
[1] Chirality (Mathematics). Wikipedia. 2006. 22 Abr. 2006 <http://en.
wikipedia.org/wiki/Chirality_%28mathematics%29>.
[2] Nelson, David L., and Michael M. Cox. Lehninger Principles of Biochemistry. 4th ed. W. H. Freeman and Company, 2005. 19.
[3] Logan, Ralph. Racemization. Home Page of Ralph Logan. 1997. 23 Apr.
2006 <http://members.aol.com/logan20/racemate.html>.
[4] Stephani, Ralph, and Victor Cesare. Resolution of Racemic Phenylsuccinic Acid Using (-)-Proline as a Resolving Agent. Journal of Chemical Education 74 (1997): 1226.
[5] Optical Resolution of 2-Phenylsuccininc Acid. Linfield Chemistry. 18
Aug. 2005. Department of Chemistry, Linfield College. 22 Mar. 2006
8
Poderíamos pensar que a prolina, cujo poder rotatório específico é negativo, teria
contribuído para um resultado favorável no valor dessa grandeza para o isómero (-) ao
contaminar em muito a amostra. No entanto, o poder rotatório específico da (-)-prolina é
o
o
apenas [α]20
D = −85,2 (c 0,04; H2 O)[8], bem longe dos -173,3 do ácido (-)-fenilsuccínico.
REFERÊNCIAS
13
<http://www.linfield.edu/chem/C321/Labs/resolution
_of_enantiomers.pdf>.
[6] Enantiomer. Wikipedia. 20 Abr. 2006. 23 Abr. 2006 <http://en.wiki
pedia.org/wiki/Enantiomer>.
[7] Reflux. Wikipedia. 11 Abr. 2006. 24 Abr. 2006 <http://en.wiki
pedia.org/wiki/Reflux>.
[8] USB Tech Library. USB Corporation. 30 Apr. 2006 <http://www.
usbweb.com/reference2.asp?id_ref=25>.
[9] Katz, Jeffrey. "Chemical Resolution of (±)-Phenylsuccinic Acid with ()-Proline."CH241 Spring 2005. 21 Feb. 2005. Department of Chemistry,
Colby College. 19 Apr. 2006 <http://www.colby.edu/chemis
try/CH241S/Experiment%202.pdf>.