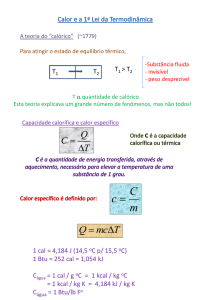
Estudo dos Grupos da Tabela Periódica
1. Por que os metais alcalinos são mais reativos que outros metais?
2. Por que o bismuto, por ser um metal, tem ponto de fusão baixo? Por que o ponto de fusão do
bismuto é menor que dos outros elementos da mesma família?
3. De acordo com os dados de ponto de ebulição e ponto de fusão dos elementos dos grupos 1
e 2 mostrados na tabela abaixo, responda:
Grupo 1
Grupo 2
Elementos
P.F. (°C)
P.E. (°C)
Elementos
P.F. (°C)
P.E. (°C)
Li
181
1347
Be
1285
2470
Na
98
883
Mg
650
1100
K
64
774
Ca
840
1490
Rb
39
668
Sr
770
1380
Cs
28
678
Ba
710
1640
Fr
27
677
Ra
700
1500
a) Por que os pontos de fusão e de ebulição do grupo 1 são muito menores em relação ao grupo
2?
b) Dos elementos do grupo 1, por que o lítio apresenta maior ponto de fusão?
4. Por que os elementos do grupo 1 possuem energia de ionização menor que os do Grupo 17?
5. Em relação as ligas metálicas, responda:
a) O cobre é um metal rígido, porém quando se adiciona berílio forma-se uma liga mais rígida,
por quê?
b) Quais características são desejáveis a uma liga quando adiciona-se magnésio?
6. Qual a diferença entre cal viva e cal extinta?
7. De acordo com a tabela abaixo, responda:
Elemento
Camada de Valência
Oxigênio
Enxofre
Selênio
Telúrio
Polônio
2s2 2p4
3s2 3p4
3d10 4s2 4p4
4d10 5s2 5p4
4f14 5d10 6s2 6p4
-II
XX
X
Estado de Oxidação
-I
II
IV
VI
XX
XX
XX
XX
XX
XX
XX
X – ocorre em menor intensidade.
XX – ocorre em maior intensidade.
Por que os elementos do grupo 16 apresentam diferença quanto ao estado de oxidação de seus
elementos?
8. O oxigênio líquido é um elemento fortemente atraído pelo imã, por quê?
9. Por que os oceanos são salgados com cloretos e não fluoretos?
10. Por que a energia de ionização dos gases nobres é muito alta?