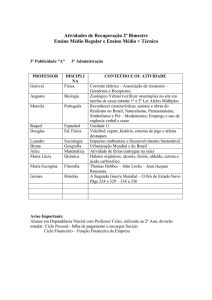
Reações Orgânicas parte I:
Reações de substituição,
eliminação e hidrólise
Profa. Kátia Aquino
1-Reações de substituição
1-REAÇÃO DE SUBSTITUIÇÃO
É uma típica reação de compostos saturados, como alcanos e
haletos. Contudo, devido a estabilidade do anel, compostos
aromáticos com benzeno, também sofrem este tipo de
reação.
Reação de substituição em alcanos
Alcanos sofrem reação de substituição via ataque de radicais
livres ou ataque eletrofílico.
1a- Reação de Substituição via radical livre
Veja exemplo abaixo e perceba a mistura de isômeros de
posição formada.
As reações de substituição de alcanos via radical livre são também
conhecidas como halogenação, pois acontecem com flúor
(fluoração),cloro (cloração), bromo (bromação) ou iodo (iodação). As
reações com iodo são muito lentas, logo são mais comum as
observações das reações de fluoração, cloração e bromação.
O bromo é seletivo e ataca os carbonos, terciários, secundários e
primários nesta ordem (veja o exemplo da reação acima). O cloro
produz uma mistura de isômeros de posição, sem necessariamente
seguir a ordem de reatividade dos carbonos. Já com o flúor, as
concentrações dos produtos são praticamente iguais, pois o flúor é
muito mais reativo que o cloro e o bromo.
1b- Reação de Substituição por ácidos fortes
Os alcanos não são, de modo geral, afetados pela maioria das
bases. Isto acontece devido à baixa polaridade das ligações
carbono-hidrogênio. Além disso, as moléculas dos alcanos não
possuem elétrons não-compartilhados para oferecer campos para
ataques pelos ácidos, levando à baixa reatividade em relação a
vários reagentes. Contudo, quando aquecidos, os alcanos também
sofrem as reações de nitração (com ácido nitrico) e sulfonação
(com ácido sulfônico)
1.b.1 Reação de Nitração de alcanos
Os alcanos podem ser nitrados utilizando-se ácido nítrico concentrado em
condições enérgicas (aprox. 400oC) e na presença de ácido súlfurico,
produzindo nitro-compostos:
1.b.2 Reação de Sulfonação de alcanos
Os alcanos podem ser sulfonados utilizando-se ácido sulfúrico concentrado , na
presença de trióxido de enxofre e a altas temperatura, produzindo ácidos
sulfônicos:
http://www.ebah.com.br/content/ABAAAANScAJ/reacoes-alcanos
1c-Reação de substituição em aromáticos
Reação de substituição em aromáticos ocorre via ataque
eletrofílico, ou seja, quem ataca o anel é um cátion. Neste
caso é necessário o uso de um catalisador. Veja a reação de
sulfonação do benzeno representada acima.
Reações de Friedel-Crafts também são substituição no
anel benzênico, veja:
Acilação
Alquilação
Se o anel aromático possui um substituinte (G) ,
este irá direcionar a substituição de outros
hidrogênios no anel nas posições indicadas
abaixo.
Radicais orto e para dirigentes ou ativantes
Abaixo um exemplo de uma reação de substituição cujo radical do
anel benzênico é orto e para dirigente:
Ex: Reação de cloração do tolueno. Forma-se os isômeros nas
posições orto e para.
Radicais meta dirigentes ou desativantes
Abaixo um exemplo de uma reação de substituição cujo
radical do anel benzênico é meta dirigente:
Ex: Reação de cloração do nitrobenzeno. Forma-se apenas
um composto orgânico com o cloro na posição meta.
1d-Reação de substituição em haletos
Este tipo de reação ocorre via ataque nucleofílico, ou seja,
quem ataca a cadeia carbônica é o ânion, geralmente uma
base de Lewis (OH- e RO- são exemplos). Para que haja
substituição de haletos precisamos considerar os seguintes
fatores:
a)Tipo do haleto (substrato)
Se primários, secundários ou terciários
OBS: Os haletos de metila, como por exemplo o cloreto
de metila, são os haletos menos impedidos, pois só
possuem três hidrogênios, que são átomos leves, na
vizinhança do halogênio.
b)Tipo de solvente
-Se polar prótico: quando o hidrogênio está ligado a um
elemento fortemente eletronegativo. Ex. Água e álcool
Os solventes polares próticos, devido as pontes de
hidrogênio que se estabelecem, obstruem o ataque do
nucleófilo em uma reação de substituição, devido ao
fenômeno de solvatação.
-Se polar aprótico: na molécula não existe um hidrogênio
está ligado a um elemento fortemente eletronegativo.
Ex. Acetona e N,N dimetilformamida (DMF)
Os solventes polares apróticos não fazem pontes
de hidrogênio, logo não solvatam o nucleófilo.
ex. de solvatação
Atenção na cinética da reação:
Haletos primários e secundários sofrem substituição
nucleofílica de segunda ordem (SN2), ou seja, a velocidade da
reação depende tanto da concentração do haleto como da
concentração da base. Cabe salientar que este mecanismo é
mais favorecido em haletos de metila e primários (nesta
ordem), devido ao menor impedimento estérico. Neste
mecanismo é preciso o uso de um solvente polar aprótico
como o DMF, pois não obstrui a ação do nucleófilo. Neste tipo
de solvente a velocidade da reação é aumentada
significativamente.
Haletos terciários, por conta do impedimento estérico do
halogênio na cadeia, sofre substituição nucleofílica de
primeira ordem (SN1), ou seja, a velocidade da reação só
depende da concentração do haleto. A cisão da ligação Chaleto é a etapa lenda da reação. Esta reação pode ocorrer
em solventes próticos, como a água, pois a velocidade não
depende da concentração do nucleófilo.
Atenção ao grupo abandonador
Os iodetos de alquila reagem mais rapidamente e os
fluoretos reagem muito lentamente que quase não são
usados em reações de substituição nucleofílica. Logo:
I- > Br- > Cl- > F- para ambas SN1 e SN2
Depois que abandonam a cadeia carbônica, estes grupos
se tornam bases de Lewis fracas. O iodeto é a base
mais fraca, pois estabiliza melhor a carga negativa ao
sair (relação tamanho/carga, ou seja, átomo
grande/carga pequena). Tal estabilização, que
acontece no complexo ativado, fornece uma energia de
ativação menor e por isso as reações com iodetos de
alquila são mais rápidas do que com os demais haletos.
Reação SN2
Características
Etapa única
Cinética: a velocidade da reação depende dos dois componentes
Ex:
http://littlebabsi.wordpress.com/2010/04/07/derivados-halogenados/
V = k [A] . [B]
V = k [OH-].[CH3Cl]
Denominação: Segunda ordem ou bimolecular
Mecanismo: ataque por trás do carbono que possui o halogênio.
Após ataque nucleofílico, os hidrogênios vão para lado oposto. Para
haletos oticamente ativos este mecanismo provoca a inversão ótica,
veja o exemplo que segue:
Reação SN1
Características
Etapas: possui 2 ou mais etapas
Cinética: A velocidade da reação depende da concentração do
derivado halogenado (R-X), pois a cisão heterolítica do haleto
terciário é a etapa lenta da reação
v=k[R-X]
Denominação: 1ª ordem ou unimolecular
Mecanismo: Pode reagir tanto pelo lado da frente quanto pelo lado de
trás do carbocátion formado na etapa lenta.Quando o haleto é
oticamente ativo é formada na reação uma mistura racêmica.
2-Reações de Eliminação
2-REAÇÃO DE ELIMINAÇÃO
Também ocorre com compostos saturados e neste caso
podemos destacar os alcanos, os álcoois e os haletos.
Como o próprio nome sugere, neste tipo de reação há a
liberação de uma molécula leve da cadeia carbônica
2a-Reação de eliminação em haletos ou
desidroalogenação
Reação de eliminação do cloro etano através do ataque de uma base
forte e no meio de um solvente prótico.
Os haletos orgânicos sofrem reação de eliminação na
presença de uma base de Lewis, ou seja um nucleófilo.
Observa-se os mecanismos de eliminação monomolecular
(E1) e bimolecular (E2), assim como acontece na reação
substituição. Observa-se E2 para os haletos primários,
secundários e terciários que reagem com uma base de
Lewis forte (OH- por exemplo). A E1 ocorre em haletos
terciários quando atacados por uma base fraca (por
exemplo CN-). Cabe salientar que as reações de
substituição e eliminação concorrem e sempre são
observados uma mistura dos dois produtos no final da
reação. A predominância depende de fatores com a força
da base (nucleófilo), do tipo de solvente do meio e a
temperatura. Por exemplo: solvente menos polares e a
temperaturas maiores favorecem a eliminação.
http://www.slideshare.net/nunes_ufc/reaes-de-eliminacao
http://www.slideshare.net/nunes_ufc/reaes-de-eliminacao
2b-Reação de eliminação de alcanos
São processos endotérmicos que necessitam de alta temperatura para a
obtenção de boas conversões. São restritos aos processos onde regentes e
produtos possuam estabilidade térmica.
Estireno é produzido no Brasil pela Cia Brasileira de Estireno – CBE,
INNOVA e Estireno do Nordeste S/A – EDN. Utilizam o processo de
desidrogenação do etil benzeno
Matéria prima
2c-Reação de eliminação de dihaletos
ou
2d-Reação de eliminação de álcool (desidratação)
Esta reação ocorre na presença de ácido, principalmente o ácido
sulfúrico e o que determina o tipo de desidratação, se inter ou
intramolecular, é a temperatura do sistema. Veja as diferenças
nas reações abaixo:
Eliminação intermolecular
Eliminação intramolecular
2e1-Reação de eliminação de água (intermolecular) na formação
de anidrido
P2O5
2e2-Reação de eliminação de água (intramolecular) na formação
de anidrido
http://portuguese.alibaba.com/product-gs/maleic-anhydride-258971312.html
O anidrido maleico provém do
ácido maleico (ácido- cis-butanodióico).
Cuidado com o isômero geométrico
do ácido (ácido- trans -butanodióico),
conhecido como ácido fumárico, que
por questões de geometria espacial
dos grupos carboxila, não forma
o anidrido fumárico por desidratação
Intramolecular.
2f-Reação de eliminação de água (intermolecular) na esterificação
O grupo hidroxila sai do ácido ou do álcool?
Um éster proveniente de ácido inorgânico que é um “estouro”
3-Reações especiais:
hidrólise e
transesterificação
http://www.qmc.ufsc.br/organica/exp13/reacoes.html
Importânica dos ésteres
Desde que as Indústrias alimentícias começaram a fabricar
produtos com sabor e aroma artificiais os ésteres já estavam
presente. Os ésteres constituem aditivos de alimentos que
conferem sabor e aroma artificiais aos produtos industrializados.
Conhecça alguns ésteres que simulam alguns aromas:
Butanoato de
etila
Etanoato de butila
Acetato de
pentila
Acetato de propila
Antranilato de metila
3a- Reação de hidrólise ácida de um éster
Esta reação é a reação inversa da reação de
esterificação. Veja:
ácido
A reação de esterificação e hidrólise ácida entram em equilíbiro químico
quando o sistema estiver fechado.
3b- Reação de hidrólise básica
Esta reação acontece em meio básico e forma o sal de ácido carboxílico
no lugar do ácido carboxílico, como ocorre na hidrólise em meio ácido.
Confira:
Reação de hidrólise básica x saponificação
Quando o éster utilizado no processo for um triglicerídio como óleo (insaturado)
ou gordura (saturado), que são ésteres graxos, o sal de ácido graxo formado
chama-se sabão. O sabão também pode ser obtido de uma reação entre
um ácido graxo e uma base. Veja o exemplo:
água
3c-Reação de transesterificação
Reação no qual um éster reage com álcool para formar outro éster. Veja :
Reação de transesterificação x biodiesel
Quando um triglicerído como óleo (insaturado) ou gordura (saturado), que são
ésteres graxos, reage com o álcool metílico (rota metílica) ou álcool étílico (rota
etílica), na presença de uma base forte (ou ácido) e com o aquecimento entre 55-65°C,
temos como produto um éster de ácido graxo e a glicerina.
O éster de ácido graxo formado na reação será um éster graxo
metílico (se for usado o metanol) ou éster graxo etílico (se for usado o etanol) .
Estes esteres graxos são conhecidos como biodiesel e são utilizados
misturados com combustíveis no percentual de 5% (B5). Este percentual foi
exigido pela Agencia Nacional de Petróleo e biocombustíveis (ANP),
desde março de 2010.
Mais informações:
http://sites.google.com/site/kbjr12/biodiesel
EX:
Bons estudos!