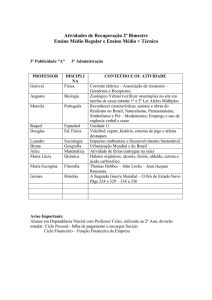
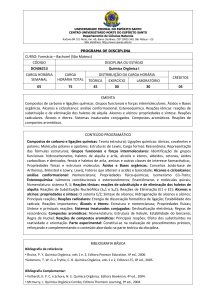
Aula: 19
Temática: Compostos Halogenados
COMPOSTOS HALOGENADOS
Na aula de hoje abordaremos os compostos halogenados, de onde
se originam os sais. Entre eles está o cloreto de sódio, mais conhecido como o
sal de cozinha. Acompanhe-me!
Haletos Iônicos
A maioria dos haletos iônicos contém o íon metálico nos estados de oxidação
(+1), (+2), ou (+3). Isso inclui os haletos do Grupo I, do Grupo 2 (exceto Be), os
lantanídeos, e alguns dos metais de transição. A maioria dos haletos iônicos é
solúvel na água, e forma íons haleto e metálicos hidratados. Alguns poucos
haletos são insolúveis: LiF, CaF2, SrF2, BaF2 e os cloretos, brometos e iodetos
de Ag(+1), Cu(+1), Hg(+1), e Pb(+2). Geralmente, a solubilidade aumenta do Fpara o I- (desde que sejam iônicos), pois a energia reticular diminui à medida
que o raio iônico aumenta.
Haletos Covalentes
No caso de metais com covalência variável, geralmente o estado de oxidação
mais alto é encontrado com os fluoretos. Por exemplo: o ósmio forma OsF6
com F, mas somente OsCl4, OsBr4 e OsI4 com os demais halogênios. Os
elementos em estados de oxidação elevados geralmente formam compostos
covalentes. Num metal com estados de oxidação variáveis, aqueles mais
elevados serão covalentes e os mais baixos serão iônicos. Por exemplo, o UF6
é covalente e gasoso, enquanto o UF4 é um sólido iônico. Analogamente, o
PCl4 é covalente e o PbCl2 é iônico. A maioria dos elementos mais
eletronegativos também forma haletos covalentes, também conhecidos como
haletos moleculares. Muitos deles são rapidamente hidrolisados pela água:
QUÍMICA INORGÂNICA
BCl3 + 3H2O → H3BO3 + 3H+ + 3ClSiCl4 + 4H2O→ Si(OH)4 + 4H+ + 4ClPCl3 + 3H2O → H3PO3 + 3H+ +3ClPCl5 + 4H2O → H3PO4 + 5H+ + 5Cl-
Às vezes, quando o elemento alcança seu grau de covalência máxima, os
haletos não reagem com a água. Por exemplo, o CCl4 e o SF6 são estáveis.
Isso se deve a fatores cinéticos e não termodinâmicos. Os haletos moleculares
são geralmente gases ou líquidos. Isso decorre da presença de fortes ligações
intermoleculares, mas somente de ligações intermoleculares fracas do tipo Van
der Waals.
Está aula foi curta, mas de extrema importância. Se for necessário,
revise o conteúdo da aula 08, quando falamos sobre os halogênios, essa
revisão poderá ajudar a entender melhor o conteúdo. Não hesite em enviar
suas dúvidas. Terei o maior prazer em ajudá-lo. Bom estudo!
QUÍMICA INORGÂNICA