A Natureza Elétrica da Matéria
Você já parou para pensar que toda matéria na natureza é eletricamente neutra? Pelo
menos no planeta Terra podemos afirmar isso! Talvez tenha sido essa observação que
levou John Dalton, em 1803, a propor o átomo como uma esfera rígida e indivisível.
Por outro lado, muitas substâncias conduzem eletricidade e alguns experimentos
realizados no século XIX foram fundamentais para descrever a natureza elétrica da
matéria.
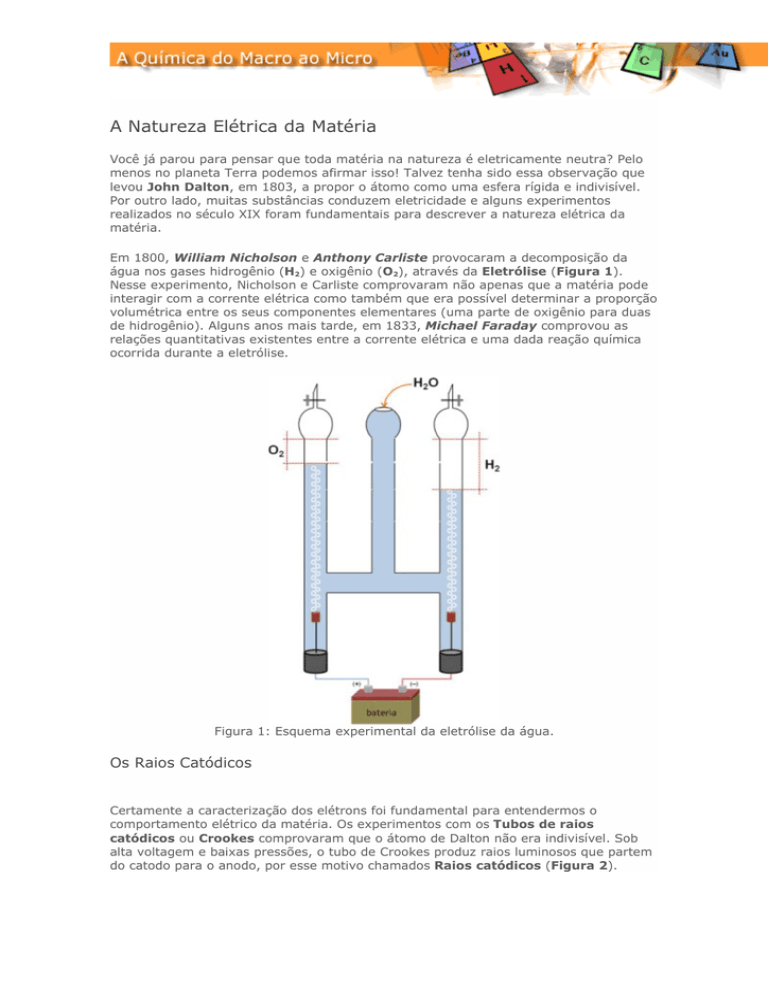
Em 1800, William Nicholson e Anthony Carliste provocaram a decomposição da
água nos gases hidrogênio (H2) e oxigênio (O2), através da Eletrólise (Figura 1).
Nesse experimento, Nicholson e Carliste comprovaram não apenas que a matéria pode
interagir com a corrente elétrica como também que era possível determinar a proporção
volumétrica entre os seus componentes elementares (uma parte de oxigênio para duas
de hidrogênio). Alguns anos mais tarde, em 1833, Michael Faraday comprovou as
relações quantitativas existentes entre a corrente elétrica e uma dada reação química
ocorrida durante a eletrólise.
Figura 1: Esquema experimental da eletrólise da água.
Os Raios Catódicos
Certamente a caracterização dos elétrons foi fundamental para entendermos o
comportamento elétrico da matéria. Os experimentos com os Tubos de raios
catódicos ou Crookes comprovaram que o átomo de Dalton não era indivisível. Sob
alta voltagem e baixas pressões, o tubo de Crookes produz raios luminosos que partem
do catodo para o anodo, por esse motivo chamados Raios catódicos (Figura 2).
Figura 2: Esquema de um tubo de raios catódicos.
Com esse experimento foram feitas as seguintes observações sobre os raios catódicos:
Deslocavam-se em linha reta do eletrodo negativo (catodo) para o eletrodo positivo
(anodo).
Movimentavam pequenos objetos – transferência de momento característica de
partícula.
Sofriam desvio sob a ação dos campos elétrico e magnético para o polo positivo
partícula carregada negativamente.
Quando na presença de um gás residual, emitem luz – a cor depende do gás utilizado.
Independem da natureza dos eletrodos ou do gás residual – está presente em toda a
matéria.
Por essas observações, concluiu-se que os raios catódicos eram constituídos por
partículas de carga elétrica negativa capazes de interagir com a matéria. Essas
partículas foram chamadas de elétrons.
A radioatividade
Em 1896, Henri Becquerel observou que o minério de urânio emitia uma radiação que
era capaz de velar placas fotográficas. Em 1898, Marie e Pierre Curie descobriram
que os elementos rádio e polônio emitiam a mesma radiação, que eles denominaram
radioatividade. Posteriormente, duas partículas (alfa e beta) e uma radiação
eletromagnética (gama) foram identificadas como resultantes daquela emissão
radioativa (Figura 3).
Figura 3: Esquema do experimento para caracterização de partículas radioativas.
Características fundamentais dos elétrons
Aplicando simultaneamente um campo elétrico e um campo magnético a um tubo de
raios catódicos (Figura 4), Joseph John Thomson, em 1897, foi capaz de determinar
a relação entre a carga e a massa do elétron (e/m= –1,76x108 C/g).
Figura 4: Esquema do experimento de Thomson.
Em 1910, analisando o comportamento de gotas de óleo em um campo elétrico (Figura
5), Robert Andrews Millikan determinou a carga do elétron (-1,6x10–19 C) e,
consequentemente, a sua massa (9,1x10–28 g).
Figura 5: Esquema do experimento de Mulliken.
Retornando ao século XIX, vemos que Ernest Goldenstein observou um feixe de
partículas carregadas positivamente que se moviam em direção oposta à dos raios
catódicos. Esse feixe de partículas foi caracterizado como íons positivos, produzidos
através da colisão entre os elétrons (raios catódicos) e as moléculas de gás contidas no
interior dos tubos de Crookes (Figura 6). Essas partículas passaram a ser chamadas de
Raios canais.
Figura 6: Esquema do experimento para observação dos raios canais.
Modelos atômicos
Com base na natureza elétrica da matéria, Thomson propôs seu modelo atômico,
afirmando que o átomo era composto por uma massa positiva, que continha tantos
elétrons quantos fossem necessários para que a matéria ficasse neutra. Era o modelo
do “pudim de passas” (Figura 7).
Figura 7: Representação do átomo de Thomson.
Na tentativa de comprovar experimentalmente o modelo de Thomson, Ernest
Rutherford propôs um experimento com partículas alfa que o levou a revolucionar o
modelo atômico. Rutherford afirmou que o átomo era composto por um núcleo
pequeno, carregado positivamente, de alta densidade e com os elétrons ocupando o
espaço em torno desse núcleo (Figura 8). Atualmente, sabemos que o raio do átomo é
aproximadamente 100.000 vezes maior que o raio do seu núcleo. Com esse modelo
atômico, vemos que a localização dos elétrons na matéria fica claramente definida.
Temos um núcleo positivo e, em torno dele, elétrons suficientes para manter a
neutralidade da matéria.
Figura 8: Representações do átomo de Rutherford.
O átomo de Rutherford estava bem caracterizado experimentalmente, mas contrariava
a Física clássica no que dizia respeito às partículas carregadas e em movimento circular.
A partir desse ponto, sabemos que a teoria dos Quanta de energia, de Max Planck (E
= hv) e o Efeito fotoelétrico de Albert Einstein (EFóton= hc/λ) foram fundamentais
para a evolução do modelo atômico. Em 1913, Niels Bohr propôs um modelo atômico
para o átomo de hidrogênio, postulando que:
Os elétrons ocupam uma posição definida no átomo, chamada níveis de energia.
Quando os elétrons estão localizados nos níveis de menor energia, o átomo estará no
seu estado fundamental.
Quando o elétron absorve uma quantidade definida de energia, dada por E= hv, ele é
promovido para níveis de energia mais altos, caracterizando o estado excitado do
átomo.
Uma vez no estado excitado, os elétrons com excesso de energia decaem para níveis de
menor energia, emitindo a energia excedente.
Esses postulados de Bohr redirecionam o átomo da Física clássica para a Física
quântica.
Não avançaremos nas teorias atômicas por não ser o propósito desta disciplina.
Contudo, gostaríamos de relacionar mais um ponto importante na caracterização dos
elétrons – a chamada dualidade partícula-onda da matéria. Em 1924, Louis de
Broglie estudou o caráter ondulatório do elétron e comprovou, com experimentos de
difração, que os elétrons se comportavam tanto como partícula (possui massa e
momento) quanto como onda (sofre difração).
Sugerimos que você faça uma revisão sobre os modelos atômicos e orbitais para
fundamentar seus conceitos sobre a estrutura da matéria. Na próxima aula, sairemos da
eletrosfera e entraremos no núcleo atômico.












