Reprodução
4
Hidrogênio
Lítio
Sódio
Potássio
Rubídio
Césio
3
2
8
1
4
24,0
12
9,0
5
6
7
2
8
8
1
20
2
8
8
2
2
8
2
2
2
Escândio
21
IIIB
3
2
8
9
2
22
IVB
4
2
8
18
8
1
38
40,0
2
8
18
18
8
1
56
88,0
2
8
18
32
18
8
1
88
137,0
226,0
2
8
18
32
18
8
1
2
8
18
18
8
1
2
8
18
8
1
89 - 103
Ac - Lr
Série dos
Actinídios
Massa Atômica Aproximada
Metais
57 - 71
La - Lu
89,0
2
8
18
9
2
2
8
18
10
2
2
8
11
2
2
8
18
32
10
2
73
93,0
41
51,0
2
8
18
32
11
2
2
8
18
12
1
74
96,0
42
52,0
2
8
18
32
12
2
2
8
18
13
1
75
99,0
43
55,0
2
8
18
32
13
2
2
8
18
13
2
2
8
13
2
76
101,0
44
56,0
2
8
18
32
14
2
2
8
18
15
1
2
8
14
2
77
103,0
45
59,0
27
2
8
18
1
2
8
18
32
32
10
2
105
181,0
2
8
18
32
32
11
2
106
184,0
2
8
18
32
32
12
2
107
186,0
2
8
18
32
32
13
2
108
190,0
2
8
18
32
32
14
2
109
192,0
2
8
18
32
32
15
2
2
8
18
32
32
16
2
2
8
18
25
8
2
110
63
195,0
2
8
18
32
17
1
2
8
18
18
111
197,0
79
108,0
47
63,5
262,0
263,0
2
8
18
2
2
8
3
2
8
18
18
9
2
58
2
8
18
19
9
2
59
2
8
18
21
8
2
60
262,0
2
8
18
21
8
2
61
265,0
2
8
18
23
8
2
62
266,0
2
8
18
24
8
2
112,0
80
48
65,5
64
2
8
18
25
9
2
65
200,5
2
8
18
27
8
2
2
8
18
32
18
2
2
8
18
18
2
115,0
81
49
70,0
31
27,0
66
204,0
2
8
18
28
8
2
2
8
18
32
18
3
2
8
18
18
3
2
8
18
3
67
207,0
82
119,0
50
72,5
32
28,5
14
12,0
Al Si
13
11,0
2
8
18
4
2
8
4
2
4
2
8
18
29
8
2
2
8
18
32
18
4
2
8
18
18
4
122,0
83
51
75,0
33
31,0
P
15
14,0
2
5
2
8
18
5
2
8
5
68
209,0
2
8
18
30
8
2
2
8
18
32
18
4
2
8
18
18
5
69
210,0
84
128,0
52
79,0
34
32,0
S
16
16,0
2
8
18
6
2
8
6
2
8
7
2
8
18
31
8
2
2
8
18
32
18
4
2
8
18
18
5
70
210,0
85
127,0
I
53
80,0
35
35,5
2
8
18
30
8
2
2
8
18
32
18
7
2
8
18
18
7
2
8
18
7
71
222,0
86
127,0
54
Xe
84,0
36
40,0
18
20,0
Cl Ar
17
19,0
F Ne
140,0
141,0
2
8
18
32
18
9
2
90
2
8
18
32
18
10
2
91
2
8
18
32
18
9
2
92
144,0
2
8
18
32
21
9
2
93
147,0
2
8
18
32
22
9
2
94
150,0
2
8
18
32
24
8
2
95
152,0
2
8
18
32
25
8
2
96
157,0
2
8
18
32
25
9
2
97
159,0
2
8
18
32
27
8
2
98
162,5
2
8
18
32
28
8
2
99
165,0
2
8
18
32
29
8
2
100
167,0
2
8
18
32
30
8
2
101
169,0
2
8
18
32
31
8
2
102
173,0
2
8
18
32
32
8
2
103
175,0
227,0
231,0
Semimetais
232,0
238,0
244,0
Não-metais
237,0
243,0
247,0
Gases nobres
247,0
251,0
254,0
257,0
258,0
259,0
260,0
Ac Th Pa U Np Pu Am Cm Bk Cf Es Cd Md No Sb
89
Série dos Actinídios
139,0
2
8
18
32
18
8
2
8
18
18
8
2
8
18
8
2
8
8
2
8
2
2
8
18
32
32
8
2
2
8
18
30
8
2
10
2
7
9
2
5
8
N O
7
4,0
VIIA
2
Zero
VIA
17
He
16
La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
57
Série dos Lantanídios
261,0
2
8
18
32
32
18
2
2
8
18
32
18
1
2
8
18
18
1
30
IIB
12
C
6
VA
15
Pt Au Hg Ti Pb Bi Po At Rn
78
106,0
46
59,0
2
8
16
2
29
IB
Unq Unp Unh Uns Uno Une Uun Uuu
104
178,5
2
8
18
32
15
2
2
8
18
16
1
2
8
15
2
28
11
B
2
3
IVA
14
18
V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
2
8
13
2
26
Hf Ta W Re Os Ir
72
91,0
40
48,0
2
8
10
2
24
25
VIIB VIIIB VIIIB VIIIB
VB
VIB
5
23
Elementos de Transição
8
6
9 10
7
5
IIIA
13
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te
39
45,0
Série dos
Lantanídios
Símbolo
Número Atômico
223,0
Fr Ra
87
133,0
Cs Ba
55
85,5
Rb Sr
37
39,0
K Ca Sc Ti
19
23,0
Cálcio
Na Mg
11
7,0
Li Be
2
1
Berílio
Magnésio
2
3
IIA
Titânio
Háfnio
Unilquádio
Estrôncio
Vanádio
Nióbio
Tantálio
Unilpêntio
Cério
Tório
Bário
Cromo
Molibdênio
Tungstênio
Unilhêxio
Praseodímio
Protactínio
1,0
Unilséptio
Neodímio
Urânio
Frâncio
Nome do elemento
Unilóctio
Promécio
Neptúnio
1
Samário
Plutônio
Rádio
Manganês
Rênio
Molibdênio
Ferro
Ósmio
Rutênio
Cobalto
Ródio
Irídio
Unilênio
Paládio
Platina
Ununílio
Európio
Amerício
Ítrio
Elétrons nas camadas
Cobre
Prata
Ouro
Ununúnio
Gadolínio
Cúrio
H
Térbio
Berquélio
1
Disprósio
Califórnio
2
Hólmio
Einstênio
1
Érbio
Férmio
IA
Túlio
Mendelévio
Zircônio
Zinco
Cádimo
Mercúrio
Índio
Tálio
Telúrio
Níquel
Boro
Alumínio
Gálio
Carbono
Silício
Estanho
Chumbo
Antimônio
Bismuto
Iodo
Astato
Itérbio
Nobélio
Lantânio
Actínio
Lutécio
Número do período
Polônio
Xenônio
Radônio
Germânio
Nitrogênio
Fósforo
Arsênio
Flúor
Cloro
Bromo
Oxigênio
Enxofre
Selênio
Hélio
Neônio
Argônio
Criptônio
22
Lawrêncio
1
Tabela Periódica
Os elementos na crosta terrestre
Corel
Na Terra foram encontrados 90 elementos, sendo que apenas oito constituem
mais de 90 % da massa da crosta terrestre.
Esses oito elementos são o oxigênio, o silício, o alumínio, o ferro, o cálcio,
o sódio, o potássio e o magnésio.
Oxigênio
Silício
Alumínio
Ferro
Cálcio
Sódio
Potássio
Magnésio
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
49,5 %
25,8 %
7,6 %
4,7 %
3,4 %
2,6 %
2,4 %
1,9 %
Todos os outros elementos aparecem em
quantidades inferiores a 1%.
Os elementos na atmosfera terrestre
Corel
Três elementos constituem mais de 90 % em volume da atmosfera da Terra.
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
Nitrogênio
78,08 %
Oxigênio
20,95 %
Argônio
0,93 %
23
Outros elementos, muito raros, presentes na atmosfera são o neônio, o hélio, o
kriptônio e o xenônio.
Os elementos no corpo humano
○
○
Quatro elementos constituem mais de 90 %
da massa do corpo humano. Esses quatro elementos são o oxigênio, o carbono, o hidrogênio
e o nitrogênio.
○
○
○
Ilustrações: Carlos Cesar Salvadori
○
○
○
○
○ ○
○
○○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
Cálcio
1,4 %
Fósforo
1,0 %
Sódio
0,35 %
Enxofre
0,25 %
Outros elementos
1%
○
○
Oxigênio
65 %
Carbono
Hidrogênio
18 %
10 %
Nitrogênio
3%
○
○
○
○
○○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
Outros elementos
mais raros são vitais para
o bom funcionamento do
corpo humano. Exemplos
desses elementos mais raros são o cálcio, o fósforo,
o sódio e o enxofre.
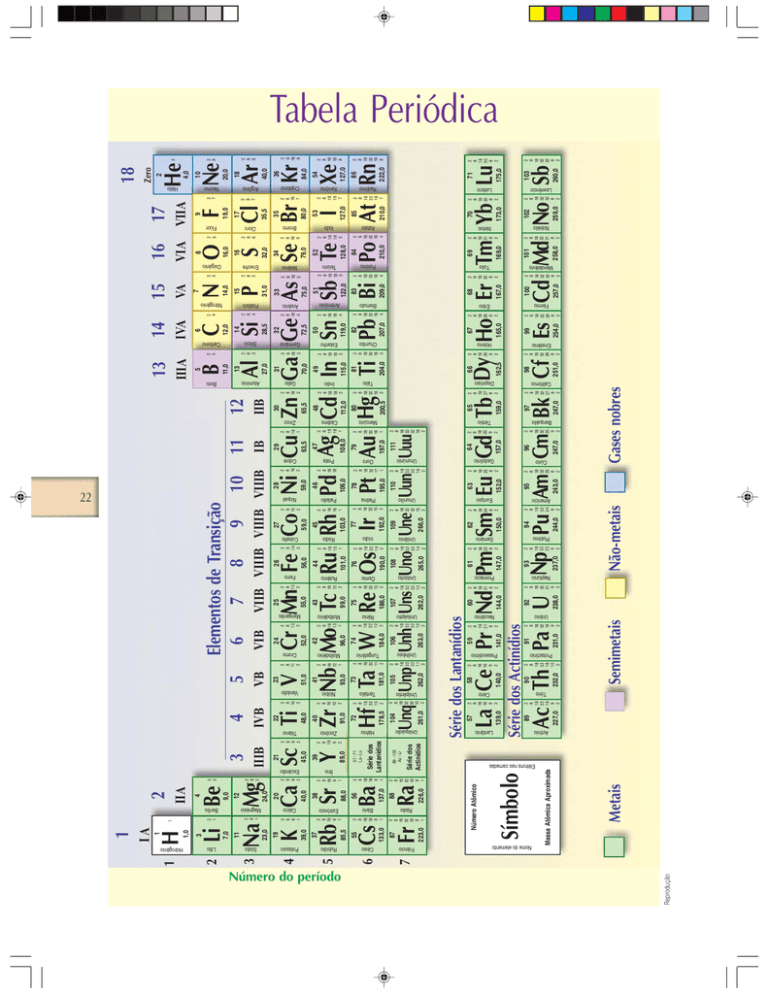
Os metais, os não-metais e os semimetais
Os elementos são classificados em metais, não-metais e semimetais.
Ser metal significa que o elemento pode ser dobrado, pode ser transformado em lâminas e em fios, tem brilho, conduz calor e corrente elétrica.
Em condições-ambiente, os metais são sólidos, com exceção do metal gálio
e do metal mercúrio que são líquidos.
Ser não-metal significa que o elemento não pode ser dobrado, não pode
ser transformado em lâminas, nem em fios, não tem brilho, não conduz calor e
nem eletricidade.
Em condições-ambiente:
• os não-metais carbono, fósforo, enxofre, selênio e iodo são sólidos;
• o não-metal bromo é líquido;
• os não-metais nitrogênio, oxigênio, flúor e cloro são gases.
Ser semimetal significa que o elemento combina propriedades dos metais e dos não-metais.
Em condições-ambiente, os semimetais são todos sólidos.
O hidrogênio é considerado um caso à parte, devido às suas propriedades
muito especiais. Em condições-ambiente o hidrogênio é um gás.
Os gases nobres
A característica mais importante dos gases nobres é o fato de muito dificilmente se combinarem com outros elementos. Em condições-ambiente são todos gases.
Os isótopos
Vamos considerar os átomos que formam o elemento hidrogênio.
Todos os átomos de hidrogênio apresentam no seu
núcleo um próton.
Entretanto, na natureza:
• 0,015 % dos átomos de hidrogênio apresenta
no núcleo além de um próton também um
nêutron;
• uma porcentagem muito pequena dos átomos
de hidrogênio apresenta no núcleo, além de
um próton, também dois nêutrons.
1
H
1
2
H
1
3
H
1
Os átomos que apresentam igual número de prótons e diferente número de
nêutrons nos seus núcleos são chamados isótopos.
Um isótopo é identificado pelo nome (ou símbolo) do elemento seguido
pelo número de massa. Dessa maneira, os isótopos de hidrogênio são identificados como hidrogênio –1, hidrogênio –2 e hidrogênio –3.
Carlos Cesar Salvadori
24
Na natureza, o elemento hidrogênio existe formado por três isótopos, o hidrogênio –1, o hidrogênio –2 e o hidrogênio –3. O hidrogênio –1 também é chamado prótio, o hidrogênio –2, deutério e o hidrogênio –3, trítio.
Na natureza, quase todos os elementos são formados por isótopos.
Veja, na tabela abaixo, alguns exemplos de isótopos encontrados na natureza.
Nome do isótopo
Número massa Número prótons Número nêutrons
% em átomos
Número atômico
Hidrogênio – 1
99,985 %
1
1
1
0
Hidrogênio – 2
0,015 %
1
2
1
1
Hidrogênio – 3
muito pequena
1
3
1
2
Carbono –12
98,89 %
6
12
6
6
Carbono –13
1,11 %
6
13
6
7
Nitrogênio –14
99,63 %
7
14
7
7
Nitrogênio –15
0,37 %
7
15
7
8
Oxigênio –16
99,759 %
8
16
8
8
Oxigênio –17
0,037 %
8
17
8
9
Oxigênio –18
0,204 %
8
18
8
10
100 %
9
19
9
10
Flúor –19
25
Exemplos importantes de isótopos naturais são o hidrogênio –2 e o carbono –12.
O hidrogênio –2 tem-se mostrado extremamente importante em pesquisas modernas.
O carbono –12 é o padrão na escala de massas atômicas usado pelos
físicos e pelos químicos.
○
○
7. Em condições-ambiente os metais são
do gálio e do mercúrio que são metais
, com exceção
.
e
.
○
○
,
;é
.
10. Um elemento ser semimetal significa que ele
propriedades dos metais e propriedades dos não-metais.
11. Em condições-ambiente os semimetais são
.
12. Os átomos isótopos são átomos que apresentam
número de prótons e
número de nêutrons nos seus
núcleos.
○
○
6. Cite cinco características de um metal.
○
○
5. Os elementos são classificados em
9. Em condições-ambiente são sólidos os não-metais
; são gases os não-metais
líquido o não-metal
○
○
são
○
são naturais e
○
4. De um total de 111 elementos,
elementos artificiais.
8. Cite cinco características de um não-metal.
○
○
3. O número atômico permite
os átomos de um elemento
dos átomos de outro elemento.
○
○
○
número
○
2. Todos os átomos de um elemento têm o
atômico.
○
○
1. Um elemento é uma substância formada por átomos que
possuem o
número de
em seu núcleo.
○
○
Leia atentamente as frases 1 a 13. Copie-as e complete-as
com a palavra adequada.
○
NÃO ESCREVA NO LIVRO
13. Na natureza quase todos os elementos ocorrem formados
por
.












