TRANSFORMAÇÕES ESPONTÂNEAS
Entropia
Uma reacção diz-se espontânea se ocorre quando se juntam os reagentes em
determinadas condições de pressão, temperatura, pressão, concentração, etc.
Energia de Gibbs e Equilíbrio
Por exemplo,
À temperatura ambiente, o sódio reage
espontanea e irreversivelmente com água,
com libertação de calor
Disciplina Química II
Na + H2O
MEQ, 2º semestre 2013/14
NaOH + ! H2
Ana Margarida Martins
Há reacções espontâneas que requerem energia do exterior. Por exemplo,
O NH4NO3 dissolve-se espontaneamente em água, à temperatura ambiente,
Outras reacções podem não ser espontâneas à temperatura ambiente, mas sê-lo
a temparaturas mais elevadas, como, por exemplo, a decomposição de HgO
absorvendo energia,
NH4NO3(s)
2HgO(s)
+ energia
H 2O
NH4+(aq) + NO3"(aq)
2Hg(l) + O2(g)
!H0 = 90,7 kJ
Outras reacções ainda, embora favoráveis do ponto de vista entálpico, não
ocorrem espontaneamente sem uma fonte de ignição, como a combustão do
A adição do sólido provoca uma
diminuição da temperatura da
metano
CH4(g) + 2O2(g)
CO2(g) + 2H2O(l)
!H0 = "890,4 kJ
solução
A entalpia não é, por si só, capaz de dar indicação sobre a
O PROCESSO NÃO É FAVORÁVEL
espontaneidade ou não espontaneidade de uma reacção. Para
DO PONTO DE VISTA ENERGÉTICO
isso é necessário introduzir uma outra grandeza termodinâmica
MAS É ESPONTÂNEO
denominada Entropia
ENTROPIA
Consideremos um gás contidas no recipiente.
NOS PROCESSOS ESPONTÂNEOS HÁ
DISPERSÃO DE ENERGIA
Se abrirmos a torneira que liga os dois reservatórios, as partículas do gás
distribuem-se pelos dois recipientes. Este processo espontâneo ocorre
quando eliminamos o constrangimento que impede a passagem de gás de
A energia flui de um estado inicial em que estava
mais concentrada para um estado final em que
está mais dispersa.
um para o outro lado.
A Propriedade Termodinâmica que traduz a dispersão de energia é a
Entropia, S
balão com gás
balão em vácuo
Porque ocupam um volume maior, os
movimentos das partículas são mais
desordenados e distribuem-se por um
número maior de posições (estados)
Quando se abre a válvula o gás
expande-se irreversivelmente
2ª LEI DA TERMODINÂMICA
UM PROCESSO ESPONTÂNEO CONDUZ A UM
AUMENTO DE ENTROPIA DO UNIVERSO
#H = 0
2ª Lei da Termodinâmica
DISPERSÃO DE MATÉRIA E DE ENERGIA
A entropia (S) é uma medida do número de microestados disponíveis para as
partículas de um sistema, que aumenta com a desordem do sistema
uma reacção é espontânea se #S para o
universo é positivo.
#Suniverso = #Ssistema + #Svizinhança
#Suniverso > 0 para processos espontâneos
isto é, num sistema ordenado o número de posições que cada partícula pode
ocupar é menor que num sistema desordenado
Quando o volume do recipiente aumenta,
aumenta o número de microestados:
A ENTROPIA AUMENTA
microestado: especifica um arranjo particular possível das partículas
Para uma mesma substância,
Entropia, S
a entropia depende do seu estado físico:
S (sólido) < S (líquido) << S (gás)
sólido
líquido
gás
O aumento da complexidade molecular
conduz, em geral, a um aumento de
entropia.
metano
O número de microestados possíveis
aumenta
etano
propano
S˚(Br2 liq) < S˚(Br2 gas)
S˚(H2O sol) < S˚(H2O liq)
Entropia, S
Entropia, S
S0[H2O(l)] é pequena devido às forças
intermoleculares fortes que existem entre
Substância
S0 (J/K.mol)
H2O(l)
69,9
H2O(g)
188,7
I2(s)
116,7
I2(g)
260,6
He(g)
126,1
Ne(g)
146,2
as moléculas.
S0[He(g)]
é menor que a
S0[Ne(g)]
Num sólido cristalino a entropia
aumenta quando diminuem as forças de
ligação entre as partículas constituintes
do cristal.
porque
as forças intermoleculares entre átomos de
Ne são mais fortes, uma vez que tem um
maior número de electrões que o He.
Óxido de Magnésio
Fluoreto de Sódio
26,9 J/K•mol
51,5 J/K•mol
Para um sólido iónico
quanto maior for a
carga dos iões menor
é a entropia
Os líquidos ou sólidos dissolvem-se
espontaneamente num solvente devido
a um aumento de entropia.
No processo há dispersão de matéria (e
energia) em relação ao estado inicial
A ENTROPIA DE UM SISTEMA AUMENTA COM A TEMPERATURA
causa um aumento dos
movimentos moleculares que
resulta num aumento de
tempo
Aquecimento
do vapor
Um aumento de temperatura
entropia do sistema
Entropia, S0
Entropia, S
Aquecimento do líquido
Vaporização
do líquido
Fusão do sólido
Temperatura (K)
3ª LEI DA TERMODINÂMICA
A ENTROPIA DE UM CRISTAL PERFEITO TENDE PARA ZERO À
MEDIDA QUE A TEMPERATURA TENDE PARA O ZERO ABSOLUTO
#So
Para uma Reacção
= " So (productos) - " So (reagentes)
2 H2(g) + O2(g)
2 H2O(liq)
#So = 2 So (H2O) - [2 So (H2) + So (O2)]
A entropia de uma substância a uma dada temperatura pode obter-se medindo
o calor necessário para aumentar a temperatura desde 0 K até essa
#So = 2 mol (69.9 J/K·mol) - [2 mol (130.7 J/K·mol) + 1 mol (205.3 J/K·mol)]
temperatura desde que o processo ocorra de forma reversível.
#S = qrev/T
!So = -326.9 J/K
a variação de entropia é negativa porque
3 mol de gás dão 2 mol de líquido
2 H2(g) + O2(g)
2 H2O(liq)
!So
Cálculo de !Souniverso
= -326.9 J/K
A variação de entropia do sistema é negativa
2 H2(g) + O2(g)
2 H2O(liq)
#Souniverso = #Sosistema + #Sovizinhança
mas a reacção é espontânea
!Sovizinhança = qrev vizinhança / T
A variação de entropia do universo é positiva
= -qrev sistema / T = - !Hosistema / T
#Hosistema = 2 Hfo (H2O, l) - [2 Hfo (H2) + Hfo (O2)]
#Hosistema = 2(-285.83) kJ/mol = -571.66 KJ/mol
#Sovizinhança = 571.66x103 / (273.15+25) = 1917 J/K
!Souniverso = 1917 - 327 = 1590 J/K
A ENTROPIA DO UNIVERSO AUMENTA
Critérios de Espontaneidade
!H0 (sistema)
!S0 (sistema)
Classificação do Processo
Exotérmico, <0
Positiva, >0
Espontâneo a todas as
temperaturas; !S0 (universo)>0
Negativa, <0
Espontâneo a baixas
temperaturas; depende dos
valores relativos de !H0 e !S0
Endotérmico, >0
Positiva, >0
Espontâneo a temperaturas
elevadas; depende dos valores
relativos de !H0 e !S0
Endotérmico, >0
Negativa, <0
Independentemente da
temparatura, nunca é espontâneo;
!S0 (universo)<0
Exotérmico, <0
Lembre-se que
–#H˚sis é proporcional a #S˚viz
Um processo exotérmico tem #S˚viz > 0
A REACÇÃO ESTÁ DESLOCADA
NO SENTIDO DA FORMAÇÃO
DOS PRODUTOS
Energia Livre de Gibbs, G
#Suniv = #Sviz + #Ssis
!Suniv =
"!Hsys
T
+ !Ssys
J. Willard Gibbs
Se multiplicarmos por -T
1839-1903
-T#Suniv = #Hsis - T#Ssis
-T#Suniv = variação da energia de Gibbs do
sistema = #Gsistema
Em condições padrão —
#Gosis = #Hosis - T#Sosis
Num processo espontâneo,
#Suniv = #Sviz + #Ssis >0
#Go = #Ho - T#So
Variação da energia de Gibbs =
variação de energia total do sistema - energia perdida
na dispersão de energia
#Gosis = #Hosis - T#Sosis <0
Se a reacção é
• exotérmica (#Ho negativo) e a entropia aumenta (#So
Um processo que ocorre à temperatura T é espontâneo
quando as variações de entalpia e de entropia são tais
que !H ! T!S < 0
positivo )
• logo, #Go é NEGATIVO
• A reacção é espontânea (product-favored).
#Go = #Ho - T#So
Energia de Gibbs, G
Se a reacção é
• endotérmica
#Go = #Ho - T#So
(#Ho positive)
• e a entropia diminui
(#So negative)
• Então #Go é POSITIVO !
• A reacção é não-espontânea (isto é, reactant-favored).
#Ho
#So
#Go
exo(–)
aumento(+) –
Prod-favored
endo(+)
diminuição(-)
exo(–)
diminuição(-)?
Dependente T
endo(+)
aumento (+)?
Dependente T
+
Reacção
React-favored
Energia de Gibbs, G
#Go
=
#Ho
-
2 métodos para calcular
T#So
#r
"
(produtos) - "
#fGo
condições padrão.
energia de Gibbs de formação padrão,
como a variação de energia de energia de Gibbs que corresponde à síntese de uma
b)Usar valores tabulados de energias livres
de formação, #fGo.
#fGo
variação de energia de Gibbs padrão,
como a variação de energia de energia de Gibbs de uma reacção efectuada em
Define-se !Gf0 ,
#Go
a)Determinar #rHo e #rSo e usar a equação
de Gibbs.
Go =
Define-se !G0 ,
(reagentes)
mole de um composto a partir dos seus elementos no estado padrão.
Para uma reacção,
aA + bB
cC + dD
!Gr0 = " (n!Gf0(produtos) # m!Gf0(reagentes))
onde n e m são os coeficientes estequiométricos
Cálculo de !Gor
#rGo = " #Gfo (produtos) - " #Gfo (reagentes)
C(grafite) + O2(g)
CO2(g)
#rGo = #fGo(CO2) - [#fGo(graf) + #fGo(O2)]
#rGo = -394.4 kJ - [ 0 + 0]
#rGo = -394.4 kJ
favored
A reacção é product-
Para um elemento ou para um composto elementar
no estado padrão !fG˚ = 0
Energia de Gibbs e Temperatura
2 Fe2O3(s) + 3 C(s)
#r
Ho =
+467.9 kJ
4 Fe(s) + 3 CO2(g)
#r
#rGo = +300.8 kJ
So
ENERGIA DE GIBBS E EQUILÍBRIO QUÍMICO
Quando não estamos em condições padrão, por exemplo durante uma reacção
(mesmo que no início os reagentes e produtos estejam nas condições padrão elas
= +560.3 J/K
variam ao longo do tempo),
A reacção não ocorre a 298 K
!G = !G0 + RT lnQ
onde Q representa o quociente reaccional
A que temperatura é que a reacção é possível? Isto é, a
que temperatura o valor de #rGo passa de (+) para (-)?
#rGo = 0 = #rHo - T#rSo
Em qualquer instante define-se quociente reaccional, Q, como a razão entre as
concentrações de produtos e reagentes no instante considerado.
!r H
467.9 kJ
T=
=
= 835.1 K
!r S
0.5603 kJ/K
No equilíbrio,
A expressão
#
#
#rGo = - RT lnK
#!G = !G0 + RT lnQ
Para a reacção N2O4
transforma-se em
#rGo = +4800 J = - (8.31 J/K)(298 K) ln K
Substituindo !G0 na expressão anterior obtém-se
!G = RT ln
2 NO2
#rGo = +4.8 kJ
!G0 = "RT lnK
!G = "RT lnK + RT lnQ
Calcular Keq
Q = Keq e !G = 0
ln K = -
Q
K
K = 0.14
4800 J
= -1.94
(8.31 J/K)(298K)
#rGo > 0
K<1
!G, !G˚ e Keq
Product Favored, !G˚ negative, K > 1
• #G é a variação de energia livre em condições
não-padrão
• #G está relacionado com #G˚
• #G = #G˚ + RT ln Q
onde Q = quociente reaccional
• Quando Q < K ou Q > K, a reacção é espontânea
• Quando Q = K a reacção está no equilíbrio
• Quando #G = 0 a reacção está no equilíbrio
• Logo, #G˚ = - RT ln K
Reactant Favored, !G˚ positive, K < 1
Q<K
!G = RT ln
Q
K
<0
a reacção evolui no sentido directo
Q=K
!G = RT ln
Q
K
=0
a reacção atingiu o equilíbrio
Q>K
!G = RT ln
Q
K
>0
a reacção evolui no sentido inverso
K >> 1
!G0 < 0
em condições padrão a é espontânea
(product favored)
K >> 1
!G0 = 0
em condições padrão a reacção
está no equilíbrio
K >> 1
!G0 > 0
em condições padrão a reacção
não é espontânea (reactant favored)
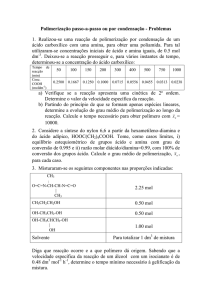
PROBLEMAS
1. A variação da energia de Gibbs padrão para a reacção
3NO(g)
N2O(g) + NO2(g)
é "104,18 kJ. Calcule a constante de equilíbrio da reacção a 25 °C.
2. Calcule as constantes de equilíbrio para a reacção inversa à do problema 1 e
para a reacção inversa à do problema 1 multiplicada por !.
Compare os resultados obtidos.
3. Calcule a variação de energia de Gibbs para a reacção do problema 1, a 25 °C,
quando as pressões parciais dos três gases são 0,0010 atm.
4. Calcule a constante de equilíbrio a 25 °C para a seguinte reacção
2H2O(l)
Comente o resultado obtido.
Dados: !Hf0[H2O(l)] = "237,2 kJ/mol
2H2(g) + O2(g)