Preparação do cloreto
de
terc-butila
Substituição Nucleofílica Alifática
Tatiana Verissimo
Métodos mais comuns de
Preparação de Haletos de Alquila
• Halogenção direta de alcanos,para a
formação direta de cloretos e brometos de
alquila (mistura de isômeros de dificil
separação).
H3C-CH2-CH3 + Cl2 → H3C-CH-CH3 + H3C-CH2 –CH2
propano
Cl
2-cloropropano
Cl
1-cloropropano
Métodos mais comuns de
Preparação de Haletos de Alquila
• Adição de ácidos halogenidricos em
alcenos.
H3C-CH=CH2 + HCl →
propeno
H3C-CH-CH3
|
Cl
2-cloropropano
Métodos mais comuns de
Preparação de Haletos de Alquila
• Conversão de álcoois em haletos de
alquila por reações SN1 e SN2.
CH3
CH3
|
|
H3C - C-OH + HCl → H3C - C-Cl
|
|
CH3
CH3
álcool t-butílico
+ H 2O
cloreto de t-butila
Reações de Substituição
Nucleofílica
São aquelas reações em que o grupo que
entra fornece um par de elétrons para
nova ligação covalente e o grupo que sai
leva consigo o par de elétrons da ligação
quebrada
Reações de Substituição
Nucleofílica
-
-
Nü + R X
Nucleófilo
R Nü + X
Substrato
(haleto de alquila)
Produto
H
Nü
-
Centro que o
nucleófilo procura
H
H
δ+
δ-
C
X
Íon haleto
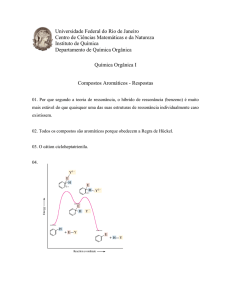
As reações de substituição
nucleofílica podem ser de dois
tipos:
• SN1:Substituição nucleofílica unimolecular
• SN2:Substituição nucleofílica bimolecular
Substituição Nucleofílica SN1
• A velocidade da reação depende somente
da concentração do substrato,
• Cadeia ramificada (impedimento estérico),
• Há formação de carbocátion,
• Os nucleófilos são fracos,
• O solvente utilizado é polar e prótico,
Substituição Nucleofílica SN1
(CH3)3COH + H3O+ + Cl(CH3)3CCl + 2H2O
Etapa 1:
CH3
H3C C Cl
CH3
H2O
Com ajuda do
solvente polar, o
átomo de cloro se
afasta com o par de
elétrons que o ligava
ao carbono
Etapa 2:
CH3
H3C C +
CH3
ácido de Lewis
CH3
C+ terciário
H3C C + + Cl- estável
CH3
lenta
Produtos solvatados e
estabilizados pela H2O
rápida
:OH2
base de
Lewis
CH3
H3C C O+ H
CH3 H
Substituição Nucleofílica SN1
Etapa 3:
CH3
H3C C O+ H
CH3 H
:OH2
rápida
base de
Bronsted
(aceita um
próton)
CH3
H3C C O H + H3O+
CH3
Substituição Nucleofílica SN2
• A velocidade da reação depende da
concentração do substrato e do nucleófilo,
• O substrato não deve ser impedido
estericamente,
• Não há formação de carbocátion,
• Os nucleófilos devem ser fortes e
concentrados,
• O solvente utilizado é polar e aprótico,
• E ocorre inversão de configuração.
Substituição Nucleofílica SN2
Reação envolvida na classe Sn2
Eliminação unimolecular (E1)
O mecanismo E1 é semelhante com a reação SN1.
Forma-se um carbocátion na primeira etapa e a
velocidade da reação só depende da concentração do
substrato. Ambos são favorecidos pelos mesmos
fatores.
E!
SN1 x E1
SN1 – CARBOCÁTIONS ESTÁVEIS,
NUCLEÓFILOS FRACOS,
SOLVENTES POLARES,
BAIXAS TEMPERATURAS,
E1 – CARBOCÁTIONS ESTÁVEIS,
NUCLEÓFILOS FRACOS,
SOLVENTES POLARES,
ALTAS TEMPERATURAS
Propriedades dos compostos utilizados
Compostos
Álcool tercbutílico
Cloreto de
terc-butila
Bicarbonato
de sódio
Ácido
clorídrico(em
solução)
Cloreto de
cálcio
Fórmula
Molecular
C4H10O
C4H9Cl
NaHCO3
HClágua
CaCl2
Ponto de
ebulição(0C)
82.9
51
-
114
Maior que
16002,152
Ponto de
fusão(0C)
25.5
-26.5
270,perde CO2
-85
772
Densidade
(g.cm3)(250C)
0,779
0,847
2,159
1,187
2,152
Peso
Molecular(g.
mol-1)
73,96
92,57
34,01
36,46
110,98
Solubilidade
Água,éter e
álcool
Álcool e éter.
Insolúvel em
água
Água.
Insolúvel em
álcool
Água,álcool
Éter e
benzeno
Água e
álcool
Pouco
tóxico;não
inflamável
Tóxico por
inalação,
irritante para
os olhos e
pele; não
inflamável
Pouco tóxico
Toxidade
Irritação nos
olhos e na
pele;
inflamável
Tóxico(inalaçã
o prolongada);
inflamável
Agente secante
•Forma com a água um sal Hexa-hidratado
(CaCl2.6H2O), em temperatura inferior a 30°C.
devido a presença , como impureza, de fabricação ,
de hidróxido de cálcio ou de cloreto básico,
•Não deve ser usado nas secagens ácidas ou de
líquidos ácidos,
•Não deve ser empregado nas secagens de alguns
compostos carbonílicos, de ésteres , álcoois, fenóis,
aminas, e amidas, em virtude de reagir
quimicamente com esses compostos.
Procedimento experimental
Preparação do
cloreto de terc-butila
Aparelhagem
• Reação: funil de
separação
Aparelhagem
• Filtração simples
Aparelhagem
• Destilação simples
Técnicas utilizadas
• Lavagem: Adição do NaHCO3 para retirada do
excesso de ácido.
• Secagem de solução:retirada de água por
agentes inorgânicos e minerais
• Filtragem simples eliminação do agente secante
da solução que é o CaCl2
• Destilação simples: purificação do cloreto de
terc-butila
25g de álcool t-butílico em funil de separação de 25Oml
1.Adicionar 85mL de
HCl concentrado
2.Agitar a mistura por 30 segundos a cada cinco minutos
durante 20 minutos
3.deixar em repouso
para separação das fases
Fase aquosa (inferior):
H3O+, Cl-- ; traços de álcool t butílico; traços de Cloreto de t-butila
Fase aquosa (inferior): Na+ Cl- ;Na+
HCO3- ; traços de cloreto de tbutila; traços de álcool t-butílico
Fase orgânica (superior): cloreto de t-butila;
traços de álcool t butílico; HCl ;H2O
1.Transferir para Béquer
2.Lavar com 20mL de NaHCO3
3.Transferir para o funil de
separação
Cloreto de t-butila (superior):
Traços de álcool t-butillico; traços de
H2O; Na+ Cl- ; Na+ HCO3Lavar com
20 mL de
água destilada
Fase aquosa (inferior): Na+ Cl- ; Na+ HCO3-;
traços de cloreto de
t-butila; traços de álcool t-butílico
Cloreto de t-butila (superior); traços
de Na+ HCO3-; traços de Na+ Cl- ; H2O
; traços de álcool t-butílico
Transferir Para erlenmeyer De 125 mL
Cloreto de t-butila (superior); traços de Na+ HCO3-; traços
de Na+ Cl- ; H2O ; traços de álcool t-butílico
secar o produto com 5g de
CaC12 anidro
filtrar em papel pregueado, e
recolhendo a fase orgânica
em balão de
destilação de
100mL.
Sólido retido no filtro:
NaCl ,CaCl2.6H2O;
NaHCO3; traços de
cloreto de t-butila;
traços de álcool tbutílico
Resíduos: de cloreto
de t-butila; NaCl;
CaCl2.6H2O; traços de
álcool t-butílico
Filtrado: cloreto de t-butila: traços de
CaCl2.6H2O; traços de Na+ Cl- ; traços de
H2O; traços de álcool de t-butílico
1) Tarar um erlenmeyer.
2) Destilar oproduto na faixa
49-51°C. (temperatura
constante)
3) Calcular o rendimento.
4) Corrigir o p.e.
Destilado: cloreto de t-butila
Recolher em frasco com tampa.
Rotular indicando:
Nome do produto
Volume
Faixa destilação
Membros do grupo
Data
REAÇÕES ENVOLVIDAS:
•Reação de formação do cloreto de terc-butila:
(CH3)3OH + H3O+ + Cl-
(CH3)3Cl + 2H2O
REAÇÕES ENVOLVIDAS:
• Eliminação de ácido que possa estar em
excesso:
NaHCO3 + HCl
→
Na+ Cl- + CO2 + H2O
• Eliminação da água através do agente secante:
CaCl2 + 6 H2O →
CaCl2.6H2O
Reação concorrente (E1)
•
Uma reação paralela que pode ocorrer é a eliminação de um
próton do carbocátion formando um alceno.
Cálculos
- Volume a ser utilizado de álcool t-
butílico:
m
25,00 g
d = → 0,78 g mL =
V
VmL
V= 32,05mL de álcool t-butílico
Cálculos
- Cálculo da massa de HCl que reage
com 25,00 g de t-butanol:
1 mol de t-butanol ---------- 1 mol de HCl
73,96 g ---------- 36,5 g
25,00 g ---------- Y
Y = 12,34 g de HCl
Cálculos
Cálculo do volume de HCl necessário para
reagir com 25g de álcool t-butílico:
HCl conc. = 35,5% , d(HCl) = 1,19 g/ mL
Volume de HCl utilizado = 85,00mL
100 g de solução de HCl ------ 35,5 g de HCl
100
m
= 84,04mL
d = →V =
1,19
V
Cálculos
100 g de sol.(que contém 35,5g de HCl)-------84,04 mL
Z
---------- 85,00 mL
Z = 35,75 g de HCl contidos em 85,00 mL de
solução.
Cálculos
- Cálculo da massa de cloreto de tbutila obtida na reação com 25,00 g
de álcool t-butílico:
1 mol de t-butanol ---- 1 mol de cloreto de t-butila
73,96g --------------- 92,57g
25,00g --------------- X
X= 31,30g de cloreto de t-butila para 100%
de rendimento.
Cálculos
- Fator de Correção do ponto de ebulição
à pressão de 1 atm:
P.E.=Tobs+ ΔT
ΔT =1,2x10-4(760 – p)(Tobs + 273)
Supondo:Tobs = 45oC( 318K) e p = 709 mmHg
ΔT =1,2x10-4.(760 – 709).(318 + 273) =
=3,61K( 3,61o C)
Cálculos
Cálculo do rendimento:
Rendimento exp. =
Rendimento exp. =
massa (exp .)
100
massa(calc.)
massa (exp)
100
31,30 g
O rendimento de uma reação raramente é 100%,
devido a possíveis fontes de erro.
Fontes de erro
• Há possibilidade da reação não ser completa;
• Ocorrência de reações secundárias
concorrentes;
• A insuficiência de um reagente em relação ao
outro;
• Impurezas dos reagentes utilizados;
• Lavagem incorreta;
• Contaminação dos materiais.
Resíduos
Os resíduos devem ser
colocados em frasco
especial devido a
presença de terc-butila,
que posteriormente será
incinerado.
Bibliografia
• http://labjeduardo.iq.unesp.br
• http://nautilus.fis.uc.pt/wwwqui/equilibrio/port/hipertexto/e
qq_hiper_texto_01.html
• http://www.geocities.com/vienna/choir/9201/quimica_org
anica2.htm
• Solomons,T.W.G., Fryhle, C.B.,Química Orgânica 1trad.Whei Oh Lin, 7ªed,LTC-Rio de Janeiro,2001.