Capítulo 5
Gases
•
Substâncias que Existem como Gases
•
Pressão de um Gás
•
Leis dos Gases
•
Equação do Gás Ideal
•
Estequiometria com Gases
•
Lei de Dalton das Pressões Parciais
•
Teoria Cinética Molecular dos Gases
•
Desvios ao Comportamento Ideal
Copyright © McGraw-Interamericana de España. Autorização necessária para reprodução ou utilização
Equação do Gás Ideal
Lei de Boyle: V α
1
(com n e T constantes)
P
Lei de Charles: V α T
(com n e P constantes)
Lei de Avogadro: V α n (com P e T constantes)
Vα
nT
P
V = constante ×
nT
P
=R
nT
P
R é a constante
dos gases
PV = nRT
5.4
As condições 0ºC e 1 atm chamam-se condições de pressão
e temperatura padrão (PTP).
Experiências demonstram que a PTP, 1 mole de um gás
ideal ocupa 22,414 L.
PV = nRT
(1 atm)(22,414L)
PV
R=
=
nT
(1 mol)(273,15 K)
R = 0,082057 L • atm/(mol • K)
5.4
Qual é o volume (em litros) ocupado por 49,8 g de HCl a PTP?
T = 0 0C = 273,15 K
PV = nRT
nRT
V=
P
V=
P = 1 atm
n = 49,8 g ×
1 mol HCl
= 1,37 mol
36,45 g HCl
L • atm
1,37 mol × 0,0821 mol
× 273,15 K
•K
1 atm
V = 30,6 L
5.4
O árgon é um gás inerte usado no interior das lâmpadas para retardar a
vaporização do filamento. Uma lâmpada contendo árgon a 1,20 atm a 180C
foi aquecida a 850C, a volume constante. Qual é a pressão final do árgon no
interior da lâmpada (em atm)?
PV = nRT
nR
P
=
T
V
P1
T1
P2 = P1 ×
=
n, V e R são constantes
= constante
P1 = 1,20 atm
P2 = ?
T1 = 291 K
T2 = 358 K
P2
T2
T2
T1
= 1,20 atm × 358 K
291 K
= 1,48 atm
5.4
Estequiometria com Gases
Calcule o volume de CO2 produzido a 370 C e 1,00 atm quando 5,60 g
de glucose são consumidas na reacção:
C6H12O6 (s) + 6O2 (g)
g C6H12O6
5,60 g C6H12O6
V=
×
nRT
=
P
6CO2 (g) + 6H2O (l)
mol C6H12O6
1 mol C6H12O6
180 g C6H12O6
×
mol CO2
6 mol CO2
1 mol C6H12O6
V CO2
= 0,187 mol CO2
L • atm
× 310,15 K
mol • K
1,00 atm
0,187 mol × 0,0821
= 4,76 L
5.5
Lei de Dalton das Pressões Parciais
V e T são
constantes
Misturando
os gases
P1
P2
Ptotal = P1 + P2
5.6
Considere dois gases, A e B, num recipiente de volume V.
nART
PA =
V
nA é o número de moles de A
nBRT
PB =
V
nB é o número de moles de B
nA
XA =
nA + nB
PT = PA + PB
PA = XA PT
nB
XB =
nA + nB
PB = XB PT
Pi = Xi PT
fracção molar (Xi ) =
ni
nT
5.6
Uma amostra de gás natural contém 8,24 moles de CH4, 0,421 moles
de C2H6 e 0,116 moles de C3H8. Se a pressão total dos gases for
1,37 atm, qual é a pressão parcial do propano (C3H8)?
Pi = Xi PT
PT = 1,37 atm
0,116
Xpropano =
8,24 + 0,421 + 0,116
= 0,0132
Ppropano = 0,0132 × 1,37 atm = 0,0181 atm
5.6
Capítulo 6
Termoquímica
•
Natureza da Energia e Tipos de Energia
•
Variações de Energia em Reacções Químicas
•
Introdução à Termodinâmica
•
Entalpia de Reacções Químicas
•
Calorimetria
•
Entalpia de Formação e de Reacção Padrão
•
Calores de Solução e de Diluição
Copyright © McGraw-Interamericana de España. Autorização necessária para reprodução ou utilização
Energia é a capacidade de realizar trabalho
•
Energia radiante ou energia solar — provém
do Sol e é a fonte de energia primária da Terra.
•
Energia térmica — energia associada ao
movimento aleatório dos átomos e das moléculas.
•
Energia química — energia armazenada dentro
das unidades estruturais das substâncias químicas.
•
Energia nuclear — energia armazenada
no conjunto de neutrões e protões do átomo.
•
Energia potential — energia disponível como
consequência da posição de um objecto.
6.1
Variações de Energia em Reacções Químicas
O calor é a transferência de energia térmica entre dois corpos que
estão a temperaturas diferentes.
Temperatura é a medida da energia térmica.
Temperatura = Energia térmica
900C
400C
energia térmica superior
6.2
A termoquímica estudo do calor posto em jogo nas
reacções químicas.
O sistema é a parte específica do universo que nos
interessa.
SISTEMA
Aberto
Transferência: Massa e Energia
Fechado
Isolado
Energia
Nada
6.2
Processo exotérmico — qualquer processo que liberte calor
(transfere energia térmica do sistema para a vizinhança).
2H2 (g) + O2 (g)
H2O (g)
2H2O (l) + energia
H2O (l) + energia
Processo endotérmico — qualquer processo em que se tem
de fornecer calor ao sistema a partir da vizinhança.
energia + 2HgO (s)
energia + H2O (s)
2Hg (l) + O2 (g)
H2O (l)
6.2
Exotérmico
Endotérmico
6.2
Termodinâmica
Funções de estado — propriedades que são determinadas pelo estado
do sistema, independentemente do modo como ele foi atingido.
energia, pressão, volume, temperatura
∆E = Efinal – Einicial
∆P = Pfinal – Pinicial
∆V = Vfinal – Vinicial
∆T = Tfinal – Tinicial
A energia potential do caminhante 1
e do caminhante 2 é a mesma apesar
de usarem trilhos diferentes.
6.3
Primeira lei da termodinâmica — a energia pode ser
convertida de uma forma noutra, mas não pode ser criada
ou destruída.
∆Esistema + ∆Evizinhança = 0
ou
∆Esistema = –∆Evizinhança
C3H8 + 5O2
3CO2 + 4H2O
Reacção química exotérmica!
Energia química perdida por combustão = Energia ganha pela vizinhança
sistema
vizinhança
6.3
Uma forma mais útil da primeira lei ...
∆E = q + w
∆E = varição da energia interna do sistema
q = troca de calor entre o sistema e a vizinhança
w = trabalho efectuado sobre (ou pelo) sistema
w = –P∆V quando um gás se expande contra uma pressão
externa constante
6.3
Trabalho Efectuado sobre o Sistema
w = Fd
∆V > 0
–P∆V < 0
w = –P ∆V
wsis < 0
F
P × V = 2 × d3 = Fd = w
d
O trabalho não
é uma função
de estado!
∆w = wfinal – winicial
inicial
final
6.3
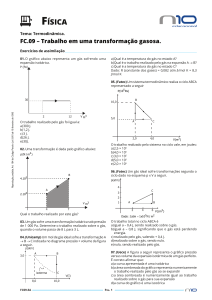
Uma amostra de azoto gasoso expande-se em volume de 1,6 L até 5,4 L
a temperature constante. Qual é o trabalho efectuado em joules se o gás
se expandir (a) no vácuo e (b) sob uma pressão constante de 3,7 atm?
w = –P ∆V
(a)
∆V = 5,4 L – 1,6 L = 3,8 L
P = 0 atm
W = –0 atm × 3,8 L = 0 L • atm = 0 J
(b)
∆V = 5,4 L – 1,6 L = 3,8 L
P = 3,7 atm
w = –3,7 atm × 3,8 L = –14,1 L • atm
w = –14,1 L • atm ×
101,3 J = –1430 J
1 L • atm
6.3
Entalpia e a Primeira Lei da Termodinâmica
∆E = q + w
A pressão constante: q = ∆H e w = –P∆V
∆E = ∆H– P∆V
∆H = ∆E + P∆V
6.4
Reacções Exotérmicas e Endotérmicas
Reacção endotérmica
2 HgO(s) + 182 kJ → 2 Hg(l) + O2(g)
∆H = + 182 kJ
Reacção exotérmica
Fe2O3(s) + 2 Al(s)
→
Al2O3(s) + 2 Fe(s) + 849 kJ
∆H = - 849 kJ
22
A entalpia (H) é utilizada para quantificar o fluxo de calor libertado ou
absorvido por um sistema num processo que ocorre a pressão constante.
∆H = H (produtos) – H (reagentes)
∆H = calor libertado ou absorvido durante a reacção a pressão constante
Hprodutos > Hreagentes
∆H > 0
Hprodutos < Hreagentes
∆H < 0
6.4
Equações Termoquímicas
∆H é negativo ou positivo?
O sistema absorve calor
Endotérmico
∆H > 0
6,01 kJ são absorvidos por cada mole de gelo que funde a 00C e 1 atm.
H2O (s)
H2O (l)
∆H = 6,01 kJ
6.4
Equações Termoquímicas
∆H é negativo ou positivo?
O sistema liberta calor
Exotérmico
∆H < 0
890,4 kJ são libertados por cada mole de metano queimado a 250C e 1 atm.
CH4 (g) + 2O2 (g)
CO2 (g) + 2H2O (l) ∆H = –890,4 kJ
6.4
Equações Termoquímicas
•
O coeficiente estequiométrico refere-se sempre ao número de mole
de uma substância.
H2O (s)
•
∆H = 6,01 kJ
Se inverter uma reacção o sinal de ∆H altera-se.
H2O (l)
•
H2O (l)
H2O (s)
∆H = –6,01 kJ
Se multiplicar ambos os membros da equação por um factor n o ∆H
deve alterar-se pelo mesmo factor n.
2H2O (s)
2H2O (l)
∆H = 2 × 6,01 = 12,0 kJ
6.4
Equações Termoquímicas
• O estado físico de todos os reagentes e produtos deve ser especificado.
H2O (s)
H2O (l)
∆H = 6,01 kJ
H2O (l)
H2O (g)
∆H = 44,0 kJ
Que quantidade de calor é desenvolvido quando 266 g de fósforo
branco (P4) ardem no ar?
P4 (s) + 5O2 (g)
266 g P4 ×
P4O10 (s)
1 mol P4
123,9 g P4
×
∆H = –3013 kJ
3013 kJ
= 6470 kJ
1 mol P4
6.4
Comparação de ∆H e ∆E
2Na (s) + 2H2O (l)
2NaOH (aq) + H2 (g)
∆E = ∆H– P∆V
∆H =–367,5 kJ/mol
A 250C, 1 mole H2 = 24,5 L a 1 atm
P∆V = 1 atm × 24,5 L = 2,5 kJ
∆E = –367,5 kJ/mol – 2,5 kJ/mol = –370,0 kJ/mol
6.4
O calor específico (c) de uma substância é a quantidade de calor
necessária para elevar de um grau Celsius a temperatura de um grama da
substância.
A capacidade calorífica (C) de uma substância é a quantidade de calor
necessária para elevar de um grau Celsius a temperatura de uma dada
quantidade da substância.
C = mc
Calor (q) absorvido ou libertado:
q = mc∆t
q = C∆t
∆t = tfinal – tinicial
6.5
Quanto calor é libertado quando uma barra de ferro com 869 g
arrefece de 940C para 50C?
c (Fe) = 0,444 J/g • 0C
∆t = tfinal – tinicial = 50C – 940C =–890C
q = mc∆t = 869 g × 0,444 J/g • 0C x –890C = –34 000 J
6.5
Calorimetria a Volume Constante
qsis = qágua + qcal+ qreac
qsis = 0
qreac = – (qágua + qcal)
qágua = mc∆t
qbomb = Ccal∆t
Reacção a V constante
∆H = qreac
Não há entrada nem saída de calor!
∆H ~ qreac
6.5
Calorimetria a Pressão Constante
qsis = qágua + qcal + qreac
qsis = 0
qreac = – (qágua + qcal)
qágua = mc∆t
qcal = Ccal∆t
Reacção a P constante
∆H = qreac
Não há entrada nem saída de calor!
6.5
6.5
Química em Acção:
Valores Energéticos de Alimentos e de Outras Substâncias
C6H12O6 (s) + 6O2 (g)
6CO2 (g) + 6H2O (l) ∆H = –2801 kJ/mol
1 cal = 4,184 J
1 Cal = 1000 cal = 4184 J
Como não há maneira de determinar o valor absoluto da entalpia de
uma substância tenho que medir as alterações da entalpia para
cada uma das reacções em causa?
Estabeleça uma escala arbitrária com a entalpia de formação padrão (∆Hf0)
como ponto de referência para todas as expressões de entalpia.
Entalpia de formação padrão (∆Hf0) ― calor posto em jogo
quando se forma uma mole de um composto a partir dos seus
elementos à pressão de 1 atm.
A entalpia de formação padrão de qualquer elemento na sua forma
mais estável é zero.
∆H0f (O2) = 0
∆H0f (O3) = 142 kJ/mol
∆H0f (C, grafite) = 0
∆H0f (C, diamante) = 1,90 kJ/mol
6.6
6.6
Entalpia de formação padrão (∆H0reac) ― entalpia de uma reacção
levada a cabo a 1 atm.
aA + bB
cC + dD
∆H0reac = [ c∆H0f (C) + d∆H0f (D) ] – [ a∆H0f (A) + b∆H0f (B) ]
∆H0reac = Σ n∆H0f (produtos) – Σ m∆Hf0 (reagentes)
Lei de Hess ― quando os reagentes são convertidos em produtos,
a variação de entalpia é a mesma quer a reacção se dê num só passo
ou numa série de passos.
A entalpia é uma funcão de estado. Não interessa como se chega lá,
apenas é importante onde se começa e onde se acaba.
6.6
Calcule a entalpia de formação padrão do CS2 (l):
C(grafite) + O2 (g)
CO2 (g)
S(rômbico) + O2 (g)
∆H0
reac
∆H0reac = –296,1 kJ
SO2 (g)
CS2(l) + 3O2 (g)
= –393,5 kJ
CO2 (g) + 2SO2 (g)
∆H0
= –1072 kJ
reac
1. Escreva a entalpia de formação da reacção para CS2
C(grafite) + 2S(rômbico)
CS2 (l)
2. Adicione as entalpias dadas:
C(grafite) + O2 (g)
+
∆H0reac = –393,5 kJ
∆H0reac= –296,1 × 2 kJ
2S(rômbico) + 2O2 (g)
2SO2 (g)
CO2(g) + 2SO2 (g)
CS2 (l) + 3O2 (g)
C(grafite) + 2S(rômbico)
6.6
CO2 (g)
∆H0reac= +1072 kJ
CS2 (l)
0
∆Hreac
= –393,5 + (2 × –296,1) + 1072 = 86,3 kJ
O benzeno (C6H6) arde no ar e produz dióxido de carbono e água
líquida. Calcule o calor libertado por mole de benzeno consumido?
A entalpia de formação padrão do benzeno é 49,04 kJ/mol. CO =-393.5
2
H2O=-241.8
2C6H6 (l) + 15O2 (g)
12CO2 (g) + 6H2O (l)
∆H0reac = Σ n∆H0f (produtos) – Σ m∆Hf0 (reagentes)
∆H0reac = [ 12∆H0f (CO2) + 6∆H0f (H2O)] – [ 2∆H0f (C6H6)]
∆H0reac = [ 12 × –393,5 + 6 × –241.8 ] – [ 2 × 49,04 ] = –... kJ
–... kJ
2 mol
= –... kJ/mol C6H6
6.6