Gliconeogénese; Rui Fontes
Gliconeogénese
1-
A gliconeogénese é um termo usado para incluir o conjunto de processos pelos quais o organismo
pode converter substâncias não glicídicas (como aminoácidos, lactato, piruvato, glicerol e
propionato) em glicose ou glicogénio.
2-
Durante o jejum aumenta a actividade lipolítica (hidrólise dos triacilgliceróis em glicerol e ácidos
gordos) no tecido adiposo e a maioria dos órgãos do organismo (nomeadamente os músculos e o
fígado) começam a usar como combustível preferencial os ácidos gordos. Contudo, os eritrócitos e,
em grande medida, os neurónios dependem do catabolismo da glicose para a síntese de ATP.
Embora a glicogenólise hepática (formação de glicose a partir do glicogénio armazenado no
fígado) seja, durante as primeiras horas de jejum, a principal fonte da glicose que é vertido no
sangue, à medida que o tempo de jejum aumenta a gliconeogénese vai sendo cada vez mais
importante.
3-
Quer na glicogenólise quer na gliconeogénese forma-se glicose-6-P e a formação de glicose só
pode ocorrer por hidrólise da glicose-6-P. Porque a enzima responsável por este processo (glicose6-fosfátase, uma enzima do retículo endoplasmático) existe no fígado, no rim e no intestino
delgado (enterócitos) são estes os órgãos responsáveis pela manutenção de níveis de glicemia
compatíveis com a actividade dos neurónios e dos eritrócitos durante o jejum. O fígado tem, neste
contexto, um papel mais importante que o rim e o intestino.
4-
Três das enzimas da glicólise [(1) cínase da glicose: ATP + glicose → glicose-6-P + ADP; (2)
cínase 1 da frutose-6-P: ATP + frutose-6-P → ADP + frutose-1,6-bisfosfato; (3) cínase do
piruvato: ADP + fosfoenolpiruvato → ATP + piruvato] catalisam reacções fisiologicamente
irreversíveis. Na gliconeogénese, também são fisiologicamente irreversíveis as reacções catalisadas
pelas enzimas que permitem as conversão de piruvato em fosfoenolpiruvato [(3a) carboxílase do
piruvato: ATP + H2O + piruvato + CO2 → ADP + Pi + oxalacetato; (3b) carboxicínase do
fosfoenolpiruvato: GTP + oxalacetato → GDP + fosfoenolpiruvato + CO2], da frutose-1,6bisfosfato em frutose-6-P [(2) frutose-1,6-bisfosfátase: frutose-1,6-bisfosfato + H2O → frutose-6P + Pi] e da glicose-6-P em glicose [(1) glicose-6-fosfátase: glicose-6-P + H2O → glicose + Pi]. A
actividade relativa das enzimas envolvidas nas transformações referidas determina a velocidade e o
sentido (anabólico ou catabólico) no metabolismo da glicose.
5-
Muitas das enzimas envolvidas na gliconeogénese também participam na glicólise: catalisam
reacções fisiologicamente reversíveis e o seu papel (anabólico ou catabólico) depende das
concentrações citoplasmáticas dos compostos (reagentes e produtos) envolvidos nessas reacções.
Essas enzimas são a enólase, a mútase do fosfoglicerato, a cínase do 3-fosfoglicerato, a
desidrogénase do gliceraldeído-3-P, a isomérase das trioses-P, a aldólase e a isomérase das
hexoses-P. É de notar que a reacção catalisada pela cínase do 3-fosfoglicerato (ATP + 3fosfoglicerato ↔ 1,3-bisfosfoglicerato + ADP) funciona no sentido da conversão de ATP em ADP
durante a gliconeogénese mostrando claramente que, em jejum, não existe no fígado déficit de
ATP. A oxidação hepática dos ácidos gordos libertados no tecido adiposo fornece ao fígado a
energia necessária para a síntese de ATP. É também de notar que, no decurso da gliconeogénese,
na reacção catalisada pela desidrogénase do gliceraldeído-3-P (NADH + 1,3-bisfosfoglicerato ↔
NAD+ + Pi + gliceraldeído-3-P), existe conversão líquida de NADH em NAD+, o contrário do que
ocorre na glicólise. Dependendo dos substratos que estão, num determinado momento a ser usados
na gliconeogénese, a oxi-redútase directamente responsável pela formação do NADH
citoplasmático pode ser a desidrogénase do malato citosólica (malato + NAD+ → oxalacetato +
NADH) ou a desidrogénase do lactato (lactato + NAD+ → piruvato + NADH).
6-
Os eritrócitos produzem continuamente lactato e os músculos, mesmo em jejum, dependem da
glicólise anaeróbia para realizarem esforços que consomem ATP a uma velocidade maior que a
velocidade de formação de ATP na fosforilação oxidativa. O lactato vertido no sangue pode, no
fígado e no rim, ser convertido em glicose e por isso se diz que o lactato é um composto
Página 1 de 4
Gliconeogénese; Rui Fontes
glicogénico. As enzimas e os transportadores envolvidas na transformação do lactato em glicose
são a desidrogénase do lactato, o simporter piruvato/H+ da membrana interna da mitocôndria, a
carboxílase do piruvato, a desidrogénase do malato da matriz da mitocôndria, a carboxicínase do
fosfoenolpiruvato (isoenzima da matriz da mitocôndria), o transportador do fosfoenolpiruvato da
membrana interna da mitocôndria, a enólase, a mútase do fosfoglicerato, a cínase do 3fosfoglicerato, a desidrogénase do gliceraldeído-3-P, a isomérase das trioses-P, a aldólase, a
frutose-1,6-bisfosfátase, a isomérase das hexoses-P e a glicose-6-fosfátase. É de notar que, quando
o lactato é o substrato da gliconeogénese, o NADH necessário para acção catalítica da
desidrogénase do gliceraldeído-3-P é formado aquando da acção da desidrogénase do lactato;
ambas as desidrogénases são enzimas citoplasmáticas de forma que quer a redução do NAD+
(lactato + NAD+ → piruvato + NADH), quer a oxidação do NADH (1,3-bisfosfoglicerato + NADH
→ gliceraldeído-3-P + NAD+ + Pi), ocorrem no citoplasma. O conjunto de reacções envolvidas na
conversão de lactato em glicose pode ser resumido na seguinte equação soma
2 lactato (C3H6O3) + 2 GTP + 4 ATP + 6 H2O
→ glicose (C6H12O6) + 2 GDP +4 ADP + 6 Pi
A formação da glicose a partir de lactato (processo endergónico) só é possível porque está acoplada
com a hidrólise de ATP e do GTP (processo exergónico).
7-
Mais importantes que o lactato como fonte de carbono para a gliconeogénese são os
aminoácidos. Em jejum aumenta a hidrólise das proteínas e o esqueleto carbonado da maioria dos
aminoácidos libertados no processo hidrolítico pode gerar glicose no fígado. Neste contexto são
particularmente importantes a alanina e o glutamato. A alanina pode, por transaminação, gerar
piruvato (alanina + α-cetoácido-X ↔ piruvato + α-aminoácido-X) e o piruvato pode, através da
acção da carboxílase do piruvato, gerar um intermediário do ciclo de Krebs, concretamente o
oxalacetato. Quer a transamínase da alanina que a carboxílase do piruvato são enzimas da
mitocôndria e, portanto, a conversão alanina→oxalacetato ocorre na matriz mitocondrial. Não
existe na membrana interna da mitocôndria transportador para o oxalacetato. A passagem do
oxalacetato da matriz mitocondrial para o citoplasma envolve a desidrogénase do malato
mitocondrial (oxalacetato + NADH → malato + NAD+), o antiporter malato/α-cetoglutarato que
catalisa a saída do malato da matriz para o citoplasma e a desidrogénase do malato citosólica
(malato + NAD+ → oxalacetato + NADH). O oxalacetato citosólico é substrato da carboxicínase do
fosfoenolpiruvato citoplasmática (oxalacetato + GTP → fosfoenolpiruvato + CO2 + GDP) e o
fosfoenolpiruvato citoplasmático formado pode, por acção das mesmas enzimas já referidas no
ponto 6, converter-se em glicose. De notar que a conversão da alanina em glicose envolve enzimas
e transportadores da lançadeira do malato a operar em sentido inverso ao que acorre na glicólise
aeróbia.
8-
O glutamato também pode, por transaminação (glutamato + α-cetoácido-X ↔ α-cetoglutarato + αaminoácido-X) ou por acção da desidrogénase do glutamato (glutamato + NAD+ →α-cetoglutarato
+ NH4+ + NADH), gerar um intermediário do ciclo de Krebs, concretamente o α-cetoglutarato.
O α-cetoglutarato pode gerar malato que, saindo da mitocôndria, pode oxidar-se a oxalacetato
(desidrogénase do malato). O oxalacetato pode, via fosfoenolpiruvato, gerar glicose. Tal como no
caso da alanina, também aqui, a enzima directamente responsável pela redução do NAD+
citoplasmático é a desidrogénase do malato citoplasmática.
9-
A lipólise no tecido adiposo também liberta glicerol para o sangue. Ao contrário do que acontece
em muitos tecidos (nomeadamente no tecido adiposo) no fígado (e rim) existe uma enzima que é
capaz de catalisar a transformação do glicerol em glicerol-3-P (cínase do glicerol: glicerol + ATP
→ glicerol-3-P + ADP) iniciando o processo de conversão do glicerol em glicose. A transformação
do glicerol-3-P (3C) em glicose (6C) envolve a actividade das seguintes enzimas: desidrogénase
citoplasmática do glicerol-3-P (glicerol-3-P + NAD+ ↔ dihidroxiacetona-P + NADH), isomérase
das trioses-P (dihidroxiacetona-P ↔ gliceraldeído-3-P), aldólase (dihidroxiacetona-P +
gliceraldeído-3-P ↔ frutose-1,6-bisfosfato), frutose-1,6-bisfosfátase (frutose-1,6-bisfosfato + H2O
→ frutose-6-P + Pi), isomérase das hexoses-P (frutose-6-P ↔ glicose-6-P) e glicose-6-fosfátase
Página 2 de 4
Gliconeogénese; Rui Fontes
(glicose-6-P + H2O → glicose + Pi). A equação soma relativa à transformação que ocorre no fígado
(e rim) pode ser escrita:
2 glicerol + 2 NAD+ + 2 ATP + 2 H2O → glicose + 2 NADH + 2 ADP + 2 Pi
No caso do glicerol (ao contrário dos casos do lactato, alanina e glutamato) a sua conversão em
glicose não envolve a redução do 1,3-bisfosfoglicerato em gliceraldeído-3-P (desidrogénase do
gliceraldeído-3-P). O NADH formado durante a conversão de glicerol-3-P em glicose é oxidado
pelo oxigénio via lançadeira do malato e complexos I, III e IV da cadeia respiratória.
10-
No homem, a maioria dos ácidos gordos têm um número par de carbonos (cadeia par) e geram no
seu catabolismo acetil-CoA que reage com o oxalacetato por acção catalítica da síntase do citrato.
Nesta reacção não há formação de intermediários do ciclo de Krebs. Por outro lado, a conversão de
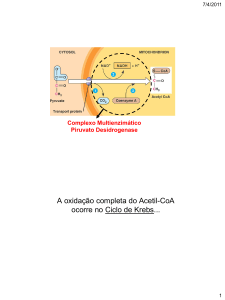
acetil-CoA em piruvato também não pode ocorrer porque a reacção catalisada pela desidrogénase
do piruvato (piruvato + NAD+ + CoA → acetil-CoA + NADH + CO2) é fisiologicamente
irreversível. Porque o acetil-CoA não pode contribuir para a síntese de compostos que sejam
substratos da gliconeogénese os ácidos gordos de cadeia par não são glicogénicos. Pelo
contrário, os ácidos gordos de cadeia ímpar podem dar origem (para além de acetil-CoA) a
propionil-CoA (o grupo propionil contém 3 carbonos). O propionil-CoA pode por acção de uma
sintétase (carboxílase do propionil-CoA: propionil-CoA + CO2 + ATP + H2O → D-metil-malonilCoA + ADP + Pi) e de duas isomérases gerar succinil-CoA que é um intermediário do ciclo de
Krebs. Para além do glicerol, do lactato, do piruvato, da alanina e do glutamato também os
ácidos gordos de cadeia ímpar são glicogénicos.
11-
Sendo parte importante nos processos homeostáticos, as enzimas que catalisam as reacções
fisiologicamente irreversíveis na glicólise e na gliconeogénese são, no fígado e rim, reguladas de
tal forma que quando a glicemia está elevada as primeiras estão activadas e as segundas inibidas. O
contrário acontece quando a glicemia está diminuída. A regulação da actividade destas enzimas
pode envolver a (i) indução ou a repressão dos genes codificadores dessas enzimas, (ii)
variação na concentração intracelular de substratos ou (iii) reguladores alostéricos assim
como (iv) activação ou inibição por fosforilação reversível.
12-
Os mecanismos que condicionam a regulação da actividade das enzimas que catalisam os passos
irreversíveis da glicólise e da gliconeogénese hepáticas e renais são complexos envolvendo também
a acção de hormonas que se libertam noutros tecidos. Assim, são parte importante nos processos
homeostáticos a insulina (que aumenta no sangue em resposta a aumentos na glicemia e tem acção
hipoglicemiante) e a glicagina (que aumenta no caso inverso e tem acção hiperglicemiante).
Estas hormonas pancreáticas exercem os seus efeitos regulando a actividade de enzimas e de
transportadores.
13-
Em jejum a hipoglicemia estimula as células α dos ilhéus pancreáticos a produzir glicagina. A
glicagina liga-se ao seu receptor na face externa da membrana dos hepatócitos estimulando a
cíclase do adenilato (ATP → AMPc + PPi) e a consequente acumulação de AMP cíclico (AMPc)
no citosol. O AMPc é um estimulador alostérico da “cínase de proteínas dependente do AMPc”
(PKA). A PKA é uma cínase que tem como substrato aceitador de fosfato múltiplas enzimas (ATP
+ enzima → ADP + enzima-P) que, dependendo da enzima concreta, podem ser activadas ou
inibidas por essa fosforilação. A glicagina induz os processos que levam à formação de glicose
porque os processos de fosforilação catalisados pela PKA activam as enzimas chave das vias
metabólicas envolvidas na formação de glicose. A glicagina prejudica o consumo de glicose
porque os processos de fosforilação catalisados pela PKA inibem as enzimas chave das vias
metabólicas envolvidas no seu consumo. Pelo contrário, a insulina, que está diminuída durante o
jejum, prejudica os processos de fosforilação estimulados pela glicagina.
14-
Dois dos substratos da PKA são a cínase do piruvato hepática e uma enzima “bifuncional”
envolvida na regulação do par fosfátase da frutose-1,6-bisfosfato/cínase 1 da frutose-6-P. Em
concordância com o papel da cínase do piruvato na glicólise a forma fosforilada desta enzima é
menos activa. Também em concordância com o papel da fosfátase da frutose-1,6-bisfosfato na
gliconeogénese e da cínase 1 da frutose-6-P na glicólise a fosforilação da enzima “bifuncional” vai
implicar a activação da fosfátase da frutose-1,6-bisfosfato e a inibição da cínase 1 da frutose-6-P. A
Página 3 de 4
Gliconeogénese; Rui Fontes
enzima “bifuncional” regula a concentração intracelular de um composto – a frutose-2,6-bisfosfato
– que é, simultaneamente, activador da cínase 1 da frutose-6-P e um inibidor da fosfátase da
frutose-1,6-bisfosfato. A enzima “bifuncional” tem duas actividades: cínase 2 da frutose-6-P
(ATP + frutose-6-P → ADP + frutose-2,6-bisfosfato) e fosfátase da frutose-2,6-bisfosfato
(frutose-2,6-bisfosfato + H2O → frutose-6-P + Pi). Via frutose-2,6-bisfosfato a activação da cínase
2 da frutose-6-P implica activação da cínase 1 da frutose-6-P e, pelo contrário, a activação da
fosfátase da frutose-2,6-bisfosfato implica a activação da fosfátase da frutose-1,6-bisfosfato. Em
concordância com isto a fosforilação pela PKA da enzima “bifuncional” tem como consequência a
diminuição da concentração intracelular da frutose-2,6-bisfosfato porque na sua forma fosforilada a
enzima “bifuncional” tem predominantemente uma actividade hidrolítica: ou seja, na forma
fosforilada anula-se a actividade de cínase 2 da frutose-6-P e fica estimulada a actividade de
fosfátase da frutose-2,6-bisfosfato.
15-
Resumindo os pontos 12 e 13:
glicemia↓ ⇒ glicagina ↑ ⇒ AMPc↑ ⇒ frutose-2,6-bisfosfato↓ ⇒ gliconeogénese↑
glicemia↑ ⇒ insulina ↑ ⇒ AMPc↓ ⇒ frutose-2,6-bisfosfato↑ ⇒ glicólise↑
16-
No jejum ocorre também hidrólise dos triacilgliceróis endógenos. O resíduo glicerol é, como
primeiro passo da sua transformação em glicose, fosforilado no fígado (cínase do glicerol: ATP +
glicerol → ADP + glicerol-3-P). Os ácidos gordos de cadeia par (os mais abundantes) não são
substratos da gliconeogénese mas tem um importante papel no processo. A sua oxidação leva à
formação de acetil-CoA e ATP. (i) A acetil-CoA é, simultaneamente, um activador alostérico da
carboxílase do piruvato (gliconeogénese) e, via activação da cínase do desidrogénase do
piruvato (ATP + desidrogénase do piruvatoactiva → ADP + desidrogénase do piruvato-Pinactiva), um
inibidor da oxidação do piruvato e, consequentemente, da glicose. Embora a fosforilação da
desidrogénase do piruvato (piruvato + CoA + NAD+ → acetil-CoA + CO2 + NADH + H+) não
esteja dependente da acção da PKA também aqui a hipoglicemia tem como consequência a
fosforilação de uma enzima. (ii) O ATP gerado no catabolismo dos ácidos gordos fornece energia
necessária para a gliconeogénese e para as outras actividades do hepatócito.
17-
Para além dos mecanismos alostéricos e de fosforilação reversível já apontados também têm
importância na regulação da glicólise e na gliconeogénese a regulação da síntese das enzimas
próprias da glicólise e gliconeogénese ao nível da transcrição. Em geral a insulina estimula a
síntese das enzimas da glicólise e inibe a síntese das enzimas da gliconeogénese. A glicagina tem
efeitos opostos.
18-
Por si só, o valor da glicemia tem importância na regulação da cínase da glicose (ATP + glicose →
ADP + glicose-6-P) pois esta enzima hepática, porque tem um Km elevado (de cerca de 8-10 mM),
é sensível às variações fisiológicas da glicemia (4-12 mM na veia porta).
Página 4 de 4