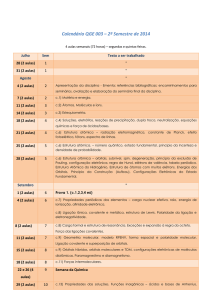
QUI109 – QUÍMICA GERAL
(Ciências Biológicas)
8ª aula / 2016-2
Prof. Mauricio X. Coutrim
(disponível em: http://professor.ufop.br/mcoutrim)
LIGAÇÃO COVALENTE
A LIGAÇÃO COVALENTE É BASEADA NO
COMPARTILHAMENTO DE ELÉTRONS
Ex. A MOLÉCULA DE H2
LIGAÇÃO COVALENTE
Estrutura de Lewis: Representa os elétrons da camada de
valência dos átomos compartilhados. P. ex., Cl2, HCl e H2S.
Os átomos tendem a obedecer a regra do octeto!
CAMADA DE VALÊNCIA n=3
1s
2s
2p
3s
3p
Cl (Z=17) :
Cl
CAMADA DE VALÊNCIA n=3
1s
2s
2p
3s
3p
Cl (Z=17) :
**
Cl
15/02/2017
Prof. Mauricio X. Coutrim
**
*
* Cl
* * Cl* ;
*
**
**
Cl – Cl; Cl2
3
LIGAÇÃO COVALENTE
Estruturas de Ressonância: Às vezes são necessárias mais
de uma estrutura de Lewis para representar a espécie
(ressonância). P. ex., NO3-, CO32- e O3 (ozônio).
CARGA FORMAL
é’s valência do átomo livre menos
é’s livres e compartilhados no
átomo ligado!
Nesse caso: 6 – (6 + 1) = -1
Ressonância no CO2
15/02/2017
Prof. Mauricio X. Coutrim
4
LIGAÇÃO COVALENTE
Camada de Valência Expandida: Átomos que possuem orbitais
d vazios podem fazer ligações covalentes com mais de 8
elétrons (expandem a camada de valência com orbitais d).
P. ex., PCl5 [PCl3 (regra do octeto)], SF4, XeF4.
15/02/2017
Prof. Mauricio X. Coutrim
5
LIGAÇÃO COVALENTE
Ligação Covalente Coordenada: Ocorre quando ambos os
elétrons de uma ligação covalente são proveniente de um
dos átomos da ligação. P. ex., NH3BF3.
Ácido de Lewis: É uma espécie receptora de par de elétrons.
Base de Lewis: É uma espécie doadora de par de elétrons.
Base de Lewis
Ácido de Lewis
15/02/2017
Prof. Mauricio X. Coutrim
6
LIGAÇÃO COVALENTE / orbitais atômicos
A forma do orbital ‘s’
(esfera representa a região
com 90% de certeza de se
encontrar o elétron
Representação das formas dos orbitais ‘p’
Representação das formas dos orbitais ‘d’
LIGAÇÃO COVALENTE
A LIGAÇÃO
s NO H – H (H2)
H (Z = 1): 1s1
15/02/2017
Prof. Mauricio X. Coutrim
Orbitais moleculares
são formados a partir
de orbitais atômicos!
A energia de um
elétron em um átomo
da ligação depende
dos demais elétrons
desse átomo e do(s)
elétron(s) do(s)
outro(s) átomo(s).
Exemplo mais
simples: orbital s na
molécula H2.
8
LIGAÇÃO COVALENTE
A LIGAÇÃO
s NO H – F (HF)
A LIGAÇÃO
s NO F – F (F2)
F (Z = 9): 1s2; 2s2; 2p5.
LIGAÇÃO s = encontro
frontal de orbitais
LIGAÇÃO COVALENTE
A LIGAÇÃO
p (encontro lateral de orbitais)
A MOLÉCULA DE N2 (NN, ligação tripla)
(a) Duas ligações p e uma
ligação s, separadas
(b) Os orbitais s e p
mostrados juntos
LIGAÇÃO COVALENTE
FORÇA DE LIGAÇÃO
ENERGIA DE LIGAÇÃO = ENTALPIA DE LIGAÇÃO
LIGAÇÃO COVALENTE
GEOMETRIA MOLECULAR / TEORIA DA LIGAÇÃO DE VALÊNCIA
Modelo da Repulsão do Par de Elétrons no Nível de Valência
- RPENV (VSEPR: valence-shell electron-pair repulsion model):
Os pares de elétrons ligantes e os não ligantes tendem ao
máximo distanciamento (repulsão de cargas elétricas).
O modelo explica a forma da molécula (geometria). P. ex., CO2 e H2O.
Como ocorre a repulsão dos pares de
elétrons (ligantes e não ligantes)
LIGAÇÃO COVALENTE
AS DIVERSAS FORMAS GEOMÉTRICAS DAS MOLÉCULAS
Exemplos de moléculas
SF4
PCl5
BrF5
LIGAÇÃO COVALENTE
A GEOMETRIA DA MOLÉCULA / POLARIDADE
Formas geométricas apolares (5 formas principais):
Observar que o átomo central é a
base do modelo!
LIGAÇÃO COVALENTE
A GEOMETRIA DA MOLÉCULA
As formas geométricas derivadas (os pares de elétrons não
ligantes interferem no ângulo da geometria):
Ângulos:
~109,5º (CH4)
107º (NH3)
~104,5º (H2O)
APOLAR
POLAR
POLAR
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS
Orbitais atômicos formam orbitais moleculares na ligação.
Muitas vezes os orbitais atômicos formam orbitais híbridos
antes de se ligarem (o número total de orbitais híbridos é
igual ao de orbitais atômicos misturados):
EXEMPLO DE UM ORBITAL HÍBRIDO
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS “s” E “p”
Tipos de orbitais híbridos (sp)
HIBRIDIZAÇÃO
sp DO
CARBONO
(C, Z=6)
(1s2, 2s2, 2p2 )
2 orbitais sp iguais (com
mesma energia)
+
2 orbitais p (mais energético)
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS sp
Exemplo:
CARBONO NO
ACETILENO
(H–C≡C–H)
GEOMETRIA LINEAR
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS sp
do Be
Exemplo:
BERÍLIO no BeF2
(C, Z=4)
(1s2,
2s2,
2p0
)
hibridização
BF2
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS “s” E “p”
Tipos de orbitais híbridos (sp2)
HIBRIDIZAÇÃO
sp2 DO
CARBONO
(C, Z=6)
(1s2,
2s2,
2p2
)
3 orbitais sp2 iguais (com mesma energia)
+
1 orbital p (mais energético) ocupado
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS sp2
Exemplo:
CARBONO NO
ETILENO
(H2C=CH2)
GEOMETRIA PLANA
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS “s” E “p”
Tipos de orbitais híbridos (sp3)
HIBRIDIZAÇÃO sp3
DO CARBONO
(C, Z=6)
(1s2, 2s2, 2p2 )
4 orbitais sp3 iguais (com mesma energia)
QUATRO ORBITAIS HÍBRIDOS sp3
(mesma energia, > 1s)
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS (sp3)
Exemplo:
CARBONO NO
METANO (CH4)
GEOMETRIA TETRAÉDRICA
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS s, p e d
HIBRIDIZAÇÃO sp3d DO FÓSFORO (P, Z=15) (Ne; 3s2, 3p3, 3d0 )
E DO ENXOFRE (S, Z=16) (Ne; 3s2, 3p4, 3d0 )
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS “s”, “p” E “d”
HIBRIDIZAÇÃO sp3d
(Exemplo, FÓSFORO
REPRESENTAÇÃO DOS ORBITAIS
DO ÁTOMO DE FÓSFORO
NO PCl5
(P, Z=15: 1s2, 2s2, 2p6,
3s2, 3p3, 3d0)
CINCO ORBITAIS HÍBRIDOS
sp3d (mesma energia)
GEOMETRIA BIPIRÂMIDE TRIGONAL
QUATRO ORBITAIS d
PUROS (mesma
energia, mas maior
que a dos híbridos)
LIGAÇÃO COVALENTE
HIBRIDIZAÇÃO DE ORBITAIS “s”, “p” E “d”
HIBRIDIZAÇÃO
sp3d2
REPRESENTAÇÃO DOS ORBITAIS
DO ÁTOMO DE ENXOFRE
(Exemplo, ENXOFRE
NO SF6
(S, Z=16: 1s2, 2s2,
2p6, 3s2, 3p4, 3d0)
GEOMETRIA BIPIRÂMIDE QUADRADA
SEIS ORBITAIS HÍBRIDOS
sp3d2 (mesma energia)
TRÊS ORBITAIS d
PUROS (mesma
energia, > híbridos)
LIGAÇÃO COVALENTE
LIGAÇÕES p DESLOCALIZADAS
ESTRUTURA DE RESSONÂNCIA
A MOLÉCULA DE BENZENO
A MOLÉCULA DE ETENO OU ETILENO
ligações p
conjugadas
LIGAÇÃO COVALENTE
ORBITAL MOLECULAR
• Níveis de Energia nos orbitais moleculares (1s)
(orbital anti-ligante)
(orbital ligante)
Diagrama de Energia do Orbital
Molecular para a molécula de H2
15/02/2017
Prof. Mauricio X. Coutrim
28
LIGAÇÃO COVALENTE
Orbitais moleculares (de OA 1s; 2s; 2p) → Ex: O + O = O2
Orbitais
atômicos
15/02/2017
Orbitais
moleculares
Orbitais
atômicos
Prof. Mauricio X. Coutrim
29
FORÇAS INTERMOLECULARES
PROPRIEDADES FÍSICAS DA ÁGUA E DO GÁS CARBÔNICO
Substância
Fórmula
Massa Molar
(g/mol)
Densidad
e (g/mL)
Ponto de
fusão (oC)
Pressão de vapor
(atm) a 20oC
Água
H2O (OH2)
18,015
1,00
0
22,7.10-2
Gás carbônico
O2C (CO2)
44,010
1,98.10-3
-56,6
56,55
DIAGRAMA DE FASE DA ÁGUA
Pressão de
Vapor é a
pressão
exercida pelo
vapor em
equilíbrio com
o líquido (ou
sólido) a uma
dada
temperatura.
DIAGRAMA DE FASE DO CO2
1 bar ~ 1 atm
1MPa ~ 10 atm
1KPa ~ 0,01 atm
1oC ~ 274 K
Fonte: 1) https://en.wikipedia.org/wiki/Properties_of_water; 2) https://en.wikipedia.org/wiki/Carbon_dioxide
FORÇAS INTERMOLECULARES
Tipos de forças intermoleculares
(van der Waals)
Dipolo
London
Fonte: https://sciborg.uwaterloo.ca/~cchieh/cact/applychem/hydration.html
FORÇAS INTERMOLECULARES
Ligação de Hidrogênio H - F, H - O ou H – N (FON)
As ligações entre H e FON são atrações dipolo-dipolo bem mais fortes do que as
atrações desse tipo que ocorrem entre outras moléculas devido a outros dipolos
EXERCÍCIOS
1) A energia de rede do KBr (671 KJ/mol) e do CsCl (657 KJ/mol) são muito próximas. O que
se conclui disso?
2) Dê a fórmula química e de Lewis do composto iônico formado pelos elementos: a) Al e F;
b) K e S; c) Be e Cl.
3) Dê as estruturas de ressonância de Lewis e as cargas formais das espécies CO3; NO3 e O3.
4) Coloque em ordem crescente de comprimento de ligação: C=C; C≡C; C–C; C≡O. Qual
entalpia de ligação é maior?
5) Quais das seguintes moléculas são polares: BF3; CO; CF4; NCl3; SF2? Justifique. Quais os
ângulos de ligação na molécula de BF3?
6) Qual a geometria das seguintes moléculas ou íons: a) SO3; b) PCl3; c) NH2Cl; d) BrF5?
7) Qual o número máximo de orbitais híbridos que um átomo de carbono pode formar? E o
número mínimo? Explique.
8) Quantos orbitais híbridos participam das ligações na molécula de acetileno? Quais as
ligações que formam?
EXERCÍCIOS (RESPOSTAS)
1) A energia de rede do KBr (671 KJ/mol) e do CsCl (657 KJ/mol) são muito próximas. O que
se conclui disso?
A força que mantêm esses íons no sólido é quase a mesma.
2) Dê a fórmula química e de Lewis do composto iônico formado pelos elementos: a) Al e F;
[Al3+][F-]3; [K+]2[S2-]; [Be2+][Cl-]2.
b) K e S; c) Be e Cl.
3) Dê as estruturas de ressonância de Lewis e as cargas formais das espécies CO
Slide
4 3 e O3.
3; NO
4) Coloque em ordem crescente de comprimento de ligação: C=C; C≡C; C–C; C≡O. Qual
entalpia de ligação é maior? C≡O > C≡C > C=C > C–C; C≡O tem maior entalpia de ligação
5) Quais das seguintes moléculas são polares: BF3; CO; CF4; NCl3; SF2? Justifique. Quais os
ângulos de ligação na molécula de BF3? CO; NCl3; SF2. BF3 é triangular plana e ângulo = 120o
6) Qual a geometria das seguintes moléculas ou íons: a) SO3; b) PCl3; c) NH2Cl; d) BrF5?
SO3 = trigonal plana; PCl3 e NH2Cl = pirâmide trigonal; SF2. BrF5 é piramidal quadrada
7) Qual o número máximo de orbitais híbridos que um átomo de carbono pode formar? E o
C com 4 elétrons de valência pode formar no
número mínimo? Explique.
máximo 4 orbitais híbridos e no mínimo 1.
8) Quantos orbitais híbridos participam das ligações na molécula de acetileno? Quais as
ligações que formam? HC≡CH; 2 híbridos sp de cada carbono se ligam ao H e ao C. As
outras 2 ligações da C≡C ocorrem entre orbitais p (não híbridos!)
EXERCÍCIOS (procure sempre justificar suas respostas)
1) SO2 tem momento de dipolo? Se sim, em qual direção aponta o dipolo resultante?
2) Quais das 3 formas isoméricas da molécula de dicloroetileno (C2H2Cl2) tem momento de
dipolo igual a zero?
3) As moléculas de BF3 e SO3 tem a geometria trigonal plana. Quais os ângulos das ligações
nessas moléculas?
4) A geometria de uma molécula AB3 é bipiramidal trigonal. Quantos pares de elétrons não
ligantes há no átomo A?
5) Qual a geometria das seguintes moléculas ou íons: a) SO3; b) PCl3; c) NH2Cl; d) BrF5?
6) Quais das seguintes espécies são ácido de Lewis e quais são base de Lewis? a) NH3; b)
BF3; c) Ag+; d) F-; e) H+; f) Al3+; g) CN-; h) NO2-. Justifique sua resposta.
7) Em qual espécie o par de átomo ligado tem maior comprimento de ligação? a) N e O em
NO, NO2 ou NO3-; b) C e C em C2H2, C2H4 ou C2H6; c) C e O em CH3OH; CH2O ou CH3OCH3.
8) Os cristais de sódio com F ou com Cl têm a mesma estrutura. Em qual se espera que a
energia de rede seja maior? Jusitifique.