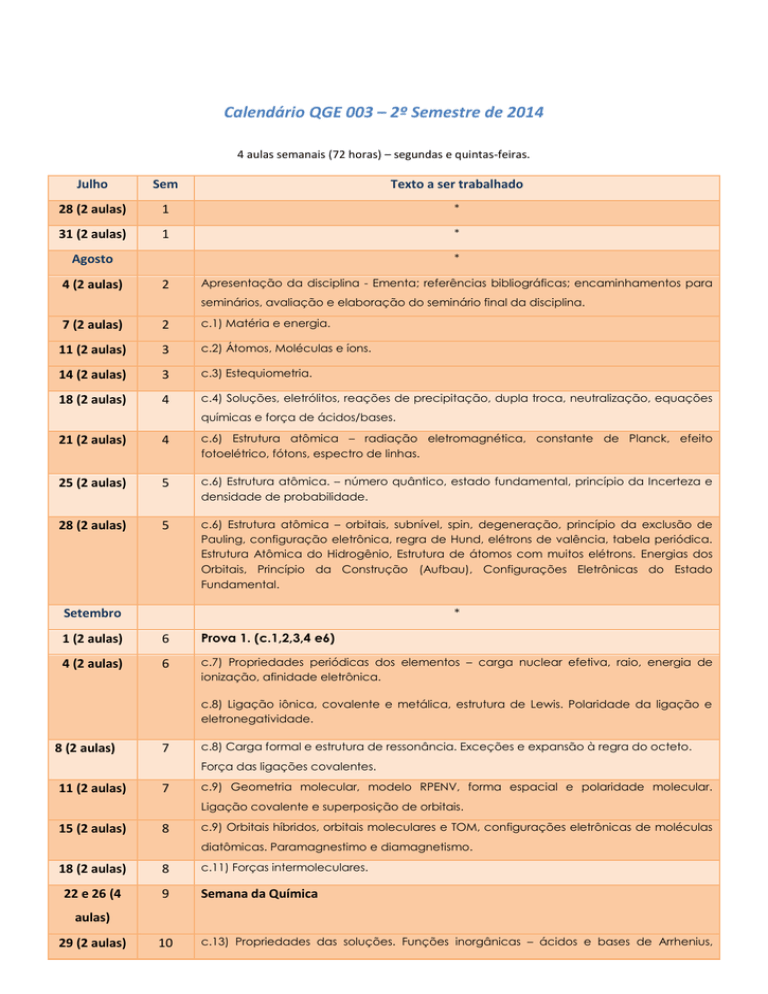
Calendário QGE 003 – 2º Semestre de 2014
4 aulas semanais (72 horas) – segundas e quintas-feiras.
Julho
Sem
Texto a ser trabalhado
28 (2 aulas)
1
*
31 (2 aulas)
1
*
*
Agosto
4 (2 aulas)
2
Apresentação da disciplina - Ementa; referências bibliográficas; encaminhamentos para
seminários, avaliação e elaboração do seminário final da disciplina.
7 (2 aulas)
2
c.1) Matéria e energia.
11 (2 aulas)
3
c.2) Átomos, Moléculas e íons.
14 (2 aulas)
3
c.3) Estequiometria.
18 (2 aulas)
4
c.4) Soluções, eletrólitos, reações de precipitação, dupla troca, neutralização, equações
químicas e força de ácidos/bases.
21 (2 aulas)
4
c.6) Estrutura atômica – radiação eletromagnética, constante de Planck, efeito
fotoelétrico, fótons, espectro de linhas.
25 (2 aulas)
5
c.6) Estrutura atômica. – número quântico, estado fundamental, princípio da Incerteza e
densidade de probabilidade.
28 (2 aulas)
5
c.6) Estrutura atômica – orbitais, subnível, spin, degeneração, princípio da exclusão de
Pauling, configuração eletrônica, regra de Hund, elétrons de valência, tabela periódica.
Estrutura Atômica do Hidrogênio, Estrutura de átomos com muitos elétrons. Energias dos
Orbitais, Princípio da Construção (Aufbau), Configurações Eletrônicas do Estado
Fundamental.
*
Setembro
1 (2 aulas)
6
Prova 1. (c.1,2,3,4 e6)
4 (2 aulas)
6
c.7) Propriedades periódicas dos elementos – carga nuclear efetiva, raio, energia de
ionização, afinidade eletrônica.
c.8) Ligação iônica, covalente e metálica, estrutura de Lewis. Polaridade da ligação e
eletronegatividade.
8 (2 aulas)
7
c.8) Carga formal e estrutura de ressonância. Exceções e expansão à regra do octeto.
Força das ligações covalentes.
11 (2 aulas)
7
c.9) Geometria molecular, modelo RPENV, forma espacial e polaridade molecular.
Ligação covalente e superposição de orbitais.
15 (2 aulas)
8
c.9) Orbitais híbridos, orbitais moleculares e TOM, configurações eletrônicas de moléculas
diatômicas. Paramagnestimo e diamagnetismo.
18 (2 aulas)
8
c.11) Forças intermoleculares.
22 e 26 (4
9
Semana da Química
aulas)
29 (2 aulas)
10
c.13) Propriedades das soluções. Funções inorgânicas – ácidos e bases de Arrhenius,
Bronsted-Lowry e Lewis. Sais e óxidos.
Outubro
*
2 (2 aulas)
10
EDEQ
6 (2 aulas)
11
Revisão
9 (2 aulas)
11
13 (2 aulas)
12
c.14) Cinética química.
16 (2 aulas)
12
c.14) Cinética química.
20 (2 aulas)
13
c.15) Equilíbrio Químico.
23 (2 aulas)
13
c. 16) Equilíbrio Químico.
27 (2 aulas)
14
FERIADO (27 a 29 de outubro)
30 (2 aulas)
14
c. 5 e 19) Termoquímica.
Prova 2 (c.7, 8,9,11,13)
Novembro
*
3 (2 aulas)
15
c.19) Termoquímica.
6 (2 aulas)
15
c.20) Eletroquímica.
10 (2 aulas)
16
c.20) Eletroquímica.
13 (2 aulas)
16
c.20) Eletroquímica.
17 (2 aulas)
17
Revisão
20 (2 aulas)
17
Prova 3. (c.14,15,16,5,19,20)
24 (2 aulas)
18
Seminário – Experimentos em Química (3 equipes)
27 (2 aulas)
18
Seminário – Experimentos em Química (3 equipes)
Dezembro
*
1 (2 aulas)
21
- Entrega de notas.
4 (2 aulas)
21
EXAME FINAL
Avaliações da disciplina:
*Seminário (20%): Nota do trabalho x 0,20.
Obs.: A turma deverá se organizar em seis equipes (4 membros) e entregar nomes da equipe até 21 de
agosto. Em seguida será sorteado um tema por equipe e o seminário consiste em apresentar, discutir,
explicar e executar para a turma um experimento de química que tenha relação com o tema sorteado.
O experimento poderá ser simples, mas que permita compreender os conceitos químicos relacionados
ao tema sorteado. Tempo para apresentação: 20 minutos.
*Lista de exercícios/ estudo dirigido: Nota das listas x 0,20.
Obs.: Listas encaminhadas por e-mail com exercícios de fixação. Entrega em data a combinar.
*Provas (60%): Média das provas 1,2 e 3 x 0,60. Questões gerais (objetivas e teóricas) sobre os capítulos
estudados. Trazer calculadora semicientífica. Providenciar uma tabela periódica.