Aula: 07
Temática: Equilíbrios Ácido-Base – Parte II
Ácidos e bases fracas
Numa solução aquosa de bases fracas e de ácidos, ocorre o equilíbrio entre íons e tipos químicos dos ácidos ou bases. Considerando HA um ácido
fraco, temos a equação de ionização, e a sua constante de ionização ou
dissociação:
HA + H2O ↔ H30+ + A–
K a [ H3O ][ A ]
[ HA]
Seja: Ka = constante de ionização do ácido fraco;
[A –] = concentração molar de íons A– presente no equilíbrio;
[H3O+] = concentração molar de íons H3O+ presente no equilíbrio;
[HA] = concentração molar de ácido fraco não dissociado presente no
equilíbrio.
De forma parecida ao que fizemos com o ácido forte, podemos também
fazer uma representação em esquema da dissociação de um ácido fraco,
como mostra na próxima figura.
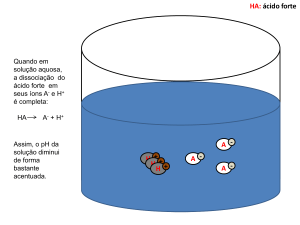
Devemos destacar que o estado “antes da dissociação” jamais existirá
verdadeiramente em uma solução, pois a solução estará sempre em equilíbrio. O lado esquerdo é simplesmente uma teoria:
Antes da dissociação
Após a disposição
no “equilíbrio”
HA
HA
H+
A–
Dissociação de um ácido forte
QUÍMICA ANALÍTICA QUALITATIVA I
31
Se menor é o valor da constante de equilíbrio Ka de um ácido, mais fraco é
este ácido. E o mútuo é verdade, simplesmente, em termos relativos.
Não devemos confundir o ácido fraco com o ácido diluído. O ácido fraco
tem valor de Ka baixo e o ácido diluído tem concentração pequena. Pode
haver um ácido fraco concentrado ou um ácido forte, ambos diluídos.
Seja a reação geral de dissociação do ácido fraco em solução aquosa:
HA + H2O ↔ H3O++ ASeja Ca a concentração molar do ácido fraco primeiramente diluído na solução e de Ci e o número de mols.L–1 que após se ionizar se dissocia,
encontrando grau de ionização (a) do ácido fraco a afinidade entre a concentração molar que passou por ionização (Ci) e a concentração molar
inicialmente diluída (Ca), ou seja, o número de mol/L que se ioniza por
mol/L diluído.
Ci
Ca
No equilíbrio:
[HA] = Ca – Ci
[H3O+] = Ci
[A –] = Ci
Suprindo as concentrações na expressão de ionização do ácido fraco, na
equação da constante de ionização do ácido fraco, temos:
[ H O ][ A ]
Ci Ci
Ci
Ka 3
[ HA]
Ca Ci Ca Ci
Sabendo-se que:
a Ci
Ca
Assim:
Ci = Ca . α
32
QUÍMICA ANALÍTICA QUALITATIVA I
2
Portanto:
(Ca )
Ca
Ca
Ka
Ca Ca . Ca (1 )
1
2
2
2
2
Ca.α2 = Ka (1– α) = Ka – Ka.α
Ca.α2 + Ka.α – Ka = 0
K a K a 4K a.Ca
2C a
2
Na equação, não se usa o sinal negativo na raiz, pois, no
final teríamos sempre um resultado negativo, o que é impossível, porque não há grau de ionização negativo.
Se a ionização é pequena, ou seja, α ≤ 5% ou ≤ 0,05, a diferença 1 – α
é considerada praticamente igual a 1. Assim a equação da constante de
equilíbrio (Ka) será:
Ka = Ca. α2
Então,
2
Ka
Ca
e
Ka
Ca
Considere de forma parecida tudo que vimos para um ácido
fraco também para uma base fraca. Substituindo apenas Ka
por Kb e Ca por Cb nas fórmulas demonstradas.
Com a diluição, o grau de ionização de ácidos e bases fracas aumentam.
Consideramos que, quanto maior a concentração da solução, mais o equilíbrio se desloca para a esquerda e, quanto mais dissolvido mais o equilíbrio se desloca para a direita (“Lei da diluição de Ostwald”).
HA + H2O ↔ H3O+ + A –
ou
B + H2O ↔ BH+ + OH–
QUÍMICA ANALÍTICA QUALITATIVA I
33
Novamente, vejamos aqui o equilíbrio de ionização do ácido fraco HA:
HA + H2O ↔ H3O++ A–
Ácido1
Base2
Ácido2
Base1
Segundo o conceito de Brönsted-Lowry, temos os seguintes pares combinados: Par nº 1: HA e A –; par nº 2: H2O e H3O+
Dada a constante de ionização do ácido HA pela equação:
[ H O ][ A ]
Ka 3
[ HA]
Sendo constante de ionização da base A–, combinada do ácido HA é encontrado do equilíbrio:
A– + H2O ↔ HA + OH–
]
K b [ HA][ OH
[A ]
Fazendo a multiplicação entre as constantes de ionização do ácido e de
sua base combinada:
[ H3O ][ A ] [ HA][ OH ]
Ka Kb
[ H3O ].[ OH ] Kw
.
[ HA] [ A ]
Então temos,
Fazendo o inverso e inserindo o logaritmo:
Ka.Kb = Kw = 10–14 (25ºC)
1111
log ----- + log -----=log -----= log ----Ka
Kb
Kw
10–14
pKa + pKb = pKw = 14 (25ºC)
34
QUÍMICA ANALÍTICA QUALITATIVA I