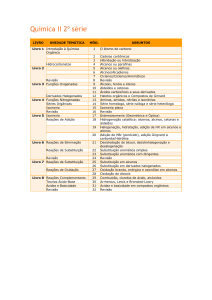
Ementa
Data
Aula
Conteúdo
Livro
07/02
14/02
21/02
Revisão
Carnaval
28/02
Alcenos, dienos e alcinos. Estrutura, obtenção e estabilidade.
Cap. 6 e 7
06/03
Reações de substituição nucleofílica
Cap. 11
13/03
Reações de eliminação
Cap. 11
20/03
Aromáticos: estabilidade, orbitais, ressonância, regra de Huckel.
Cap. 15
27/03
Aromáticos: nitração, sulfonação, halogenação, acilação, alquilação.
Cap. 16
03/04
Aromáticos: orientação da substituição no anel.
Cap. 16
Aldeídos e cetonas.
Cap. 19
08/05
Aldeídos e cetonas.
Cap. 19
15/05
Ácidos carboxílicos e nitrilas.
Cap. 20
22/05
Derivados de ácido carboxílico.
Cap. 21
29/05
Reações de substituição alfa.
Cap. 22
05/06
Reações de condensação.
Cap. 23
10/04
Prova
17/04
24/04
Feriado
01/05
Feriado
12/06
Prova
19/06
26/06
Prova
Bibliografia: Química Orgânica. John McMurry. Volumes 1 e 2. 7ª Edição.
1
ALCENOS
Capítulos 6 e 7
Profª Fernanda das Neves Costa
27/02/2012
2
Sumário
Reações de adição eletrofílica a alcenos (6.7)
Regra de Markovnikov (6.8)
Estabilidade de carbocátions (6.9)
Postulado de Hammond (6.10)
Rearranjo de Carbocátion (6.11)
Reações de alcenos:
Adição de halogênios (7.2)
Adição de halo-hidrina (7.3)
Adição de H2O (7.4)
Redução de alcenos (7.7)
Oxidação de alcenos (7.8 e 7.9)
3
Reações de Adição
Eletrofílica a Alcenos
Ligação dupla carbono-carbono: rica em elétrons
Doação de par de elétrons para um eletrófilo
4
Reações de Adição
Eletrofílica a Alcenos
Diagrama de energia da reação de
adição eletrofílica:
2 picos (estado de transição)
1 vale (intermediário de reação)
Energia do carbocátion > Energia do
alceno, porém a reação como um todo é
exergônica (ΔG° negativo)
1ª etapa é lenta, determinante da
velocidade da reação
Uma vez formado o carbocátion, ele é
rapidamente transformado no produto
final (ΔG2 < ΔG1)
5
Reações de Adição
Eletrofílica a Alcenos
Adição eletrofílica de HX a alcenos ocorre com:
HBr
HCl
HI
6
ATENÇÃO!!!
Diferentes maneiras de se escrever uma reação orgânica:
7
Regra de Markovnikov
As reações de adição eletrofílica são regioespecíficas (quando somente uma de diversas
possibilidades de adição ocorre).
8
Regra de Markovnikov
Regra de Markovnikov: na adição de HX a um alceno, o H se liga ao carbono com número
menor de substituintes alquila, enquanto o X se liga ao carbono com número maior de
substituintes alquila.
Se os carbonos da ligação dupla possuírem o mesmo nível de substituição, ocorrerá mistura
de produtos:
9
Regra de Markovnikov
Como carbocátions estão envolvidos como intermediários de reação...
Regra de Markovnikov: na adição de HX a um alceno, o carbocátion mais substituído (mais
estável!) é formado como intermediário de reação
10
Estabilidade de Carbocátions
A estabilidade de carbocátions aumenta com o aumento da substituição, portanto:
11
Postulado de Hammond
Sabe-se que:
Adição eletrofílica a alcenos assimétricos geram como intermediários os carbocátions
mais substituídos. Esses carbocátions se formam mais rápido que os menos substituídos e,
uma vez formados, reagem rapidamente para dar o produto final.
Quanto mais substituído o carbocátion, mais estável ele será.
Mas o que a estabilidade do carbocátion afeta a velocidade de formação e determina a
estrutura do produto final?
12
Postulado de Hammond
Comparando-se duas reações, vê-se
que o intermediário mais estável é
formado mais rapidamente.
O estado de transição representa a energia máxima da reação. Ocorrem transitoriamente
durante o curso da reação e se transformam imediatamente em espécies mais estáveis.
13
Postulado de Hammond
Postulado de Hammond: é possível se ter uma idéia da estrutura do intermediário de
reação olhando a estrutura da espécie estável mais próxima.
(a) Reação endergônica: energia do estado de transição é mais próxima do produto.
(b) Reação exergônica: energia do estado de transição é mais próxima do reagente.
14
Postulado de Hammond
Como aplicar o Postulado de Hammond as reações de adição eletrofílica?
A formação do carbocátion pela
protonação
do
alceno
é
endergônica: estado de transição
semelhante ao produto. Qualquer
fator que estabilize o carbocátion,
estabilizará o estado de transição,
tornando a reação mais rápida.
Carbocátions estáveis se formam mais rápido pelo fato da estabilidade refletir-se na menor
energia do estado de transição.
15
Rearranjo de Carbocátions
16
Reações de Alcenos
17
Reações de Alcenos
1. Adição de halogênios
Br2 e Cl2 são rapidamente adicionados a alcenos por processo chamado halogenação,
gerando di-haletos vicinais.
Mecanismo plausível,
porém não explica a
estereoquímica.
O que acontece na
realidade:
18
Reações de Alcenos
2. Adição de halo-hidrina
HO-Cl e HO-Br são adicionados a alcenos gerando 1,2-haloálcool, chamados de halo-hidrinas.
Atenção! Essa reação NÃO ocorre pela adição direta de HOCl/ HO-Br!
19
Reações de Alcenos
3. Adição de água
H2O pode ser adicionada a alcenos, com auxílio de ácidos
fortes, em processo chamado hidratação, gerando álcoois.
20
Reações de Alcenos
4. Redução – Hidrogenação
Alcenos reagem com H2 na
presença de ácido catalítico.
21
Reações de Alcenos
5. Oxidação - Epoxidação
Alcenos reagem com perácidos gerando epóxidos.
A síntese de epóxidos também pode ser feita utilizando-se halo-hidrinas:
22
Reações de Alcenos
6. Oxidação - Hidroxilação
Epóxidos sofrem abertura do anel na presença de água.
23
Reações de Alcenos
7. Oxidação – Clivagem oxidativa
24
Exercício
25
Exercício
26
Exercício
27
Exercício
28