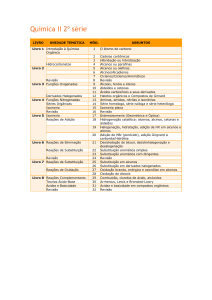
Reações Orgânicas
1- Reações de Substituição Por Radicais
Como visto anteriormente, a formação de radicais é dada pela
quebra homolítica de ligações. Para que esta quebra ocorra é
necessário que haja o fornecimento de energia na forma de calor
(aquecimento) ou irradiação de luz.
Exemplo 1: Peróxidos
R
O O
R
Calor
2R
O
Exemplo 2: Halogênios
X X
Calor o u Luz
2
X
Os radicais são altamente reativos. Quando colidem com outras
moléculas (de alcano, por exemplo), tendem a reagir para alcançar a
estabilidade. Uma maneira de isso ocorrer é, por exemplo, quando um
radical de halogênio extrai um hidrogênio de um alcano.
1.1- Mecanismo de Reações de Substituição Por Radicais
Exemplo: Cl2 + C2H6 C2H5Cl + HCl
Mecanismo:
Calor ou Luz
Cl Cl
+
Cl
H
H
H C
C
H
H
2 Cl
H
H
H
C
C
H
H
H
+
HCl
Após perder um hidrogênio o alcano se torna um radical e tende
a reagir com outra espécie (um outro radical de cloro, por exemplo)
para alcançar a estabilidade.
+
Cl
H
H
C
C
H
H
H
H
H
Cl C
C
H
H
H ou Cl
H
H
C
C
H
H
H +
1.2 – Energias de Dissociação Homolíticas de Ligações
Para fazer os cálculos das energias de dissociação de ligação
deve-se ter em mente que para o rompimento de ligações o ∆ é
positivo, e para a formação de ligações o ∆ é negativo. Os valores de
∆ de dissociação de ligações são tabelados. Para a reação anterior,
temos:
Cl
Cl
+
∆H = 243 KJ/mol
H
H
H
C
C
H
H
∆ H= 341 KJ/mol
H
Cl
H
H
C
C
H
H
∆ H= 410 KJ/mol
Assim, concluí-se que a reação é exotérmica.
H
+
H
Cl
∆ H= 431 KJ/mol
HCl
1.3 Estabilidade dos Radicais
A estabilidade dos radicais segue a sequência abaixo:
Assim, numa reação de halogenação (cloração) do butano forma
preferencialmente o 2-Cloro-butano em comparação com o 1-Clorobutano, pois no 2-Cloro-butano houve a formação de um radical
secundário que é mais estável do que o radical primário no caso do 1Cloro-butano.
H
H
H
H
H
H
H
H
H
C
C
C
C
H
Cl
H
H
H
Produto majoritário
Cl
Cl
+
H
C
C
C
C
H
H
H
H
H
H
H
H
H
H
C
C
C
C
H
Cl
H
H
H
Produto minoritário
2- Algumas Reações dos Alcanos
Os alcanos devido serem relativamente inertes sofrem poucas
reações sempre precisando de algumas condições especiais.
2.1- Reações de Halogenação
As reações de halogenação já foram discutidas na seção anterior.
2.2- Reações de Combustão
Quando provocamos a ignição de alcanos ou cicloalcanos na
presença de oxigênio produzem o dióxido de carbono, água e calor, se a
reação for completa. Por exemplo, a combustão do metano, que é o
principal constituinte do gás natural.
CH4 (g) + 2 O2 (g)
CO 2 (g) +
∆ H = -890 KJ/mol
2 H2O
A combustão de é muito exotérmica, fornecendo sempre CO2 e
H2O, se a reação for completa ou parcial, levando a produtos
intermediários. O mecanismo de reação é via radicais livres com vários
intermediários.
2.3- Reações de Sulfonação
Quando reagimos um alcano com um ácido sulfúrico (H2SO4) sob
aquecimento ocorre uma reação de sulfonação.
Exemplo:
H
H
H
C
C
H
H
H
+
HO
SO 3H
H
H
H
C
C
H
H
SO3H
+
2.4- Reações de Nitração
Quando reagimos um alcano com ácido nítrico (HNO3) sob
aquecimento ocorre uma reação de nitração.
Exemplo:
H 2O
H
H
H
C
C
H
H
H
+
HO
NO2
H
H
H
C
C
H
H
NO2
+ H2O
2.5 Reações de Pirólise
Pirólise é um processo onde ocorre uma ruptura da estrutura
molecular original de um determinado composto pela ação do calor em
um ambiente com pouco ou nenhum oxigênio. Este processo é
bastante usado na indústria petroquímica na fabricação de gasolina ou
nas indústrias de fibra de carbono.
Outra aplicação da pirólise é no tratamento do lixo ocasionando
sua decomposição.
Exemplo:
3
Sem O2
3-Reações de Alcenos
3.1 Reações de Adição Eletrofílica
Reações de adição eletrofílica são características de compostos
insaturados, como alcenos e alcinos.
Exemplo Geral:
Duas características da ligação dupla ajudam a compreender
porque tais reações de adição ocorrem:
1. Uma reação de adição é o resultado da conversão de uma
ligação pi (π) e uma ligação sigma (σ) em duas ligações sigma;
2. Os elétrons da ligação π estão expostos. Assim, funcionam
como nucleófilos suscetível a reagentes com deficiência de
elétrons (eletrófilos).
3.2 – Adição Iônica de Haletos de Hidrogênio Aos Alcenos: A Regra
de Markovnikov
Os haletos de hidrogênio (HI, HBr, HCl e HF) se adicionam à
ligação dupla dos alcanos:
A adição de HX a um alceno assimétrico poderia ocorrer
alternaticamente por dois modos, mas na prática só um predomina.
Exemplo 1: Adição de HBr ao propeno
Exemplo 1: Adição de HBr ao 2-metilpropeno
Este comportamento é explicado pela Regra de Markovnikov
que diz que a adição iônica de um reagente assimétrico à dupla ligação,
a porção positiva do reagente de adição se liga ao átomo de carbono da
ligação dupla de modo a formar o carbocátion mais estável. Assim, Na
adição de um haleto de hidrogênio a um alceno, pode-se, vulgarmente,
dizer que o átomo de hidrogênio irá se adicionar ao átomo de carbono
com maior número de átomos de hidrogênio.
Mecanismo:
3.3 – Outros Tipos de Reações de Adição Eletrofílica a Alcenos
4 – Adição de Radicais Livres Aos Alcenos:
Adição
Anti-Markovnikov
do
Brometo
de
Hidrogênio
Após inúmeras pesquisas os cientistas descobriram que a adição
de HBr a alcenos poderiam ocorrer de forma inversa à adição de
Markovnikov. Este comportamento pela ocorria pela presença de
peróxidos orgânicos nos alcenos, gerando radicais livres. Este tipo de
reação foi chamado de reações de adição anti-Markovnikov.
Descobriu-se também que este tipo de reação só funciona para o HBr.
Sob estas condições, o propeno, por exemplo, produz 1-Bromopropeno. Na ausência de peróxidos, ou na presença de compostos que
“capturam” os radicais, ocorre a adição de Markovnikov normal.
Mecanismo:
4.1- Polimerização de Alcenos Via Adição Radicalar
Os polímeros (do grego: poli = muitos e meros = parte) são
substância que consistem em moléculas muito grandes chamados
macromoléculas que são constituídas de várias subunidades que se
repetem. As subunidades moleculares que são usadas para sintetizar
os polímeros são chamadas de monômeros, e as chamados de
polimerização. Os plásticos, as borrachas, as proteínas, os DNA’s e
RNA’s são exemplos de polímeros.
Muitas reações de polimerizações são iniciadas por radicais.
O etileno (eteno), por exemplo, é o monômero que é usado para
sintetizar o conhecido polietileno.
Onde m e n são números muito grandes.
Como os polímeros tais como o polietileno são feitos pelos
reações de adição, são chamados de polímeros de crescimento de
cadeia. A tabela abaixo mostra alguns polímeros deste tipo:
5-Oxidação de Alcenos
Os alcenos sofrem várias reações em que a ligação dupla carbonocarbono é oxidada. A seguir, mostraremos varias reações como estas.
5.1- Oxidação de Alcenos Por Permanganato de Potássio
(KMnO4)
O permanganato de potássio pode ser utilizado para oxidar os
alcenos a 1,2-diois que são, comumente, chamados de glicóis. Este
processe se dá em soluções básicas a frio.
O mecanismo para a formação de glicóis através das oxidações
pelos íons permanganato envolve, inicialmente, a formação de
intermediários cíclicos . Em seguida, ocorrem, em diversas etapas, a
clivagens na ligação metal oxigênio (representadas pelas linhas
tracejadas a seguir), produzindo-se, por fim, o glicol e MnO2.
Mecanismo Simplificado:
5.2 Clivagem Oxidativa dos Alcenos
Os alcenos com átomos de carbono monosubstituídos são
clivados (quebrados) oxidativamente a sais de ácidos carboxílicos por
soluções básicas de permanganato de potássio a quente. Podemos
ilustrar esta reação com a clivagem oxidativa do cis ou trans-2buteno,
formando dois equivalentes molares do íon acetato.
A acidificação da mistura, depois da oxidação estar completa,
produz 2 mols de ácido acético para cada mol de 2-buteno.
O grupo CH2 é totalmente oxidado a dióxido de carbono (CO2) e
água por solução básica de permanganato de potássio a quente. O
átomo o átomo de carbono dissubstituído de uma ligação dupla tornaC
se o grupo carbonila
O
de uma cetona.
5.3- Oxidação de Alcenos por Ozonólise
Um método usado mais amplamente para localizar a ligação dupla
de alcenos envolve o uso do ozônio (O3). O ozônio reage vigorosamente
com os alcenos gerando compostos instáveis de baixo peso molecular
que muitas vezes explodem violentamente. Devido a esta propriedade
eles normalmente não são isolados, mas sim reduzidos diretamente
por tratamento com zinco e ácido acético (ácido etanóico - HOAc). A
redução gera a formação de compostos carbonílicos (aldeídos ou
cetonas) que podem ser isolados e identificados com segurança.
Exemplo 1:
Exemplo 2:
5.4- Oxidação de Alcenos por Combustão
Como visto anteriormente, a combustão completa de qualquer
composto orgânico necessita da presença de oxigênio e gera dióxido
de carbono (CO2), água e calor. Veja a seção 2.2.
Exemplo: A combustão do etileno (eteno).
H
H
C
H
C
+
3 O2
2 CO2
+
2 H 2O
H
6- Reações de Substituição Eletrofílica
As reações de substituição eletrofílica são reações características de
benzenos e/ou arenos que ocorrem quando benzenos reagem com
reagentes eletrofílicos. Estas reações são do tipo geral mostrado aqui.
O benzeno é suscetível ao ataque eletrofílico principalmente devido
à exposição de seus elétrons π. Desse modo, o benzeno se parece com
um alceno, porque na reação de um alceno com um eletrófilo, o sítio de
ataque é a ligação π exposta.
O benzeno difere de um alceno de uma maneira muito
significativa. A camada fechada dos seis elétrons π confere a ele uma
estabilidade especial. Assim, embora o benzeno suscetível ao ataque
eletrofílico, sofre reações de substituição em vez de reações de
adição. Reações de substituição permitem aos seis elétrons π do
aromático serem regenerados após o ataque eletrofílico. Podemos ver
como isso ocorre, se examinamos o mecanismo geral para substituição
aromática eletrófílica.
A primeira etapa é a etapa lenta, pois ocorre a formação do
carbocátion. Esta etapa determina a velocidade da reação.
A segunda etapa é a etapa rápida em comparação com a etapa 1.
6.1- Reações halogenação de benzenos
O benzeno não reage com bromo ou cloro a menos que um ácido
de Lewis esteja presente na mistura. Quando ácidos de Lewis estão
presentes, o benzeno reage prontamente com bromo ou cloro. Estas
reações fornecem bromobenzeno ou clorobenzeno, respectivamente,
com bons rendimentos.
6.2- Reações de Nitração do Benzeno
O benzendo reage lentamente com o ácido nítrico concentrado a
quente para fornecer nitrobenzeno.
6.3- Reações de Sulfonação do Benzeno
O benzeno reage com ácido sulfúrico fumegante à temperatura
ambiente para produzir o ácido benzenossulfônico. O ácido sulfúrico
fumegante é ácido sulfúrico que contém trióxido de enxofre extra
(SO3). A sulfonação também ocorre também ocorre em ácido sulfúrico
concentrado sozinho, porém mais lentamente.
Em todas as reações, o eletrófilo parece ser o trióxido de enxofre.
Em ácido sulfúrico concentrado, o trióxido de enxofre é produzido em
um equilíbrio onde H2SO4.
6.4- Reações de Alquilação de Friedel-Crafts de Benzenos
As reações de alquilações são reações que inserem um grupo
alquila (uma cadeia carbônica) ao benzeno. Este tipo de reações
ficaram conhecidas como reações de Friedel-Crafts por causa de seus
descobridores.
6.5- O Efeito dos substituintes Sobre Reatividade e Orientação
Quando benzenos substituídos sofrem ataque eletrofílico, os
grupos já presentes no anel afetam tanto a reatividade (velocidade)
quanto a orientação (sítio de ataque eletrofílico).
Podemos dividir os dois grupos substituintes em duas classes de
acordo com sua influência sobre a reatividade do anel. Aqueles que
tornam o anel mais reativo são chamados de grupos ativadores e
orientam o ataque na posição orto e para. Grupos ativadores são
grupos que “jogam” elétrons para dentro do benzeno pelo efeito
indutivo. Aqueles que tornam o anel menos reativo, são chamados de
grupos desativadores e orientam o ataque na posição meta. Grupos
desativadores são grupos que “retiram” elétrons do dentro do benzeno
pelo efeito indutivo
6.5.1- Grupos Ativadores: Orientadores Orto-Para
O grupo metila é um grupo ativador e um orientador orto-para.
O tolueno reage consideravelmente mais rápido do que o benzeno em
todas as reações de substituições eletrofílicas.
6.5.1- Grupos Desativadores: Orientadores Meta
O grupo nitro é um grupo desativador muito forte. Assim, é um
orientador meta.