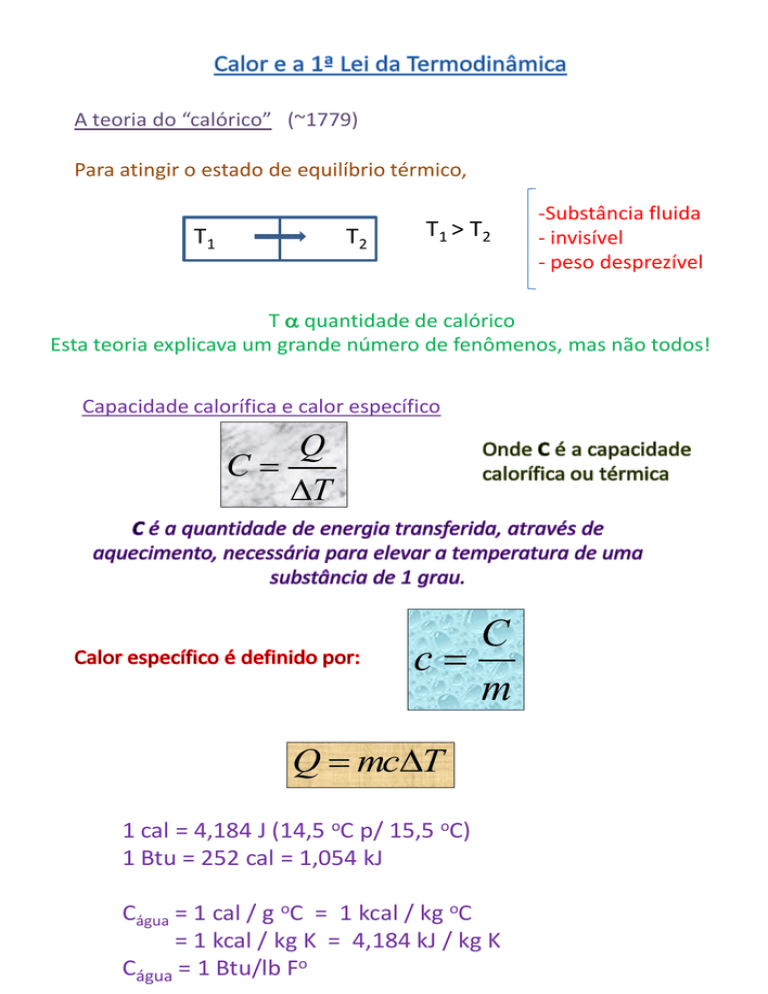
A teoria do “calórico” (~1779)
Para atingir o estado de equilíbrio térmico,
T1
T2
T 1 > T2
-Substância fluida
- invisível
- peso desprezível
T a quantidade de calórico
Esta teoria explicava um grande número de fenômenos, mas não todos!
Capacidade calorífica e calor específico
Q
C
T
C
c
m
Q mcT
1 cal = 4,184 J (14,5 oC p/ 15,5 oC)
1 Btu = 252 cal = 1,054 kJ
Cágua = 1 cal / g oC = 1 kcal / kg oC
= 1 kcal / kg K = 4,184 kJ / kg K
Cágua = 1 Btu/lb Fo
C
c
n
,
C
mc
c
Mc
n
n
,
Chidrogênio = 3,4 cal/goC
chélio = 1,25 cal/goC
Ex 18-1 Que quantidade de calor é necessária para elevar de 20 oC a
temperatura de 3 kg de cobre?
Calorímetro: recipiente com água termicamente isolado
O calor liberado pelo corpo será:
Qsai mc cc Tf Tic
Qentra ma ca T f Tia mr cr T f Tia
Qsai Qentra 0
mc cc T f Tic ma ca T f Tia mr cr T f Tia 0
Ex 18-2 Para medir o calor específico do chumbo, uma pessoa
aquece 600 g de granalha de chumbo até a temperatura de 100 oC e
depois coloca este conteúdo num calorímetro de alumínio com 200
g de massa, contendo 500 g de água, inicialmente a 17,3 oC. Se a
temperatura final do conjunto for 20,0 oC, qual o calor específico do
chumbo? (cAl = 900 J/kg K)
Sólidos, Líquidos e Gases
Substâncias
na natureza
3 fases
ou
estados
Sólida ou
líquida ou
gasosa
Determinada
pela T e p
Ex.: Nas condições ambientes (24 oC e 1 atm)
Fe (sólido)
H2O (líquida)
líquido (quando aumenta a T)
gás (quando aumenta a T ou abaixa a p)
Quando uma substância passa de uma fase para outra,
diz-se que houve uma mudança de fase ou de estado
Estudaremos as leis que descrevem o comportamento das
substâncias ao mudarem de fase
ESTADO SÓLIDO
Devido a forte ligação: forma própria e resistência a
deformação
Cristais
Uma mesma substância pode se apresentar em estruturas cristalinas
diferentes
Fulerenos
“Onions”
C20+2m (m=0,2,3,...)
“Carbynes”
Poliênica
C C C C
Cumulênica
C C C C
Nanotubos
Amorfos – quando os átomos não estão distribuídos numa
estrutura organizada (vidro, asfalto, plásticos, borracha, etc)
ESTADO LÍQUIDO
• Átomos estão mais afastados.
• A força de ligação entre eles é mais fraca que nos sólidos
• Existem pequenas translações dos átomos
Propriedades: -podem escoar
- não oferecem resistência a penetração
- tomam a forma do recipiente
- átomos estão distribuídos aleatoriamente
ESTADO GASOSO ( já estudamos!)
Fornecendo ou retirando calor
Varia a agitação molecular
Ecinética
A força de ligação entre os átomos é
alterada
Acarretando modificações na organização e
separação dos átomos
Ou seja, pode ocasionar uma mudança de
fase
3
kT
2
FUSÃO E SOLIDIFICAÇÃO
1) A uma dada pressão, a temperatura na qual ocorre a
fusão (ponto de fusão) é bem determinada para cada
substância.
Leis da Fusão:
2) Se um sólido se encontra em sua temperatura de
fusão, é necessário fornecer calor a ele para que
ocorra a mudança de estado. A quantidade de calor
que deve ser fornecida, por unidade de massa, é
denominada calor latente de fusão, que é
característico de cada substância.
3) Durante a fusão, a temperatura do sólido permanece
constante.
- Estas leis valem apenas para
sólidos cristalinos
- Nos amorfos a mudança de fase
é gradativa (estados
intermediários pastosos)
Pontos de fusão e calores latentes de fusão (à p = 1 atm)
Substância
Ponto de fusão (o C)
Calor latente (cal/g)
Platina
1775
27
Prata
961
21
Chumbo
327
5,8
Enxofre
119
13
Água
0
80
Mercúrio
-39
2,8
Álcool etílico
-115
25
Nitrogênio
-210
6,1
Ebulição
Leis da Ebulição:
1) A uma dada pressão, a temperatura na qual ocorre a EBULIÇÃO
(ponto de ebulição) é bem determinada para cada substância.
2) Se um líquido se encontra em sua temperatura de ebulição, é
necessário fornecer calor a ele para que o processo seja
mantido. A quantidade de calor que deve ser fornecida, por
unidade de massa, é denominada calor latente de vaporização,
que é característico de cada substância.
3) Durante a ebulição, apesar de se fornecer calor ao líquido, sua
temperatura permanece constante e o vapor que vai sendo
formado encontra-se à mesma temperatura do líquido.
Pontos de ebulição e calores latentes de vaporização (à p =
1 atm)
Substância
Ponto de fusão (o C)
Calor latente (cal/g)
Iodo
184
24
Bromo
59
44
Hélio
-269
6
Água
100
540
Mercúrio
357
65
Álcool etílico
78
204
Nitrogênio
-196
48
VAPORIZAÇÃO
Duas maneiras:
1) por Evaporação - a passagem se faz lentamente, a qualquer
temperatura. Ex.: secagem de uma roupa molhada
2) por Ebulição - passagem rápida, a uma temperatura bem determinada.
Ex.: a p = 1 atm a água começa a ferver aos 100 oC.
Evaporação:
A qualquer temperatura ocorre agitação das moléculas (v variável)
As moléculas de maior velocidade deixam o líquido e as que sobram no líquido
possuem v menor. a temperatura do líquido diminui.
Velocidade de evaporação:
1) Quanto maior a temperatura, maior a rapidez com que o líquido
evapora, isto é, Q a t a v2 e maior será a probabilidade das
moléculas escaparem da superfície livre do líquido;
2) Quanto maior for a área da superfície livre do líquido
maior é a probabilidade das moléculas escaparem;
3) Com VENTO, seca mais rápido.
Já, com clima úmido, demora
mais.
A energia necessária para fundir uma substância de
massa m sem alterar sua temperatura é:
Q f mL f
onde Lf é o calor latente de fusão da substância
E, para vaporizar:
Qv mLv
Ex 18-3 Qual a quantidade de calor necessária para transformar 1,5
kg de gelo a -20 oC e 1 atm em vapor?
3385,5 kJ
627,6 kJ
500,2 kJ
Taxa constante de 1 kJ/s
61,5 kJ
Ex 18-4 Um jarro de 2 litros, com limonada, foi colocado sobre uma
mesa de piquenique, ao sol o dia inteiro, a 33 oC. Uma amostra de
0,24 kg de limonada é derramada numa xícara com dois cubos de gelo
(cada um com 0,025 kg, a 0 oC). Considere que a xícara é feita com
isolante térmico isopor. a) admitindo que não haja perda de calor para
o ambiente, qual a temperatura final da limonada? b) qual seria a
temperatura final se fossem colocados 6 cubos de gelo?
A experiência de Joule e a 1ª Lei da termodinâmica
É possível elevar a temperatura de um sistema fornecendolhe calor, ou também realizando um trabalho sobre ele
Pesos de 772 lb (1 lb =
4,4482 N) cada
Para aumentar 1 oF a uma
distância de um pé (30,48
cm)
1 cal = 4,184 J
Equivalente
mecânico do calor
Ex 18-5 Você deixa cair um recipiente com água,
termicamente isolado, de uma altura h do solo. Se a
colisão for perfeitamente inelástica e toda a energia
mecânica se transformar em energia interna da água,
qual deve ser a altura h para a temperatura da água
aumentar de 1 oC?
mcT = mgh
h=426m
1ª Lei da Termodinâmica
Q = 100 J
W = 30 J
Eint = 70 J
Generalizando,
Eint = Q - Wsistema
Esta é a variação na quantidade
de energia interna de um
sistema quando uma
quantidade de calor é
absorvida ou cedida e um
trabalho é realizado por este
sistema ou sobre ele.
Ex 18-6 Realiza-se 25 kJ de
trabalho sobre um sistema que
consiste em 3 kg de água
agitando-se essa água por meio
de uma roda de palhetas.
Durante este período o sistema
perde 15 kcal de calor devido a
ineficiência do isolamento.
Qual a variação da energia
interna do sistema?
Trabalho positivo e Trabalho negativo
Se Vfinal > Vinicial (expansão); V>0; (T a +) T realizado pelo sistema
Se Vfinal < Vinicial (compressão); V<0; (T a -) T realizado sobre o sistema
Se Vfinal = Vinicial; V = 0; (T = 0) transformação isovolumétrica
A 1a Lei da Termodinâmica
Energia Interna (U) - Energia total existente no interior do sistema ou a soma de
todas as energias que um corpo pode ter. Está relacionada diretamente com a
temperatura!
Quando um sistema vai de um estado inicial à outro final ele troca energia com
(absorve ou libera calor Q ou realiza ou é realizado sobre ele trabalho T)
U = Q - T
Quando uma quantidade de calor Q é absorvida (Q-) ou
cedida (Q-) por um sistema, e um trabalho é realizado
por este sistema (T+) ou sobre ele (T-) a variação de
energia interna (U) do sistema é dada por U = Q - T
Exemplo 18-12
Compressão adiabática quase-estática de um gás
Uma certa quantidade de ar é comprimida através de um
processo adibático quase-estático de uma pressão inicial de 1
atm e um volume de 4 litros a 20 oC para a metade de seu
volume original. Calcule (a) a pressão final, (b) a temperatura
final e (c) o trabalho realizado sobre o gás.