Fases da matéria
Considera-se que a matéria se apresenta em três estados
distintos: sólido, líquido e gasoso.
Fases da matéria
A tabela mostra algumas características físicas de cada fase:
Fases da matéria
Uma substância pode passar de uma fase para outra
recebendo ou cedendo calor.
Fases da matéria
Outra figura para ilustrar as mudanças de fase.
Fusão
Exemplo: fusão do gelo
1ª Lei: sob pressão constante a fusão de uma substância se
processa à temperatura constante.
2ª Lei: para uma dada pressão, cada substância possui sua
própria temperatura de fusão.
A temperatura de fusão de cada substância varia com a
mudança de pressão.
Durante a fusão, a maioria das substâncias sofre aumento de
volume. Algumas, no entanto, como a água, apresentam
comportamento inverso.
Influência da pressão na fusão
1º caso: a substância 2º caso: a substância diminui
aumenta de volume ao de volume ao fundir-se (o
fundir-se (a maioria das caso da água)
substâncias)
Vaporização
Pode ocorrer de três formas:
Evaporação – quando a passagem da forma líquida para a
forma gasosa ocorre de maneira lenta na superfície do
líquido.
Ebulição – quando a passagem da forma líquida para a forma
gasosa ocorre de forma difusa em todo o líquido.
Calefação – quando a passagem da forma líquida para a
forma gasosa ocorre de forma brusca, em uma temperatura
superior à do líquido.
Influência da pressão na vaporização
1ª Lei: sob pressão constante, a ebulição de uma substância se
processa à temperatura constante.
2ª Lei: para uma dada pressão, cada substância possui sua
própria temperatura de ebulição.
A temperatura de ebulição de cada substância varia com a
mudança de pressão.
A água (novamente!) não entra em ebulição à mesma
temperatura em São Paulo e em La Paz devido à diferença de
pressão atmosférica entre as cidades.
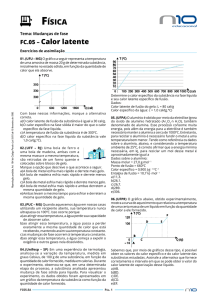
Influência da pressão na vaporização
O gráfico a seguir mostra como a pressão atmosférica varia
com a altitude:
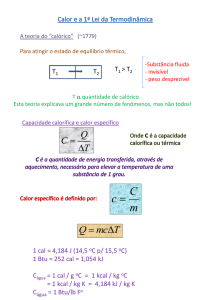
Calor latente ou calor latente específico
O calor latente provoca apenas a mudança de fase de uma
substância, sem alterar sua temperatura.
A quantidade de calor que 1 grama de uma substância
precisa ganhar ou perder para mudar de fase é denominada
calor latente específico, ou simplesmente calor latente.
Q
L = → Q = L⋅m
m
Unidade no SI : cal/g
L: calor latente da substância
Q: quantidade de calor recebida ou cedida
m: massa da substância
Aplicações
1) Considere um recipiente termicamente isolado contendo
inicialmente 200 g de gelo a – 10 °C. Determinar a
quantidade de calor que essa massa de gelo deve receber
para se transformar em 200 g de água líquida a 20 °C, dados:
calor específico do gelo = 0,5 cal/ g.°C; calor específico da
água = 1 cal/g.°C; calor latente de fusão do gelo = 80 cal/g)
Aplicações
2) Uma pedra de gelo a 0 °C é colocada em 200 g de água a
30 °C, num recipiente de capacidade térmica desprezível e
isolado termicamente. O equilíbrio térmico se estabelece em
20 °C (dados: calor específico da água = 1 cal/g.°C; calor
latente de fusão do gelo 80 cal/g). Qual é a massa da pedra
de gelo?