13ª LISTA - EXERCÍCIOS DE PROVAS – Cinética Química
Pg. 1/8
a
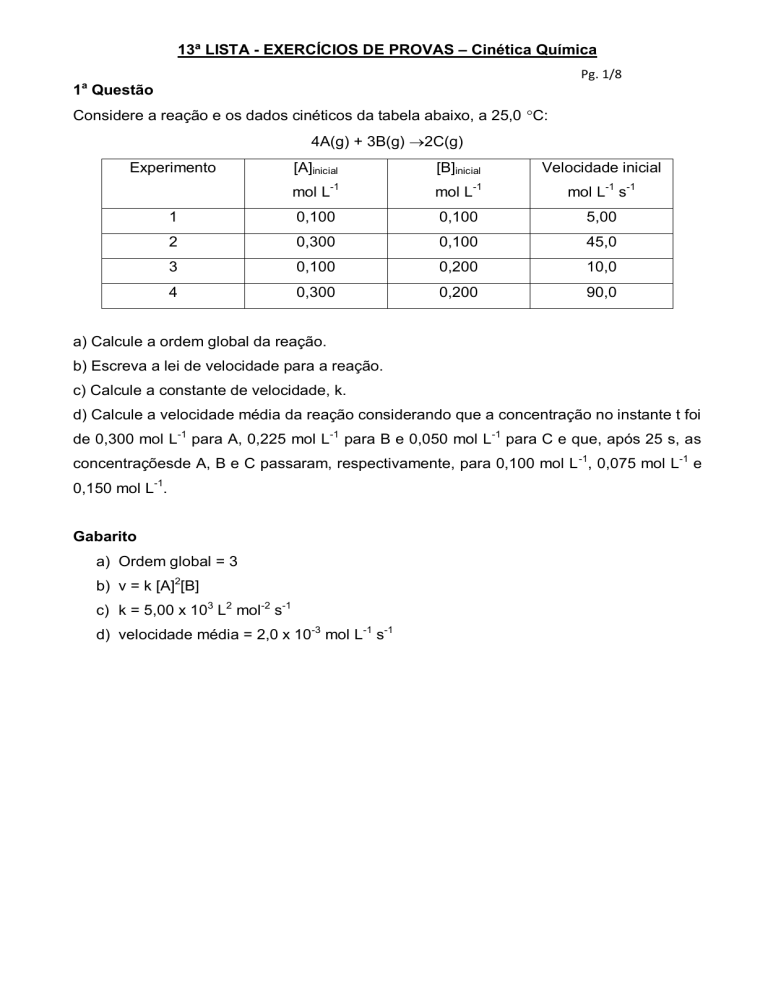
1 Questão
Considere a reação e os dados cinéticos da tabela abaixo, a 25,0 C:
4A(g) + 3B(g) 2C(g)
Experimento
[A]inicial
[B]inicial
Velocidade inicial
mol L-1
mol L-1
mol L-1 s-1
1
0,100
0,100
5,00
2
0,300
0,100
45,0
3
0,100
0,200
10,0
4
0,300
0,200
90,0
a) Calcule a ordem global da reação.
b) Escreva a lei de velocidade para a reação.
c) Calcule a constante de velocidade, k.
d) Calcule a velocidade média da reação considerando que a concentração no instante t foi
de 0,300 mol L-1 para A, 0,225 mol L-1 para B e 0,050 mol L-1 para C e que, após 25 s, as
concentraçõesde A, B e C passaram, respectivamente, para 0,100 mol L -1, 0,075 mol L-1 e
0,150 mol L-1.
Gabarito
a) Ordem global = 3
b) v = k [A]2[B]
c) k = 5,00 x 103 L2 mol-2 s-1
d) velocidade média = 2,0 x 10-3 mol L-1 s-1
13ª LISTA - EXERCÍCIOS DE PROVAS – Cinética Química
Pg. 2/8
a
2 Questão
Considere os dados para a reação hipotética, a 37 °C:
A(aq) + B(aq) C(aq)
Tabela: Velocidades e concentrações iniciais da reação.
[A] (molL-1)
[B] (mol L-1)
v (mol L-1h-1)
Experimento 1
1,0
3,0
0,050
Experimento 2
2,0
3,0
0,20
[A]
[B]
tempo
tempo
Figura: Variação da concentração de cada reagente com o tempo, mantendo a
concentração do outro reagente constante.
a) Determine a ordem da reação em função da concentração de cada um dos reagentes.
Justifique.
b) Calcule a quantidade de produto C, em mol, que pode ser formado em 5,0 h em um
reator de 1,0 L, considerando que foram utilizados inicialmente 3,0 mol de A e que B está
em excesso.
c) Calcule a energia de ativação da reação sabendo que a constante de velocidade triplica
com um aumento na temperatura de 37 °C para 57 °C.
Gabarito
a) O primeiro gráfico mostra que a reação não é de ordem zero em relação ao
reagente A, devido ao fato de ser uma curva podendo ser de qualquer ordem
superior.Contudo, pela tabela vemos que fixando a [B] e dobrando a [A] a
velocidade aumenta 4 x, indicando que a reação é de ordem 2 em relação ao
reagente A. v = k’ [A]2
O segundo gráfico mostra que a reação é de ordem zero em relação ao reagente B,
pois a velocidade (tangente do gráfico, em cada instante é constante) logo não
depende de sua concentração. v = k’’ [B]°
b) 1,3 mol de C
c) Ea = 47 kJ mol-1
13ª LISTA - EXERCÍCIOS DE PROVAS – Cinética Química
Pg. 3/8
a
3 Questão
O éter dimetílico, (CH3)2O, é um composto orgânico que se decompõe a 540 oC,seguindo
uma cinética de primeira ordem, de acordo com a equação:
(CH3)2O(g) →CH4(g) + H2CO(g)
A tabela abaixo mostra a relação entre a pressão parcial do éter dimetílico e o tempo de
decomposição.
Pressão parcial do éter dimetílico, mmHg
Tempo, s
312
0
264
390
224
777
187
1195
78,5
3232
Considerando o comportamento ideal dos gases, faça o que se pede:
a) Escreva a expressão da lei de velocidade da reação.
b) Calcule o valor da constante de velocidade da reação.
c) Calcule a pressão total dos gases em 390 s, considerando os volumes e temperatura
constantes.
d) Explique se a reação é favorecida cinética e termodinamicamente com o aumento da
temperatura, sabendo que a reação é exotérmica.
Gabarito
a)
'
v k P CH
3
2 O
ou
v k [ CH
3
2 O]
b) k = 4,28 x 10-4 s-1
c) Ptotal = 360 mmHg
d) A reação é favorecida cineticamente porque aumentando a temperatura aumenta a
velocidade da reação. O aumento da temperatura provoca um aumento da fração de
colisões com energia suficiente para provocar a ocorrência da reação.
A reação é desfavorecida termodinamicamente porque aumentando a temperatura, a
constante de equilíbrio, Kp, é diminuída, isto é, no equilíbrio a reação deverá possuir uma
concentração menor dos produtos em relação ao éter dimetílico. Além disso, com o
aumento da temperatura, a constante de velocidade da reação inversa deverá aumentar
em relação a constante de velocidade da reação para a direita.
13ª LISTA - EXERCÍCIOS DE PROVAS – Cinética Química
Pg. 4/8
a
4 Questão
O urânio empobrecido é principalmente formado pelo isótopo
238
92
U.
O tempo de meia-vida
do U-238 é de 4,60 bilhões de anos, a 25 oC. O U-238 sofre decaimento, liberando uma
partícula alfa e se transformando em tório-234(Th-234), de acordo com a seguinte reação:
238
92
U
234
90
Th
4
2
α
O decaimento do U-238, a 25C, segue uma cinética de primeira ordem. Sabendo-se que a
concentração de U-238 medida, nos dias de hoje, na Terra, é de 50% da concentração
inicial em relação à criação do planeta, faça o que se pede.
a) Calcule a constante de velocidade para o decaimento do U-238.
b) Escreva a lei da velocidade da reação de decaimento do U-238 e mostre como se pode
estimar graficamente o valor da constante de velocidade.
c) Suponha que o pedaço de rocha mais antigo encontrado na Terra possuía, no tempo
zero (formação do planeta), 6,00 mg de isótopos de urânio kg -1. Entre os isótopos de
urânio, o mais abundante é o U-238, que ocorre em uma percentagem de 99,3%.Calcule a
percentagem de U-238, em relação à quantidade inicial deste isótopo, que irá existir
quando a Terra atingir 11,5 bilhões de anos, considerando que a temperatura não varie
significativamente ao longo deste período.
d) As retas A e B representadas no gráfico de Arrhenius (ln k versus 1/T) pertencem aos
isótopos de U-238 e Th-234. Sabendo-se que o tempo de meia-vida do isótopo de Th-234
é de 24,5 dias, diga qual das duas retas (A ou B) representa melhor o processo de
decaimento do U-238? Justifique sua resposta.
Gabarito
a) k = 1,51x 10-10 ano-1
b) v = 1,51 x 10
-10
x [U]
Pelo gráfico ln [A] versus t : k = - ∆y/∆x
Pelo gráfico: v versus [A]: k = ∆y/∆x
13ª LISTA - EXERCÍCIOS DE PROVAS – Cinética Química
Pg. 5/8
c) 17,6%
d) Pelo grande tempo de meia vida, a reação de desintegração do U-238 deve ter
energia de ativação muito alta. Ea muito alta é a linha que encosta no eixo dos x.
Sabe-se que a Ea é diretamente proporcional à inclinação da reta. Considerando 2
pontos consecutivos em y, observa-se que para um mesmo ∆y, o ∆x para a reta B é
muito maior do que o ∆x para a reta A, portanto a inclinação da reta B é menor e a
Ea também é menor. Portanto, a reta que representa melhor a desintegração do U238 é a reta A.
Ou
O tempo de meia vida é menor para o Th-234 do que para oU-238, portanto o k e
lnk e consequentemente a velocidade é maior para o Th-234 do que para o U-238.
Pelo gráfico, vê-se que para uma mesma temperatura, a k e consequentemente a
velocidade aumenta mais para a reta B e a k e consequentemente a velocidade
aumenta menos para a reta A que é a do U-238, cuja meia vida é maior.
13ª LISTA - EXERCÍCIOS DE PROVAS – Cinética Química
Pg. 6/8
a
5 Questão
A reação abaixo representa a decomposição de primeira ordem do pentóxido de
dinitrogênio, N2O5, dissolvido em CCl4:
N2O5(em CCl4)
N2O4(em CCl4) + ½ O2(g)
O gráfico abaixo mostra, para esta reação, a relação entre o logaritmo neperiano (também
chamado de natural) da constante de velocidade de decomposição do N 2O5, k, em s-1, com
o inverso da temperatura, 1/T, em K-1.
a) Usando as informações do gráfico determine o valor da energia de ativação da reação,
Ea, em kJ mol-1.
b) Determine a temperatura na qual o tempo de meia vida é de 2,0 horas.
c) Considerando que a reação acima apresenta uma constante de equilíbrio, K c, igual a
180, calcule o valor da constante de velocidade da reação inversa na mesma
temperatura. Considere que os coeficientes estequiométricos são iguais às ordens
individuais de reagentes e produtos nas reações inversa e direta.
d) Esboce um gráfico relacionando a velocidade da reação de decomposição do N2O5 em
função da sua concentração.
Gabarito
a) Ea 112 kJ mol-1; b) T = 307 K; c) k = 5,4 x 10-7 s-1
v
d)
[N2O5]
13ª LISTA - EXERCÍCIOS DE PROVAS – Cinética Química
Pg. 7/8
a
6 Questão
O íon benzenodiamônio, C6H5N2+(aq), reage com a água, de acordo com a reação a
seguir:
C6H5N2+(aq) + H2O(l) C6H5OH(aq) + N2(g) + H+(aq)
Nas condições da reação a água se encontra em grande excesso, conseqüentemente a
velocidade da reação só depende da variação da concentração molar do C 6H5N2+(aq). A
constante de velocidade da reação, em s-1, varia conforme mostrado no gráfico ln k versus
1/T abaixo.
a) Escreva a lei de velocidade para a reação a 301 K, incluindo o valor numérico da
constante de velocidade.
b) Calcule a concentração molar de C6H5N2+(aq) e de C6H5OH(aq) após 120 s de reação, a
301 K, considerando que a concentração inicial de C 6H5N2+(aq) é de 1,00 x 10-2 mol L-1.
c) Calcule o tempo de meia vida do C6H5N2+(aq) na reação, a 301 K.
d) Calcule a energia de ativação da reação.
Gabarito
a) v = 0,01526 [C6H5N2+]
b) [C6H5N2+] = 1,6 x 10-3 mol L-1 e [C6H5OH] = 8,4 x 10-3 mol L-1
c) t ½ = 45,42 s
d) Ea = 1,393 x 103 J mol-1 ou 1,393 kJ mol -1
13ª LISTA - EXERCÍCIOS DE PROVAS – Cinética Química
Pg. 8/8
7a. Questão
a) A taxa de decomposição do acetaldeído, CH 3CHO, foi medida na faixa de temperatura
de 700 a 1000 K. As constantes de velocidade encontradas estão tabeladas abaixo.
T (K)
k
(L mol-1 s-1)
700
730
760
790
810
840
910
1000
0,011
0,035
0,105
0,343
0,789
2,17
20,0
145
a.1) Qual a ordem da reação de decomposição do acetaldeído. Justifique sua resposta.
a.2) Determine a energia de ativação.
b) Segundo a teoria das colisões, a colisão entre moléculas é um dos fatores necessários
para que ocorra uma reação química. Como explicar então, segundo essa mesma teoria,
que no ar há cerca de um bilhão de colisões por segundo entre as moléculas do gás
oxigênio e do gás metano e não ocorre reação? (na explicação cite dois fatores
determinantes para a colisão ser efetiva, ou seja, para que ocorra a reação).
Gabarito:
a1) A reação de decomposição do acetaldeído é de segunda ordem. Esta informação pode
ser obtida pela unidade da constante cinética, k, uma vez que para segunda ordem:
v k [A]
Δ[ ]
ΔT
2
2
k[ ]
mol
Ls
k
mol
L
2
2
k
L
mol s
a2) 2 x 102 kJ mol-1
b) Na teoria da colisão os produtos só se formam se a colisão envolver energia suficiente,
ou seja, a colisão só será bem sucedida se a energia cinética for maior que um certo valor
mínimo, a energia de ativação, Ea, da reação. Porém, nem toda colisão provocará a
reação mesmo que as exigências de energia sejam satisfeitas. Os reagentes devem
também colidir numa orientação apropriada, é o que se pode chamar de “fator de
orientação”. Assim, além da colisão entre as partículas, dois outros fatores para a
ocorrência de uma reação química são energia suficiente e orientação adequada.












