Faculdade UnB – Planaltina
Licenciatura em Ciências Naturais
Energia e Dinâmica das Transformações Químicas – Prova 3
Professor: Alex Fabiano Cortez Campos, Dr.
Prova Escrita
10,0
Aluno:
Matrícula:
Questão 1
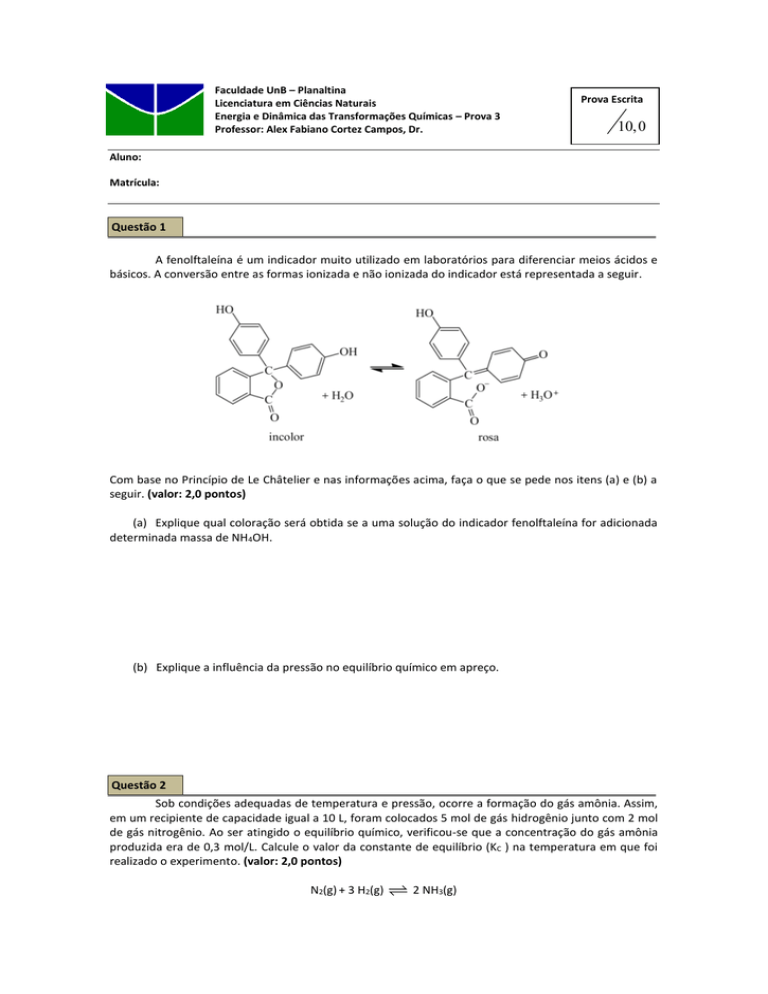
A fenolftaleína é um indicador muito utilizado em laboratórios para diferenciar meios ácidos e
básicos. A conversão entre as formas ionizada e não ionizada do indicador está representada a seguir.
Com base no Princípio de Le Châtelier e nas informações acima, faça o que se pede nos itens (a) e (b) a
seguir. (valor: 2,0 pontos)
(a) Explique qual coloração será obtida se a uma solução do indicador fenolftaleína for adicionada
determinada massa de NH4OH.
(b) Explique a influência da pressão no equilíbrio químico em apreço.
Questão 2
Sob condições adequadas de temperatura e pressão, ocorre a formação do gás amônia. Assim,
em um recipiente de capacidade igual a 10 L, foram colocados 5 mol de gás hidrogênio junto com 2 mol
de gás nitrogênio. Ao ser atingido o equilíbrio químico, verificou-se que a concentração do gás amônia
produzida era de 0,3 mol/L. Calcule o valor da constante de equilíbrio (KC ) na temperatura em que foi
realizado o experimento. (valor: 2,0 pontos)
N2(g) + 3 H2(g)
2 NH3(g)
Questão 3
A reação de íons de ferro III com íons tiocianato pode ser representada pela equação:
13+
Fe(aq)
+ SCN(aq)
2+
FeSCN(aq)
Nesta reação a concentração dos íons varia segundo o gráfico abaixo sendo a curva I correspondente ao
íon Fe3+(aq).
.
a)
A partir de que instante, aproximadamente, podemos afirmar que o sistema entrou em equilíbrio?
Explique. (valor: 0,5 ponto)
b) Calcule o valor aproximado da constante de equilíbrio para a reação de formação de FeSCN2+(aq).
(valor: 1,0 ponto)
Questão 4
O dióxido de carbono representa, em média, 0,037% da composição volumétrica do ar seco
atmosférico, nas condições ambientes. Esse gás, dissolvido em água, sofre um processo de hidratação
para formar um ácido diprótico, que se ioniza parcialmente no líquido, de acordo com a equação abaixo.
CO2(g) + H2O(l)
H3O+(aq) + HCO3-(aq)
A solubilidade do dióxido de carbono e o valor da constante do equilíbrio acima, nas condições
ambientes, são iguais a 1,26 x 10-5 mol/L e 4,4 x 10-7.
Com base nas informações, calcule a concentração do íon bicarbonato (HCO3-), em mol/L,
quando o equilíbrio em apreço for atingido. (valor: 1,0 ponto)
Questão 5
A figura apresenta a variação de rapidez em função do tempo para a reação química hipotética não
catalisada (reações direta e inversa). Reproduza nesta mesma figura as curvas dessas mesmas reações
direta e inversa catalisadas. (valor: 1,0 ponto)
Rapidez
Tempo
Questão 6
A dependência com a temperatura para a constante KC do equilíbrio
Ag2CO3(s) ⇌ Ag2O(s) + CO2(g)
pode ser expressa como:
9, 6 103
ln K C 0, 2
T
,
em que T é a temperatura absoluta.
a)
A reação direta do equilíbrio anterior é exotérmica ou endotérmica? Justifique. (valor:
0,5 ponto)
b) Calcule o valor de KC quando o equilíbrio é estabelecido a 527 °C. Quais espécies predominam
no equilíbrio nesta temperatura? (valor: 1,0 ponto)
Questão 7
As Diretrizes Curriculares Nacionais para o Ensino Médio e as Orientações Curriculares
Nacionais enfatizam a utilização da contextualização e da possibilidade da interdisciplinaridade, sem que
haja uma linearidade, tão comum nos currículos escolares. Nesse contexto, apresente dois exemplos de
abordagem do conceito de equilíbrio químico: um, de forma contextualizada e outro, de forma
interdisciplinar. (valor: 1,0 ponto)












