QFL-5922
Espectrometria de Massa
Luiz Henrique Catalani
Data Tópicos 30/03
Espectrometria de massas – Técnicas básicas
06/04
Espectrometria de massas – Teoria de fragmentação
13/04
Espectrometria de massas – Teoria de fragmentação
20/04
Resolução de problemas
27/04
1ª Prova
04/05
Seminários
Períodicos especializados em
espectrometria de massas:
1. International Journal of Mass Spectrometry
2. International Journal of Mass Spectrometry and Ion Processes
3. Journal of Chromatography. A, Including Electrophoresis, Mass
Spectrometry and other Separation and Detection Methods
4. Journal of Mass Spectrometry
5. Journal of the American Society for Mass Spectrometry
6. Mass Spectrometry for Biotechnology
7. Mass Spectrometry Reviews
8. Rapid Communications in Mass Spectrometry
Histórico
1897: J.J. Thompson descobre elétron e determina m/z
1912: J.J. Thompson constrói o primeiro espectrômetro de massas
1942: Demster desenvolve a fonte de impacto de elétrons
1942: Primeiro instrumento comercial para análise orgânica
1953: Quadrupolo e ion trap (W. Paul e H.S. Steinwedel, Nobel 1989)
1956: Primeiro GC-MS
1974: Primeiro HPLC-MS
1987: Demonstração de MALDI
1988: Demonstração de ESI
1990s: Crescimento explosivo de MS, devido a ESI e MALDI
2002: Nobel para inventores ESI (Fenn e Tanaka)
Informações Obtidas da
Espectrometria de Massa
A massa molecular
A fórmula molecular
A massa de fragmentos
Detalhes estruturais do
composto
Espectrometria de Massas
Técnica analítica para:
identificação de compostos desconhecidos
quantificação de compostos conhecidos.
Sensibilidade: Substâncias podem ser detectadas com
quantidades mínimas de amostra (10-12 g, 10-15 moles pra
um composto de massa 1000 Daltons.
Seletividade: Substâncias podem ser identificadas e
quantificadas em concentrações muito baixas (uma parte
em 1012) em misturas complexas.
Definição IUPAC
Espectrometria de Massas:
Estudo de sistemas pela formação de íons em fase gasosa, com ou sem
fragmentação, que são caracterizados por suas relações massa carga e
abundâncias relativas
Em que consiste EM
Ionização
Fonte
Separação dos íons
Detecção dos íons
Analisador
Detector
Sistema de
dados
Manipulação
dos dados
Entrada
100
Saída dos
dados
Ion Abundance (%)
Introdução
da amostra
80
60
40
20
0
0
50
100
150
200
250
m/z
Espectro de massas
Espectro de massas
Ion abundance (%)
Pico base (ion 100%)
Íons fragmentários Pico do íon molecular
100
(Precursor)
80
60
Isótopos
40
20
m/z
Reações de produção de íons em EM
Protonação
Remoção de elétrons
– eM
M+•
Captura de elétrons
M
+ e-
M– •
M + H+
[MH]+
Cationização
M + Na+
[MNa]+
Desprotonação
MH
– H+
M–
Necessidade de vácuo
Passo livre médio
percorrido por uma
molécula entre colisões
L (em cm) =
Sugere pressões da ordem de 10-5 torr para mover
uma molécula um metro sem colisão
4,95
p (em mTorr)
Espectrômetro de massas
Sistema de dados
Alto vácuo 10-5-10-8 mbar
Sistema
de
inserção
HPLC
GC
Bomba
seringa
Fonte de íons
ESI*
APCI*
MALDI
EI
CI
*Fonte de íons a pressão atmosférica
Analisador
Quadrupolo
TOF
Ion trap
FT-ICR
Setor Magnético
Detector
Fotomultiplicador
Multiplicador de elétrons
Microchannel Plate
Métodos de produção de íons em EM
Métodos de produção de íons em EM
• EI (electron impact)
• CI (chemical ionization)
• FAB (fast atom bombardment)
• MALDI (matrix-assisted laser desorption/ionization)
• API (atmospheric pressure ionization)
• ESI (electrospray ionization)
• APCI (atmospheric pressure chemical ionization)
• ICP (inductively-coupled plasma)
• TIS (thermal ionization source)
Como ocorre a ionização por EI?
Fonte de Impacto Eletrônico (EI)
A-B-C
70 eV e-
Elétrons de
baixa energia
<70 eV e-
A-B-C+.
cátion radicalar
A+ + B-C.
A. + B-C+
B + C+
B+ + C
A-B . + C+
A-B+ + C .
A + B+
A+ + B
Vantagens e desvantagens de EI
Vantagens
• Método robusto e simples
• Fragmentação fornece informações estruturais;
• Espectros são facilmente reprodutíveis;
• Existência de biblioteca de “impressões digitais”;
Limitações
• Requer volatilização da amostra ou derivatização;
• Para substâncias de massa molar <800 uma
• Amostra deve ser termicamente estável;
• Íon molecular pode ser de difícil identificação;
• Fragmentação pode ser extensa (moléculas maiores).
Ionização química - CI
Como ocorre a ionização química?
• Modificação de EI
• Resulta em pouca ou nenhuma fragmentação
• Gás e amostra entram junto
• Amostra é tipicamente 1% da mistura
• Maior pressão do gás gera ionização preferencial
• Espécie iônica gerada transfere carga para o analito
Mecanismos de ionização química
Troca de carga (hélio como reagente)
He+ + M → He + M+
Reações ácido-base
Com metano: CH5+ + M → CH4 + M+ (P elevadas)
Com água: OH- + MH → H2O + MAdição de grupo alquila
C2H5+ + M → MC2H5+
Como ocorre a ionização química?
A fonte CI é uma fonte EI modificada
O gás reagente pode ser:
• Introduzido diretamente na fonte
• Misturado com a amostra antes de
entrar na fonte.
• Requer colisão, logo, as pressões são
mais altas
L = 4,95
p
0,01 cm = 4,95
p = 495 mTorr
p
Vantagens e desvantagens de CI
Vantagens
• Determinação do peso molecular (íon molecular)
• Baixa fragmentação
Limitações
• Vários parâmetros (gás, reagente e pressão relativa) dificultam a
reprodutibilidade
• Ausência de espectros de referência
• Perda de informações estruturais devido à baixa fragmentação
Bombardeamento rápido de átomos (FAB)
• Técnica rápida e simples para análise de compostos de 300 a
6000 Da;
• Amostra é dissolvida numa matriz líquida, viscosa e com baixa
pressão de vapor (glicerol ou álcool 3-nitrobenzílico);
• Matriz é bombardeada com feixe de átomos (xenônio ou
argônio) ou íons (césio) de alta energia cinética;
• Moléculas são removidas da superfície da matriz, entram na
fase gasosa e se ionizam por protonação ou desprotonação;
• Íon resultante é estável e fragmenta pouco.
Como ocorre a ionização por FAB?
Vantagens e desvantagens de FAB
Vantagens
• Rapidez e simplicidade
• Tolerante às variações na amostra
• Corrente intensa de íons (bom para altas resoluções)
Limitações
• Requer que o analito seja solúvel na matriz líquida
• Requer pureza e boa quantidade de amostra
• Não é adequado para compostos com mais de duas cargas
EM via FAB de
5 peptídeos
íons (M+H)+;
Seqüenciamento
do m/z 872
Dessorção/ionização a LASER
assistida por matriz - MALDI
• Preparação de amostra: analito dissolvido junto com uma
substancia orgânica, “matriz”, que possui absorção intensa
no λ do laser (λ = 337 nm para laser de N2);
• Dessorção da solução sólida por um laser pulsado (ns) de
alta intensidade;
• Matrizes típicas: ácido 2,5-dihidroxibenzóico; ácido 3,5dimetóxi-4-hidroxicinâmico; ácido 5-clorosalicílico;
• Espectro resultante inclui íons (M+H)+, e outros com prótons
adicionais, retirados da matriz.
• Deve ser usado com analisadores compatíveis com métodos
pulsados (TOF ou FT-ICR)
MALDI
Matrizes típicas
Utilizadas em MALDI
Placa de amostras para MALDI
100 poços padrão
Vantagens e desvantagens de MALDI
Vantagens
• Baixa concentração do analito
• Velocidade
• Análise de polímeros e macromoléculas polares e nãopolares (M>50.000)
Limitações
• Não compatível com LC/MS
• Difícil obtenção de espectros de MS/MS
• Deve ser usado com analisadores compatíveis com métodos
pulsados (TOF ou FT-ICR)
EM via MALDI de um
anticorpo monoclonal
EM via MALDI de
poli(metil metacrilato)
Mw = 7100 Da
MW mero = 100
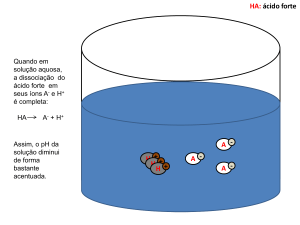
Ionização por electrospray - ESI
• Substância dissolvida numa mistura, p.ex. agua-metanol, é
injetada diretamente, ou por HPLC, ou por eletroforese capilar.
• Íons são formados a partir das gotas a pressão atmosférica e
formam um jato por expansão livre. O mecanismo exato ainda é
objeto de especulações. Amostragem ocorre através de um
“skimmer”, e introduzidos no alto vácuo do espectrômetro.
• Íons com número elevado de cargas.
• Íons com carga múltipla podem ser detectados mesmos com
instrumentos menos sofisticados.
• O número de cargas pode depender do pH, da presença de sais,
desnaturação da proteína, quebra de ligações S-S, etc.
Ionização por electrospray
Vantagens e desvantagens de ESI
Vantagens
• Amostras não-voláteis
• Ionização “branda” a pressão atmosférica
• Análise de compostos de elevado peso molecular
• Acoplamento com HPLC e eletroforese capilar
Limitações
• Espécies multiplamente carregadas exigem transformações matemáticas
para interpretação do espectro
• Complementar à APCI. Não é boa para compostos não carregados, não
básicos e de baixa polaridade, como esteróides
• Muito sensível a contaminantes, tais como metais alcalinos ou compostos
básicos
• Corrente de íons relativamente baixa
EM da lisozima: MW calculado = 17828 ± 2.0 Da
Mioglobina de cavalo
MW = 16.951,5 Da
A. Íons de carga +12 a +24 em
baixa resolução
B. Ampliação do +17
mostrando picos isotópicos
(resolução 15.000)
Determinação do número de cargas e de M em
espectros contendo íons com cargas múltiplas
a) Em espectros electrospray, a massa de um íon m1 com carga z1 pode ser
equacionada com a massa da molécula (M) e da massa do próton (mp)
m1 z1 = M + m p z1
M = z1 (m1 − m p )
(1)
b) Escolhendo outro pico no espectro, separado por (j-1) picos em ordem crescente
de m/z, podemos equacionar a massa m2 como
m2 ( z1 − j ) = M + m p ( z1 − j )
(2)
c) Da combinação de (1) e (2):
z1 =
j (m2 − m p )
(m 2 −m1 )
(3)
Ionização química a pressão atmosférica (APCI)
Ionização similar à electrospray, com exceção de que:
• Ocorre em uma coroa de descarga e não no capilar
• Capilar encontra-se aquecido e não está submetido à alta
voltagem
• As moléculas de solvente são ionizadas primeiramente
.
NATUREZA DA AMOSTRA MÉTODO DE IONIZAÇÃO EXEMPLO Amostras gasosas, voláteis e
termicamente estáveis Moléculas pequenas (< 1000 u),
puras e suficientemente estáveis e
voláteis para serem dessorvidas de
uma sonda Moléculas pequenas (< 1500 u) que
não são voláteis ou termicamente
estáveis. Devem ter um grau de
afinidade de próton Moléculas como as acima, mas que
podem ser derivatizadas para dar
produtos voláteis e estáveis Peptídeos, proteínas e
oligonucleotídeos Proteínas, peptídeos e misturas do
mesmos Interações não-covalentes
EI, CI CO2, NO, solventes,PAH, dioxinas EI, CI
(Em EI o pico do íon molecular pode
não aparecer) Muitas moléculas orgânicas FAB (se pura),
ESI ou APCI (infusão ou via HPLC,
se necessário). Aminoácidos, carboidratos, lipídios Análise elementar
EI ou CI usando CG/MS. Ácidos como ésteres, álcoois como
silil-éteres ESI (via bomba de infusão ou
acoplada com micro-CLAE). MALDI Proteínas intactas. ESI (nanoflluxo) com MS-MS.
Interações droga-droga ou drogaproteína
Solo
ICP ou TIS
PPG, PEG Métodos de análise de íons em EM
Métodos de análise de íons em EM
• Deflexão elétrica
• Deflexão magnética
• Quadrupolo
• Tempo de vôo – TOF (time of flight)
• Aprisionamento de íons – IT (Ion trap)
• Ressonância ciclotrônica de íons – FT-ICR (Fourriertransform ion cyclotron resonance)
Deflexão magnética
Deflexão magnética
Deflexão elétrica
Deflexão elétrica
Foco duplo – alta resolução
Modelo Nier-Johnson - E constante H variável
Quadrupolo
Quadrupolo
+
-
+
-
-++
M
2V
= 2 2
z
Dυ
D
Para um determinado V, D e ν só existe um M/z que tem
uma oscilação estável através do quadrupolo sem chocarse com os polos.
TOF (tempo de vôo)
TOF (tempo de vôo)
TOF tipo Reflectron
TOF (tempo de vôo)
TOF = t0 + ta + tD + td
Onde:
t0 = tempo de formação do íon
ta = tempo de aceleração
tD = tempo de percurso
td = tempo de resposta do detector
Aprisionamento de íons (Ion trap)
Aprisionamento de íons (Ion trap)
• Íons são presos através da ação de três eletrodos (2 end-cap e um anel)
• Voltagens aplicadas geram uma cavidade onde os íons oscilam em uma
trajetória estável
• A trajetória exata dos íons é dependente das voltagens aplicadas e da razão
m/z
• A alteração dos potenciais destabiliza a trajetória resultando em sua ejeção
através do endcap de saída, em ordem crescente de m/z
• É possível isolar um valor particular de m/z e, assim, permitir experimentos
CID (collision induced dissociation), para análise de íons-filho e MSn
Ressonância ciclotrônica de íons
FT-ICR (Fourrier-transform ion cyclotron resonance)
Ressonância ciclotrônica de íons
• Íons se movem em um movimento circular em um campo magnético
• A freqüência ciclotrônica do movimento circular é dependente da massa
• Sob excitação externa de mesma freqüência (ressonante), a orbita aumenta
e, quando se aproxima do receiver plate, induz uma corrente imagem que é
amplificada e digitalizada
• Um unico pulso contendo todas as freqüências gera uma corrente-imagem
contendo informações sobre todos os íons de diferentes massas (diferentes
freqüências)
• Transformada de Fourrier do sinal da corrente-imagem gera espectro de
massa
Ressonância ciclotrônica de íons
Ressonância ciclotrônica de íons
• Técnica de grande resolução (maior entre TOF, IT e anteriores)
• Adequado para técnicas pulsadas como MALDI
• Magneto supercondutor provém calibração estável
• Faixa dinâmica de trabalho é baixa
• Apresenta artefatos como harmonicas e bandas laterais
Orbitrap
- Similar ao FT-ICR
- Maior resolução (~200.000)
- Maior faixa dinâmica de trabalho
(~5000 Da)
Análise em série – Tandem MS
Análise em série – Tandem MS
• Combina dois ou mais analisadores diferentes ou do mesmo tipo
• O primeiro analisador isola o íon de interesse (íon parente)
• Íons são fragmentados entre o primeiro e segundo analisador através
de colisões ou irradiação
• O último analisador obtém o MS dos fragmentos (íons filho)
Detectores
Detectores - Fotomultiplicadoras
Detectores – Multiplicadora de dinôdo
contínuo
Detectores – Microchannel plate
12,5 µm de diâmetro
Fim