UNIVERSIDADE FEDERAL FLUMINENSE
CENTRO DE CIÊNCIAS MÉDICAS
FACULDADE DE VETERINÁRIA
PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
LYA MADUREIRA SEPÚLVEDA
Reação em Cadeia da Polimerase após Transcrição Reversa
(RT - PCR) na detecção e diferenciação do vírus da Estomatite
Vesicular
NITERÓI
2005
LYA MADUREIRA SEPÚLVEDA
Reação em Cadeia da Polimerase após Transcrição Reversa
(RT - PCR) na detecção e diferenciação do vírus da Estomatite
Vesicular
Dissertação apresentada ao Curso de PósGraduação em Ciências Veterinárias da
Universidade Federal Fluminense, como
requisito parcial para obtenção do Grau de
Mestre. Área de concentração: Medicina
Veterinária Coletiva.
Orientador: Prof. Dr. ELMIRO ROSENDO DO NASCIMENTO
Co-Orientador: Drª VIVIANA MALIRAT
Niterói
2005
A meus pais Leleu e Ercy: minha base
A meu marido Noir: minha estrutura
A meus filhos Iago e Igor: minha vida (alegria – razão de viver)
AGRADECIMENTOS
Ao Dr. Eduardo Corrêa, diretor do Centro Pan-Americano de Febre Aftosa, por ter
me proporcionado a oportunidade de atualização e aperfeiçoamento com a
realização do mestrado.
A Dra. Ingrid Bergmann, coordenadora do Laboratório de PANAFTOSA, pelo
incentivo para a realização do mestrado.
A Dra. Viviana Malirat pela orientação, apoio e estímulo na elaboração desse
trabalho.
Ao Prof. Dr. Elmiro Rosendo do Nascimento pela confiança ao me acolher como
orientada me proporcionando excelentes oportunidades de aprendizado.
Ao Servicio Ecuatoriano de Sanidad Agropecuária (SESA) através do Dr. Aníbal
Mantilla pelo provimento dos isolados do Equador e por disponibilizar os resultados
dos testes de Fixação de Complemento realizados nesse laboratório.
A todos os meus amigos do Laboratório. Aos mais novos e principalmente aos
antigos que fazem parte de toda a minha trajetória profissional e que sempre me
acolheram em todas as mudanças que passamos juntos. Especial agradecimento a
minha grande amiga Maria da Penha, meu companheiro de todas as “barras”
Antonidio, ao meu consultor para assuntos diversos Maurício, a Rossana e Pedro
Jeovah que me iniciaram no fascinante mundo da Biologia Molecular e ao Jorge
López pela presteza em me auxiliar nos obstáculos que inevitavelmente apareceram.
Aos meus pais e minha tia Celi, presenças marcantes e constantes durante toda
minha vida; pelo apoio em qualquer hora, lugar, situação e necessidade. Pelo
carinho e dedicação aos meus filhos quando por muitas vezes tive que faltar para
me dedicar a esse trabalho.
Ao meu marido Noir por ser tudo. O seu amor incondicional me deu a força
necessária para correr atrás do meu sonho, força para estudar de madrugada,
confiança de que seria capaz de conseguir. Por ser um excelente pai e entreter as
crianças para que eu pudesse estudar e pela compreensão e paciência durantes os
meus momentos de tensão.
Aos meus filhos Iago e Igor por “recarregarem” minhas pilhas.
Aos meus irmãos e toda a minha maravilhosa família pelo infinito carinho.
Aos meus amigos que me orgulho de serem muitos. Mesmo sem saberem são
peças fundamentas no processo de construção da história de minha vida.
A Astrid Pimentel pelo auxílio com as referências bibliográficas e todos os
funcionários de PANAFTOSA que me ajudaram de alguma forma na realização
desse trabalho.
SUMÁRIO
LISTA DE QUADROS, p. 8
LISTA DE TABELAS, p. 9
LISTA DE FIGURAS, p. 10
LISTA DE ABREVIATURAS E SIGLAS, p. 12
RESUMO, p. 14
ABSTRACT, p. 15
1 INTRODUÇÃO, p. 16
2 REVISÃO DE LITERATURA, p. 19
2.1 ESTOMATITE VESICULAR, p. 19
2.1.1 O Vírus da Estomatite Vesicular, p. 20
2.1.2 Estrutura e composição do Vírus da Estomatite Vesicular, p. 20
2.1.3 Ciclo de replicação do Vírus da Estomatite Vesicular, p. 23
2.1.4 Partículas defectivas, p. 24
2.2 HISTÓRICO E DISTRIBUIÇÃO GEOGRÁFICA DA ESTOMATITE VESICULAR, p. 25
2.2.1 Aspectos epidemiológicos, p. 27
2.3 DIAGNÓSTICO, p. 29
3 MATERIAL E MÉTODOS, p. 32
3.1 INFRA-ESTRUTURA, p. 32
3.2 AMOSTRAS DE REFERÊNCIA, p. 32
3.3 ESPÉCIMES CLÍNICOS, p. 33
3.4 “PRIMERS” , p. 34
3.5 EXTRAÇÃO DE RNA, p. 35
3.6 TRASCRIÇÃO REVERSA (RT) , p. 36
3.7 REAÇÃO EM CADEIA DA POLIMERASE – PCR, p. 36
3.8 ELETROFORESE EM GEL DE AGAROSE, p. 37
3.9 PURIFICAÇÃO DOS PRODUTOS DA PCR, p. 37
3.10 QUANTIFICAÇÃO DO DNA, p. 38
3.11 SEQUENCIAMENTO CÍCLICO, p. 39
3.12 PURIFICAÇÃO DO PRODUTO DA REAÇÃO DE SEQÜENCIAMENTO, p. 39
3.13 LEITURA E ANÁLISE DE SEQÜÊNCIAS, p. 39
3.14 ANÁLISE FILOGENÉTICA, p. 40
3.15 DESENHO EXPERIMENTAL, p. 40
3.15.1 Estudos preliminares, p. 40
3.15.1.1 Estudos preliminares de detecção por RT – PCR de amostras de referência,
p. 40
3.15.1.2 Estudos preliminares de detecção por RT – PCR de amostras de campo, p.
41
3.15.2 Ajuste de prova, p. 41
3.15.3 Estudo de detecção de amplificação de subtipos do VEV, p. 43
3.16 SENSIBILIDADE ANALÍTICA, p. 43
4 RESULTADOS, p. 44
4.1 ESTUDOS PRELIMINARES, p. 44
4.1.1 Estudos preliminares de detecção por RT – PCR de amostras de
referência (tabela 1 e figuras 5 e 6), p. 44
4.1.2 Estudos preliminares de detecção por RT – PCR de amostras de campo,
p. 47
4.2 AJUSTE DE PROVA, p. 49
4.3 ESTUDO DE DETECÇÃO DE AMPLIFICAÇÃO DE SUBTIPOS DO VEV, p. 52
4.4 SENSIBILIDADE ANALÍTICA, p. 53
4.5 SEQÜENCIAMENTO, p.54
5 DISCUSSÃO, p. 68
6 CONCLUSÃO, p. 72
7 OBRAS CITADAS, p. 73
8 OBRAS CONSULTADAS, p. 79
LISTA DE QUADROS
QUADRO 1: Amostras de Referência da coleção da PANAFTOSA utilizados para a
implementação do RT – PCR para o diagnóstico da EV, p. 33
QUADRO 2: Espécimes clínicos provenientes do Equador utilizados para a
implementação do RT – PCR para o diagnóstico da EV, p. 34
QUADRO 3: “Primers” a serem testados na implementação da RT - PCR para a
detecção do vírus da Estomatite Vesicular, p. 35
QUADRO 4: Modificações propostas na temperatura de anelamento e quantidade de
ciclos, na tentativa de ajuste de prova utilizando-se “primers” que reconhecem o
gene L do VEV: NS / NA e IS / IA, p. 42
QUADRO 5: Seqüências do GenBank utilizadas para alinhamento e o cálculo e
análise das distâncias genéticas em comparação com as seqüências obtidas nesse
trabalho, p. 55
LISTA DE TABELAS
TABELA 1: Resultados dos estudos preliminares de detecção por RT – PCR em
amostras de referência para os sorotipos NJ e Ind, p. 45
TABELA 2: Resultado dos estudos de amplificação por RT – PCR dos isolados do
Equador e amostras de referência utilizando-se “primers” que flanqueiam diferentes
genes do genoma do VEV nas condições de prova recomendadas por seus autores,
em comparação com os resultados obtidos por FC50 , p. 48
TABELA 3: Resultados de RT – PCR observados no ajuste de prova proposto para
os “primers” NS / NA e IS / IA que flanqueiam o gene L do VEV, p. 50
TABELA 4: Resultados observados no teste de RT – PCR para as amostras de
referência e controles utilizando-se “primers” NJ 102 / 744 e Ind 179 / 793, p. 52
TABELA 5: Cálculo das distâncias genéticas entre as seqüências parciais do gene P
do VEV obtidas nesse trabalho e as publicadas no GeneBank utilizando-se o
programa MEGA versão 3.0, p. 66
LISTA DE FIGURAS
FIGURA 1: VEV purificado de cultivo de célula infectada. Coloração negativa do
virion
onde
se
percebe
claramente
a
forma
de
um
projétil.
Ampliado
aproximadamente x 40,000, p. 21
FIGURA 2: Esquema do genoma do VEV. Os números entre parênteses
representam os nucleotídeos não codificados, p. 21
FIGURA 3: Esquema da estrutura do vírus da Estomatite Vesicular indicando a
localização das principais proteínas virais e a composição do RNA viral: 3’ N-P-M-GL 5’, p. 23
FIGURA 4: Distribuição geográfica e epidemiológica do Vírus da Estomatite
Vesicular, p. 27
FIGURA 5: Gel de agarose dos produtos obtidos por RT – PCR das amostras de
referência NJ CR /66 (colunas 1 e 7), Ind CR /72 (colunas 2 e 8), Ind 2 Rib BR /79
(colunas 3 e 9), Ind 3 A N BR /86 (colunas 4 e 10), controle negativo (colunas 5 e 11)
e controle do Kit (colunas 6 e 12) utilizando-se os “primers” para o gene P. Colunas 1
a 6: “primers” NJ 102 / 744; colunas 7 a 12: “primers” Ind 179 / 793, p 46
FIGURA 6: Gel de agarose dos produtos obtidos por RT – PCR das amostras de
referência NJ CR /66 (colunas 1 e 7), Ind CR /72 (colunas 2 e 8), Ind 2 Rib BR /79
(colunas 3 e 9), Ind 3 A N BR /86 (colunas 4 e 10), controle negativo (colunas 5 e 11)
e controle do Kit (colunas 6 e 12) utilizando-se os “primers” para o gene L. Colunas 1
a 6: “primers” NJ NS / NA; colunas 7 a 12: “primers” Ind IS / IA, p 46
FIGURA 7: Gel de agarose dos produtos obtidos por RT – PCR dos isolados do
Equador e amostra de referência, p. 49
FIGURA 8: Gel de agarose dos produtos obtidos por RT – PCR para detecção do
VEV do isolado do Equador 029-6 no ajuste de prova proposto, p. 51
FIGURA 9: Diluição seriada do RNA extraído de células BHK – 21 infectada com
VEV NJ CR /66, p. 53
FIGURA 10: Diluição seriada do RNA extraído de células BHK – 21 infectada com
VEV Ind CR /72, p. 54
FIGURA 11: Alinhamento entre as seqüências parciais do gene P do VEV obtidas
nesse trabalho utilizando-se os “primers” 102 / 744 para NJ com seqüências
publicadas no GeneBank (programa de editoração BioEdit 5.0.6), p. 57
FIGURA 12: FIGURA 12: Alinhamento entre as seqüências parciais do gene P do
VEV obtidas nesse trabalho utilizando-se os “primers” 179 / 793 para Ind com
seqüências publicadas no GeneBank (programa de editoração BioEdit 5.0.6), p. 61
FIGURA 13: Árvore filogenética (Neighbor-joining) baseado na seqüência parcial do
gene P do VEV NJ e Ind. Vírus com seqüência total do gene P em destaque.A
árvore foi obtida através do programa Mega 2.01, p. 67
LISTA DE ABREVIATURAS E SIGLAS
A24 Cruz BR /55
A 24 Cruzeiro Brasil / 55
BHK-21
Baby Hamster Kidney
cDNA
Cadeia complementar de DNA
DNA
Ácido Desoxirribonucléico
dNTP
Deoxinucleotídeo Trifosfato
DTT
Dithiotreitol
EDTA
Ácido Etileno Diamino Tetracético
ELISA
Enzyme-linked Immunosorbent Assay
EV
Estomatite Vesicular
FA
Febre Aftosa
FC50
Fixação de complemento 50%
G
Glicoproteína
HCl
Ácido Clorídrico
ICTVdb
International Committee on Taxonomy of Viruses
Ind
Indiana
Ind 1 CR /72
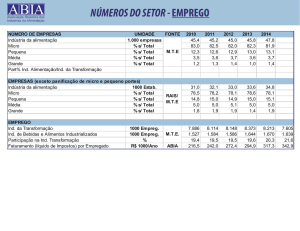
Indiana 1 Costa Rica / 72
Ind 1 CR /79
Indiana 1 Costa Rica / 79
Ind 1 ES /71
Indiana 1 El Salvador / 71
Ind 1 ES /78
Indiana 1 El Salvador / 78
Ind 2 Ranc BR /66 Indiana 2 Rancharia Brasil / 66
Ind 2 Rib BR /79
Indiana 2 Ribeirão Brasil / 79
Ind 3 A N BR /86
Indiana 3 Agulhas Negras Brasil / 86
Ind 3 Esp BR /77
Indiana 3 Espinosa Brasil / 77
KCl
Cloreto de Potássio
L
Polimerase
M
Proteína Matriz
MgCl
Cloreto de Magnésio
N
Nucleoproteína
Nc
Não consistente
Neg
Negativo
NJ
New Jersey
NJ CR /66
New Jersey Costa Rica / 66
NJ Eq /85
New Jersey Equador / 85
OIE
Organização Mundial de Saúde Animal
OPS
Organização Pan-Americana da Saúde
OMS
Organização Mundial da Saúde
O1 Cps BR /58
O1 Campos Brasil / 58
P
Fosfoproteína
PANAFTOSA
Centro Pan-Americano de Febre Aftosa
pb
Pares de bases
PCR
Reação em Cadeia da Polimerase
Pos
Positivo
RNA
Ácido Ribonucléico
RNAm
RNA mensageiro
RT – PCR
Reação em Cadeia da Polimerase após Transcrição Reversa
TA
Temperatura Ambiente
Taq
Thermus aquaticus
TBE Tampão
Tris-Borato-EDTA
TCID50
Dose infectante em cultivo de célula 50%
TE Tampão
Tris-EDTA
Tris
Tris (hidroximetil) aminometano
U
Unidade
VEV
Vírus da Estomatite Vesicular
RESUMO
A Estomatite Vesicular (EV) é uma enfermidade causada por um vírus da família
Rhabdoviridae, gênero Vesiculovirus. O animal acometido por essa enfermidade
apresenta queda na produção de leite e carne sendo sua presença um fator limitante
para o comércio internacional de animais. Além do prejuízo na produtividade do
rebanho, assume um importante papel nos programas de saúde animal por ser
indistinguível clinicamente da Febre Aftosa. As técnicas empregadas para o
diagnóstico da EV são, principalmente, a Fixação de complemento 50% (FC50),
ELISA (Enzyme-linked immunosorbent assay) e Virusneutralização que permitem
não somente a detecção viral, mas também a diferenciação dos dois sorotipos
descritos para o vírus da Estomatite Vesicular (VEV): o New Jersey (NJ) e o Indiana
(Ind). A metodologia molecular de reação em cadeia da polimerase (PCR) após
transcrição reversa (RT – PCR) baseada na amplificação específica de genes do
VEV foi implementada, podendo ser utilizada como um método alternativo para a
detecção do vírus. Um total de 12 amostras de referência do VEV e 14 espécimes
do Equador foram utilizados para a implementação da RT – PCR. Inicialmente
utilizou-se “primers” que flanqueiam regiões dentro dos genes que codificam as
proteínas L e P do vírus. Os resultados mostram uma melhor adequação dos
“primers” que reconhecem o gene P na amplificação específica do VEV de cepas de
referência dos sorotipos NJ e Ind 1, assim como nos espécimes colhidos de
episódios a campo. Esses “primers” amplificam um produto de 642 pb para NJ e 614
pb para Ind. Os resultados foram concordantes com os dados obtidos por Fixação
de complemento 50% e confirmados pelo seqüenciamento das bases nucleotídicas
que foram alinhadas e comparadas entre si e com seqüências do VEV publicadas.
Palavras-Chave: Reação em Cadeia da Polimerase após Transcrição Reversa,
RT – PCR, Estomatite Vesicular, Diagnóstico molecular.
ABSTRACT
Vesicular Stomatitis (VS) is a disease caused by a virus from the Rhabdoviridae
family, Vesiculovirus genus. The disease has a great impact in animal health, as
infected animals present marked decrease in meat and milk production. Its presence
is a limiting factor for international animal trade. Besides the damage in the livestock
productivity, such disease assumes an important role in animal health programs
since it is clinically indistinguishable from Foot-and-Mouth Disease. The diagnosis of
the VS has been made, mainly, through Complement Fixation, ELISA (Enzymelinked immunosorbent assay) and Virus Neutralization tests, assays that allow not
only for viral detection but also for differentiation of the two serotypes described for
Vesicular Stomatitis Virus (VSV): New Jersey (NJ) and Indiana (Ind). A molecular
diagnostic approach the polymerase chain reaction (PCR) performed after reverse
transcription (RT – PCR) based on the specific amplification of VSV genes was
implemented, becoming an alternative method for the detection of the virus. A total of
12 VSV reference samples and 14 specimens collected from field episodes in
Ecuador were used for the implementation of the RT–PCR. Initially, "primers" that
amplify regions within the L and P genes of the virus were used. Our results showed
a better fitness of the “primer” that recognizes the P gene for specific amplification of
VSV, both for reference NJ and Ind1 strains, as well as for samples collected from
field episodes This "primer" amplifies a product of 642 bp for NJ and 614 bp for Ind.
The results were compatible with data obtained through Complement Fixation test
and confirmed by nucleotide sequencing of the amplified products. The sequences
obtained were aligned and compared with published sequences of VSV.
Keywords: Polymerase Chain reaction; RT – PCR, Vesicular Stomatitis, molecular
diagnosis.
1 INTRODUÇÃO
A disponibilidade de fonte de proteína animal contribui significativamente para
a melhoria de qualidade de vida da população. Os ruminantes domésticos são
importante fonte dessas proteínas sendo as enfermidades transmissíveis a esses
animais, responsáveis por elevadas perdas econômicas e conseqüentemente perda
na qualidade de vida da população.
Dentre as diversas enfermidades transmissíveis temos a Estomatite Vesicular
(EV), uma enfermidade viral contagiosa que acomete principalmente eqüinos,
bovinos e suínos, podendo também afetar uma diversidade de animais domésticos e
silvestres, incluindo o homem. Atualmente está restrita ao Continente Americano
(HANSON, 1952).
O vírus da Estomatite Vesicular (VEV) é o protótipo da família Rhabdoviridae,
com dois sorotipos principais: New Jersey (NJ) e Indiana (Ind) (BISHOP, 1979).
Possui propriedades que contribuem para que seja um excelente modelo para
estudo em virologia molecular: é um vírus infectante com genoma simples composto
de uma cadeia de RNA com peso molecular de aproximadamente 3,5 x 106 daltons;
o virion serve de molde para a síntese de pequenos RNA mensageiros (RNAm)
possuindo sua própria RNA trascriptase que é capaz de sintetizar RNAm “in vitro” e
é muito utilizado no estudo de interação entre célula – vírus devido à variedade de
hospedeiros, vertebrados e invertebrados, que possui na natureza (EMERSON,
1976).
A EV é uma enfermidade de reconhecida importância em saúde animal com
graves conseqüências sócio–econômicas uma vez que o animal acometido
apresenta queda na produção de leite e carne (MASON, 1978). Sua presença é um
fator limitante para o comércio internacional de animais e seus subprodutos
17
(HAYEK et al., 1998). Além do prejuízo na produtividade do gado, assume um papel
importante para os programas de saúde animal por ser indistinguível clinicamente,
em suínos e bovinos, da Febre Aftosa (FA) (FERRIS; DONALDSON, 1988) - severa
enfermidade vesicular que vem provocando grandes prejuízos na economia das
Américas (OLASCOAGA et al., 1999).
Os animais acometidos pela EV apresentam febre e formação de vesículas na
mucosa da boca, epitélio lingual, lábios, região interdigital das patas e tetas. Deixam
de se alimentar e conseqüentemente perdem peso cessando, por vezes, a lactação.
(BISHOP, 1979).
A enfermidade clínica é geralmente observada em bovinos adultos sendo as
lesões raramente observadas em bezerros. Pode ser observada sob forma
subclínica apresentando um quadro de debilidade geral. A incidência da
enfermidade clínica pode variar de 5 a 50 % podendo atingir a 90% do rebanho. A
mortalidade raramente excede a 5% (OIE, 2005).
EV está incluída na Lista das enfermidades de declaração obrigatória da
Organização Mundial de Saúde Animal (OIE), classificada como uma doença que
pode se estender além das fronteiras nacionais, com conseqüências sócioeconômicas ou sanitárias graves e importantes conseqüências no comércio
internacional de animais e produtos de origem animal (OIE, 2005). Esta inclusão
resulta na imposição de quarentena e na realização de testes para controle da
doença.
As lesões dos animais acometidos pela EV são ricas em partículas virais
sendo o vírus facilmente isolado por inoculação em cultivo celular ou em
camundongos lactentes. A identificação do vírus pode ser feita principalmente por
provas de Fixação de Complemento (FC50), testes imunofluorescentes com uso de
anticorpos monoclonais ou por testes imunoenzimáticos (ELISA) (ALONSO, 1983;
ALLENDE et al.,1992).
A identificação do VEV por amplificação do RNA viral através da técnica de
RT – PCR (Reação em Cadeia da Polimerase após Transcriptase Reversa) tem sido
descrita na literatura (RODRIGUEZ et al., 1993; HOFNER et al., 1994; NÜÑEZ et al.,
1998). Essa técnica amplifica milhões de vezes uma região delimitada por “primers”
detectando pequenas quantidades de ácido nucléico presente nas amostras. Esse
método possui a vantagem de ser sensível e específico permitindo a detecção do
VEV diretamente de amostras de tecidos, possibilitando um diagnóstico rápido e
18
seguro o que contribui para respostas imediatas e direcionadas na tomada de
medidas sanitárias.
Esse estudo teve como objetivo a implementação da técnica da RT - PCR
para detecção e diferenciação do VEV NJ e Ind. Em seu desenvolvimento utilizou-se
amostras de referência do Centro Pan-Americano de Febre Aftosa (PANAFTOSA) e
isolados de animais com suspeita clínica de enfermidade vesicular para:
•
Extração o RNA viral e amplificação de diferentes regiões do genoma.
•
Estabelecimento de condições mais apropriadas (“primers”, tampões,
ciclos
e
temperatura
de
anelamento)
para
a
amplificação
e
identificação do material por RT - PCR.
•
Comparação dos resultados obtidos dos diferentes ensaios da RT PCR com os resultados dessas mesmas amostras por prova de FC50.
•
Seqüenciamento da região genômica delimitada pelos “primers” para
confirmação dos resultados obtidos pela RT – PCR através da
comparação dessas seqüências com as obtidas no banco de dados
disponíveis na Internet (GenBank).
2 REVISÃO DE LITERATURA
2.1 ESTOMATITE VESICULAR
A Estomatite Vesicular é uma enfermidade viral transmissível que acomete
preferencialmente eqüinos, bovinos e suínos. Ovinos, caprinos e mamíferos
silvestres também podem se infectar (ALONSO et al., 1991; OIE, 2005). Com menor
freqüência pode acometer o homem causando sintomas semelhantes à gripe
(MASON, 1978), mas existem relatos da forma cutânea da enfermidade devido à
infecção acidental de trabalhadores de laboratório por aerossóis ou trabalhadores
que realizaram necropsia de animais infectados (HANSON, 1981; BISHOP, 1979).
Os animais acometidos pela EV apresentam febre e formação de vesículas na
mucosa da boca, epitélio lingual, lábios, região interdigital das patas e tetas.
Normalmente as vesículas aparecem em um só tecido susceptível não ocorrendo
generalização (BISHOP, 1979).
As vesículas que ocorrem na boca, lábios e gengivas causam excessiva
salivação dificultando a alimentação. O animal perde peso, pois não se alimenta
adequadamente e reluta em andar devido às dores provocadas pelas lesões na
banda coronária das patas. Severa mastite pode ocorrer em virtude das vesículas
nas tetas dificultando amamentação dos bezerros que podem se infectar por essa
via (BISHOP, 1979; MAAS, 2005; CALLIS et al., 1981).
O período de incubação da enfermidade varia de 3 a 14 dias e o animal se
convalesce em um período de 2 - 3 semanas (LETCHWORTH et al., 1999). Infecção
subclínica pode ocorrer tanto em animais quanto em humanos que tiveram contato
com o vírus uma vez que podem não desenvolver a enfermidade, mas apresentam
20
níveis elevados de anticorpos no soro (BISHOP, 1979). A enfermidade acomete uma
percentagem alta do rebanho, mas a mortalidade é praticamente inexistente em
bovinos e eqüinos. A infecção geralmente é inaparente com cerca de 10-15% dos
animais adultos apresentando sinais clínicos (OIE, 2005). Os bovinos e eqüinos com
menos de 1 ano de idade raramente são afetados. Prejuízos economicamente
significativos são mais observados entre os suínos e bovino leiteiro (MAAS, 2005).
Suínos afetados com a cepa New Jersey apresentam alta mortalidade (OIE, 2005).
As perdas econômicas em rebanho, tanto de carne quanto de leite, sua
importância para os programas de saúde animal por se similar clinicamente a FA e a
possibilidade de produzir enfermidades em humanos, demonstra a importância
sócio-econômica dessa enfermidade (HANSON, 1981; MASON, 1978).
2.1.1 O Vírus da Estomatite Vesicular
O vírus da Estomatite Vesicular pertence à família Rhabdoviridae, gênero
Vesiculovirus (ICTVdb, 2005). Estão incluídos na grande ordem Mononegavirus, ou
seja, vírus que possuem RNA de cadeia simples e negativa não podendo ser
traduzido diretamente em proteínas possuindo, portanto, sua própria RNA
trascriptase para fazer a transcrição do seu genoma e produção de RNAm.
O gênero Vesiculovirus inclui, além do VEV, os vírus Chandipura, Isfahan e
Piry que produzem meningoencefalite em humanos (BONUTTI; FIGUEIREDO,
2005).
São conhecidos dois tipos antigenicamente distintos do VEV: New Jersey e
Indiana (MASON, 1978) sendo o Indiana dividido em três subtipos: Indiana 1 para o
vírus isolado nos Estados Unidos; Indiana 2 Cocal, isolado em Trinidad e Indiana 3
isolado em Alagoas – Brasil (FEDERER et al., 1967).
2.1.2 Estrutura e composição do Vírus da Estomatite Vesicular
O VEV possui morfologia semelhante a um projétil com uma extremidade
arredondada e outra plana, com dimensões aproximadas de 175 X 68 nm.
(PRINGLE, 1986) (FIGURA 1).
21
FIGURA 1: VEV purificado de cultivo de célula infectada. Coloração negativa do
virion
onde
se
percebe
claramente
a
forma
de
um
projétil.
Ampliado
aproximadamente x 40,000 (MURPHY, 2005).
O genoma é um RNA de cadeia simples com aproximadamente 11.000
nucleotídeos, composto de 5 genes na ordem de 3’ N-P(NS)-M-G-L 5’ separados um
do outro por apenas 2 nucleotídeos (região intergênica, não transcrita) (WAGNER,
1991; DEWHURST, 2005) (FIGURA2). Possuem também duas pequenas proteínas
C e C’ que são codificadas em uma segunda fase de leitura aberta dentro do gene
P, não se sabendo ainda a sua função (ARBOLEDA; TRUJILLO, 2002).
FIGURA 2: Esquema do genoma do VEV. Os números entre parênteses
representam os nucleotídeos não codificados. (WAGNER, 1991).
O virion é formado por duas unidades estruturais distintas: o nucleocapsídeo
ou ribonucleoproteína (RNP) interna e a membrana externa. (WAGNER, 1991)
(FIGURA 3).
22
O nucleocapsídeo é composto pela nucleoproteína (N) que possui 1.333
nucleotídeos e que envolve abundantemente o RNA viral formando a RNP helicoidal.
Tem função crítica no empacotamento do genoma viral dentro de um núcleo
resistente a Rnases (ARBOLEDA; TRUJILLO, 2002). Está associada a duas outras
proteínas em menor quantidade: polimerase (L) com 6.380 nucleotídeos e
fosfoproteína (P ou NS) com 822 nucleotídeos (SCHUBERT et al. 1984).
O gene que codifica a proteína L representa aproximadamente 60% do
genoma do VEV. É uma proteína altamente conservada entre os sorotipos do VEV.
Seu grande tamanho reflete a natureza multifuncional dessa proteína na transcrição,
replicação, poliadenilação e replicação do RNA viral (ARBOLEDA, 2002).
A fosfoproteína P que em combinação com a proteína L formam o complexo
de transcrição ativa é fosforilada para gerar a atividade de polimerase. Através da
análise genética dos diferentes genes de vários VEV identificou-se uma região
bastante variável do gene da proteína P. Estudos evolucionários de árvores
filogenéticas utilizando esse gene indicam que este fragmento é altamente
informativo e confiável para estudos de relações filogenéticas dos diferentes
isolados do VEV (BILSEL, 1990: NICHOL et al., 1993).
As duas pequenas proteínas básicas C (55 aminoácidos) e C’ (65
aminoácidos) formada a partir de uma segunda fase de leitura aberta do gene P
possuem funções desconhecidas, mas parecem possuir importante papel na
patogenia ou na transmissão do vírus por insetos vetores (ARBOLEDA, 2002).
A membrana externa é composta de camada lipoprotéica e proteínas. A
camada lipoprotéica é dupla e está fortemente associada à RNP. Os lipídios são
totalmente derivados da célula hospedeira, mas diferem na sua composição. Esta
alteração contribui para uma melhor viscosidade da membrana do VEV em
comparação com a membrana da célula hospedeira da qual foi derivada (WAGNER,
1991).
As proteínas principais que compõem a membrana do VEV são a
glicoproteína (G) e a proteína Matriz (M). A glicoproteína, composta de 1.672
nucleotídeos, forma pontas triplas na superfície do vírus sendo o principal
determinante antigênico além de induzir a formação de anticorpos neutralizantes
(SCHUBERT et al., 1984). A proteína Matriz de pequeno tamanho (838
nucleotídeos), mas em maior quantidade no virion, é responsável por manter o
nucleocapsídeo firmemente ligado à membrana interna do envelope lipoprotéico.
23
Essa proteína tem importante papel na inibição da síntese de RNA para que se inicie
o processo de associação das proteínas do capsídeo durante a replicação viral
(SCHUBERT et al. 1984; RODRIGUEZ et al., 1996; WAGNER, 1991).
FIGURA 3: Esquema da estrutura do vírus da Estomatite Vesicular indicando a
localização das principais proteínas virais e a composição do RNA viral: 3’ N-P-M-GL 5’ (DEWHURST, 2005).
2.1.3 Ciclo de replicação do Vírus da Estomatite Vesicular
A infecção se inicia com a adsorção - união do vírus a um receptor da célula
hospedeira. O vírus penetra na célula por endocitose ocorrendo a fusão do envelope
do vírus com a membrana do endossoma, evento catalisado pela proteína G. Em
seguida, a proteína M se dissocia da RNP que então é liberado dentro do citoplasma
da célula hospedeira (ARBOLEDA;TRUJILLO, 2002).
A reação de transcrição do RNA viral depende das três proteínas estruturais;
a proteína L e P e a proteína interna N que envolvendo o RNA serve de molde para
a transcrição (WAGNER, 1991). Juntas compõem a polimerase, se ligam à
extremidade 3’ do genoma viral transcrevendo o RNA (Líder) de 47 nucleotídeos. O
RNA Líder funciona como um iniciador da transcrição (promotor) que é
24
obrigatoriamente seqüencial refletindo a posição de cada gene (WHELAN; WERTZ
2002; LETCHWORTH et al., 1999). Seqüências conservadas de dinucleotídeos
aparecem no limite de cada gene como sinal de terminação e poliadenilação de um
RNAm e de iniciação da próxima transcrição. (LETCHWORTH et al., 1999;
ARBORLEDA, 2002). O resultado é que se produz mais RNA mensageiro a partir
dos genes que estão mais próximos do promotor e sua abundância decresce à
medida que se distancia dele sendo N > P > M > G > L (WHELAN; WERTZ, 2002,
WAGNER, 1991). A transcrição é totalmente independente das funções da célula
hospedeira.
Cada RNA codifica uma única proteína. Um sinal que provavelmente envolve
o acúmulo da proteína N bloqueia a poliadenilação e a clivagem do RNAm fazendo
com que a polimerase passe a sintetizar uma cadeia completa de RNA positivo
chamado de intermediário replicativo. Esse intermediário replicativo servirá de molde
para a síntese de novas cadeias completas negativas durante a replicação
(LETCHWORTH et al., 1999). Essas cadeias de RNA se unem às proteínas N, P e L
para formar o complexo ribonucleoproteico (RNP). O RNP se associa com a
membrana citoplasmática onde se encontram as proteínas M e G e se condensa
dentro de uma estrutura fortemente espiralada. O virion completo é liberado por
rompimento da membrana (ARBORLEDA, 2002; FENNER, 1974).
2.1.4 Partículas defectivas
Passagens seriadas, não diluídas do VEV em cultivo de célula resultam em
suspensão virulenta com baixo título se comparada com passagens seriadas
diluídas. Isso se deve a presença de partículas de VEV não infecciosa, de baixa
densidade, mas com constituição química similar ao vírus infeccioso (HOWATSON,
1970). Estas partículas conhecidas como partículas defectivas possuem estrutura,
antigenicidade e constituição química semelhante ao vírus infeccioso (HOWATSON,
1970). São 20 – 50% de menores que as partículas infecciosas e não é infecciosa
porque o genoma é cerca de 50 – 80% menor (WAGNER, 1991).
A produção de partículas defectivas (DI) é característica de algumas espécies
de vírus e acredita-se que possa moderar a severidade da enfermidade clínica “in
vivo” (CARTER et al., 2004).
25
2.2 HISTÓRICO E DISTRIBUIÇÃO GEOGRÁFICA DA ESTOMATITE VESICULAR
A Estomatite Vesicular é uma enfermidade restrita ao Hemisfério Ocidental,
entretanto existem relatos da enfermidade na África do Sul, em cavalos, que datam
do século XIX (1884 e 1887). Após esse episódio, não houve mais notificações da
doença nesta localidade ou em nenhuma outra parte da África. É mais provável que
sempre tenha estado presente nas Américas e que em algum momento possa ter
sido levado para a África. (HANSON, 1952). Postula-se também, que a causa do
surto tenha tido como agente etiológico um outro vírus membro da mesma família da
EV onde seu reservatório na África do Sul tenha sido destruído (HANSON, 1981).
Nos anos de 1915 – 1917, um surto de EV em cavalos, ocorrido na França,
teria como origem a importação desses animais do Canadá e EUA durante a
Primeira Guerra Mundial e que posteriormente teria se disseminado pela Itália e
Alemanha (HANSON, 1981; BISHOP, 1979). Não ocorreram mais registros da
enfermidade na Europa. Atualmente a EV está limitada às Américas (HANSON,
1984).
Os primeiros relatos da EV nos Estados Unidos datam de 1821. A etiologia
viral da enfermidade foi estabelecida por Cotton em 1926 (MASON, 1978) quando se
isolou o agente infeccioso de um foco ocorrido em Indiana (EUA) - denominado
sorotipo Indiana (Ind). Posteriormente em outro foco ocorrido em bovinos de New
Jersey (EUA) demonstrou-se que o agente causal era antigenicamente distinto do
Ind isolado anteriormente, sendo chamado de New Jersey (NJ) (BISHOP; 1979
HANSON, 1952).
A primeira descrição da enfermidade na América do Sul data do ano de 1929,
na Colômbia, apresentando ampla distribuição tanto de NJ quanto de Ind
(PANAFTOSA, 2005). Em 1939 foi detectada em eqüinos da Argentina e
posteriormente na Venezuela e Equador (HANSON, 1952). Embora existam
registros de focos de NJ e Ind nessas regiões, no Equador o sorotipo Ind não
apresenta níveis de significância (ASTUDILLO et al., 1984).
Até 1961 ocorreram somente relatos dos dois tipos clássicos de EV: NJ e Ind.
Nesse ano, cepas sorologicamente distintas foram descritas. A cepa Indiana 2 Cocal
foi isolada de pulgas que se alimentavam de ratos de arrozais na floresta de Trinidad
(América Central) e que possui relação sorológica com a posteriormente isolada em
26
Belém (Brasil) também a partir de pulgas (MASON, 1978: ANDRADE et al., 1980).
Em 1963, na Argentina, uma cepa idêntica à cepa Cocal foi isolada de cavalos da
província de Buenos Aires, sendo denominada cepa Salto (Indiana 2 Salto –
Argentina/63) (PIRAZZI et al., 1966; ALONSO, 1983). De 1966 a 1968 o Indiana 2 foi
diagnosticado no Brasil, no município de Rancharia (São Paulo) onde se isolou o
vírus Indiana 2 Rancharia (Indiana 2 Rancharia – Brasil/66) vírus esse relacionado
com o Indiana 2 Salto (PUSTIGLIONE NETTO et al., 1969; PANAFTOSA, 2005;
ALONSO, 1983). Novas epidemias do Indiana 2 ocorreram em 1978 no Rio Grande
do Sul e em 1979 no município de São José de Boa Vista (São Paulo) onde foi
isolado um vírus também relacionado ao Indiana 2 Salto sendo denominado Indiana
2 Ribeirão – Brasil/79. Em 1998 novos focos ocorreram em Santa Catarina e Paraná
(LÓPEZ, 1996-1997).
Em 1964, ocorreu um surto em mulas, em diversas parte do Estado de
Alagoas (Brasil) e no Estado vizinho de Pernambuco (MASON, 1978; ANDRADE et
al., 1980). O vírus isolado era sorologicamente diferente dos VEV conhecidos como
Ind e Cocal e foi denominado Indiana 3 Alagoas (Indiana 3 Alagoas – Brasil/64). O
primeiro isolamento no estado de Minas Gerais ocorreu em 1977 no município de
Espinosa, de uma cepa similar ao Indiana 3 Alagoas sendo designado Indiana 3
Espinosa (Indiana 3 Espinosa – Brasil/77) (ALONSO, 1983). Atualmente o vírus
Indiana 3 é endêmico no norte de Minas Gerais e Ceará.
Dos vírus descritos como agente etiológico da EV, somente os subtipos
Indiana 2 e Indiana 3 apresentam importância epidemiológica no Brasil (LÓPEZ,
1996 -1997), não havendo relatos da ocorrência do tipo NJ provavelmente devido ao
clima tropical já que este tipo é característico de climas temperados (De STEFANO
et al., 2002).
As relações entre as cepas dos subtipos Ind foram estudadas por FEDERER
et al. (1967) que propuseram a seguinte classificação: Indiana 1 para a amostra
clássica isolada nos EUA; Indiana 2 para as amostras Cocal (Trinidad) e Salto
(Argentina) e Indiana 3 para a amostra Alagoas. Portanto o sorotipo NJ não possui
subtipo e tem ampla distribuição nas áreas temperadas da América do Norte e o
sorotipo Indiana possuiria três subtipos no qual dois estão limitados a América do
Sul. (MASON, 1978). Nova classificação tem sido proposta onde os subtipos Cocal
e Alagoas seriam classificados como espécie (ICTVdb, 2005).
27
Atualmente a enfermidade apresenta atividade endêmica do norte da América
do Sul (Colômbia, Equador, Peru e Venezuela) ao norte do México e sudeste dos
Estados Unidos. Atividade epidêmica geralmente acorre no sul da América do Sul,
Estados Unidos e Canadá (RODRIGUEZ et al., 1996; ARBOLEDA; TRUJILLO,
2002) (FIGURA 4).
Intervalo entre Ocorrências
Não Reportado
≥ 10 anos
5 – 10 anos
< 1 ano
FIGURA 4: Distribuição geográfica e epidemiológica do Vírus da Estomatite
Vesicular (ARBOLEDA; TRUJILLO, 2002).
2.2.1 Aspectos epidemiológicos
A enfermidade ocorre anualmente ou em intervalos de 2 – 3 anos em áreas
tropicais e subtropicais. Os intervalos aumentam quando se move dos trópicos para
regiões temperadas da América do Norte e América do Sul (HANSON, 1981). Os
surtos iniciam repentinamente no verão e aparecem em várias localidades
28
simultaneamente
de
uma
área
restrita.
Possuem
distribuição
irregular
e
freqüentemente não são observados casos em propriedades adjacentes (MASON,
1978).
O mecanismo de transmissão do VEV e o modo pelo qual é mantido na
natureza durante os surtos endêmicos e epidêmicos não estão totalmente
esclarecidos (VANLEEUWEN et al., 1995). Estudos de patogenia comprovam que o
VEV não é capaz de penetrar a pele intacta nem de ser introduzida através de
alimentos ou por reservatório de água. A infecção natural deve ocorrer por meio de
lesões na língua, tetas ou na pele da banda coronária das patas entre animais
suscetíveis. A maioria dos animais susceptíveis pode ser infectada por via
nasofaringe (MASON, 1978).
A maior ocorrência de focos de EV em meses quentes e chuvosos, a rápida
difusão da enfermidade em grandes áreas de vasta vegetação e correntes de água
natural sugere a hipótese de que o VEV poderia ser transmitido por insetos
(MASON, 1978). Essa hipótese poderia explicar a variação sazonal da doença com
maior freqüência na estação chuvosa em áreas tropicais, desaparecendo no início
do inverno em áreas temperadas (BILSEL et al., 1990; LETCHWORTH et al., 1999)
e seria corroborada pelo fato do vírus já ter sido isolado em artrópodes. Os
Phlebotomus são o grupo de insetos freqüentemente associado à transmissão do
VEV, porém pouco se sabe sobre o mecanismo e locais de replicação do vírus
nesses insetos (WEAVER et al, 1992). O vírus Indiana tem sido repetidamente
isolado em Phlebotomus e em mosquitos do gênero Aedes (MASON, 1978). O vírus
da EV foi propagado em “in vitro”, em células de Aedes aegypti, Aedes albopictus
(ARTSOB; SPENCER, 1974) e em células de mosca de frutas Drosophila
melanogaster (PRINTZ, 1970). O vírus Indiana 1, Indiana 3 Alagoas e New Jersey
têm sido isolados de Phlebotomus naturalmente infectado onde a transmissão
transovariana tem sido demonstrada pelo isolamento de vírus em macho, uma vez
que somente as fêmeas se alimentam de sangue (COMER et al., 1992). Existem,
porém, várias objeções a essa hipótese. Uma delas postula que eqüinos, bovinos e
suínos não produziriam viremia suficiente para infectar artrópodes hematófagos
sendo, portanto os animais domésticos hospedeiros terminais (CALLIS et al., 1981;
ARBOLEDA; TRUJILLO, 2002); ou que a distribuição espacial da enfermidade
durante o foco não seria típico de enfermidade transmitida por insetos onde regiões
29
contíguas não são afetadas; e de não ter sido possível isolar o vírus de artrópodes
durante algumas ocorrência da enfermidade (CALLIS et al., 1981).
Existe também a teoria de que o VEV seria um vírus de planta, sendo os
animais o final de uma cadeia epidemiológica ou que em alguma circunstância
possa sofrer um processo de adaptação para infectar animais (MASON, 1978; OIE,
2005). O VEV poderia ser transmitido aos insetos quando se alimentam de sucos da
planta e estes insetos passariam o vírus aos vertebrados quando acidentalmente
fossem ingeridos junto com os alimentos vegetais (MASON 1978).
2.3 DIAGNÓSTICO
O aparecimento de sinais clínicos de doenças vesiculares em animais na
América do Sul causa suspeita de um episódio de FA, trazendo grandes implicações
sócio-econômicas. Na dificuldade do diagnóstico clínico, o diagnóstico laboratorial se
torna imprescindível para a identificação de amostras clínicas negativas a essa
enfermidade (MASON, 1978; HOFNER et al., 1994; De STEFANO et al., 2003;
RODRIGUEZ et al., 1993; ALONSO, 1991).
Com o objetivo de facilitar o diagnóstico diferencial, a coleta de material para
detecção do VEV deve estar em concordância com os métodos utilizados para o
diagnóstico de FA e outras enfermidades confundíveis. Material de fluidos
vesiculares e epitélio de vesículas rompidas de lesões da boca, patas ou outros
locais são os indicados para testes laboratoriais (OIE, 2005; CALLIS et al., 1981).
Quando não é possível se obter o tecido epitelial de bovinos, pode-se coletar fluidos
esofágico-faríngeo (OIE, 2005).
As ferramentas disponíveis para o diagnóstico do VEV são a identificação
e/ou isolamento viral que pode ser feito por inoculação em cultivo de célula, ovos
embrionados ou camundongos lactentes. Para a identificação do vírus utiliza-se os
testes de FC50 (FEDERER et al., 1967; ALONSO, 1986), ELISA Sanduíche-Indireto
(Enzyme-linked immunosorbent assay) (ALONSO et al., 1991), imunofluorencência
com Anticorpos Monoclonais e Virusneutralização (FEDERER et al., 1967; ALONSO,
1986).
Quando não é possível a identificação do agente, pode-se utilizar amostras
pareadas de soro de um mesmo animal com intervalo de 1 a 2 semanas entre
30
coletas, para detectar e quantificar anticorpos específicos. O aumento no título de
anticorpos pode ser um indicativo de infecção recente. A identificação e
quantificação de anticorpos no soro podem ser feitas por prova de ELISA e
Virusneutralização. A FC50 também pode ser utilizada quando se coleta o soro de
animais logo após o início da infecção (OIE, 2005).
O uso de técnicas moleculares para a caracterização do agente vem sendo
cada vez mais utilizado (MALIRAT; BERGMANN, 2003). Dentre essas técnicas
temos a Reação em Cadeia da Polimerase (PCR), um método de diagnóstico rápido
e sensível, onde uma parte do genoma viral pode ser detectado de variados tipos de
espécimes e amostras. Essa técnica vem substituindo a maioria dos métodos diretos
clássicos de detecção de agente infeccioso. Possui a vantagem adicional de utilizar
tanto o tecido epitelial quanto suspensão viral inativadas, não oferecendo risco
biológico à saúde humana e animal e podendo também ser realizado em áreas livres
ou exóticas da doença (THOMPSON et al., 1998). Além do mais, as amostras de
campo enviadas para o diagnóstico, em muitos casos chegam ao laboratório em mal
estado de conservação dificultando o isolamento devido à contaminação bacteriana
ou a conteúdos citotóxico como, por exemplo, os anti-sépticos utilizados pelos
criadores para tratar as lesões dos animais. Essas contaminações não afetam a
PCR (RODRIGUEZ et al., 1993).
A detecção do VSV por amplificação do RNA viral por RT – PCR tem sido
descrito na literatura (RODRIGUEZ et al., 1993; HOFNER et al., 1994; NÜÑEZ et al.,
1998). Essa técnica amplifica milhões de vezes uma região delimitada por “primers”
detectando pequenas quantidades de ácido nucléico presente nas amostras e que
são reveladas por bandas observadas em gel de agarose. Provém ainda DNA
suficiente para o seqüenciamento e tipificação genética (RODRIGUEZ et al., 1993).
A aplicação de técnicas moleculares na caracterização do agente e posterior
análise filogenética em estudo epidemiológico tem sido muito utilizado, resultando
em importante aporte na identificação, caracterização e possível rastreamento das
fontes de disseminação do vírus (MALIRAT; BERGMANN, 2003). A aplicação
apropriada da ferramenta molecular auxilia na vigilância da enfermidade e na
detecção da fonte da infecção (THOMPSON et al., 1998).
Através do cálculo de distâncias genéticas com alinhamento de amostras
seqüenciadas pode-se construir árvores filogenéticas (MALIRAT; BERGMANN,
2003) que proporcionam informações valiosas sobre a dinâmica das populações,
31
história evolucionária, classificação e taxonomia do vírus (MALIRAT; BERGMANN,
2003).
Regiões altamente conservadas podem revelar relações taxonômicas entre as
espécies, moderadamente conservadas pode diferenciar cepas ou relações entre
espécies relacionadas, moderada variação pode indicar a estrutura genética da
população e altamente variável permite traçar uma verdadeira identidade do isolado
dentro da população. A região do DNA examinada deve ser apropriada ao que se
pretende esclarecer (THOMPSON et al., 1998).
3 MATERIAL E MÉTODOS
3.1 INFRA-ESTRUTURA
O trabalho foi desenvolvido no Laboratório de Biologia Molecular do Centro
Pan-Americano de Febre Aftosa (PANAFTOSA).
3.2 AMOSTRAS DE REFERÊNCIA
Um total de 12 cepas da coleção do Centro Pan-Americano de Febre Aftosa
(PANAFTOSA – OPS – OMS) foi utilizado no experimento (QUADRO 1). Os
sobrenadantes obtidos através de inoculação em monocamada de células BHK-21
(Baby Hamster Kidney), conservadas à -70°C, foram descongelados e colocadas em
TRIZOL (Invitrogen, SP, Brasil) para a extração do RNA.
33
QUADRO 1: Amostras de Referência da coleção da PANAFTOSA utilizados para a
implementação do RT – PCR para o diagnóstico da EV.
Amostras de Referência
Abreviação
Vírus da Estomatite Vesicular
New Jersey Costa Rica / 66
NJ CR /66
New Jersey Equador / 85
NJ Eq /85
Indiana 1 Costa Rica / 72
Ind 1 CR /72
Indiana 1 El Salvador / 71
Ind 1 ES /71
Indiana 1 El Salvador / 78
Ind 1 ES /78
Indiana 1 Costa Rica / 79
Ind 1 CR /79
Indiana 2 Rancharia Brasil / 66 Ind 2 Ranc BR /66
Ind 2 Ribeirão Brasil / 79
Ind 2 Rib BR /79
Indiana 3 Ag. Negras Brasil / 86 Ind 3 A N BR /86
Indiana 3 Espinosa Brasil / 77 Ind 3 Esp BR /77
Vírus da Febre Aftosa
O1 Campos Brasil / 58
O1 Cps BR /58
A 24 Cruzeiro Brasil / 55
A24 Cruz BR /55
3.3 ESPÉCIMES CLÍNICOS
Foram utilizados 14 espécimes (epitélio de animais com suspeitas clínicas de
enfermidades vesiculares) proveniente do Equador coletados no ano de 2004
caracterizados antigenicamente por FC50 e enviados ao Laboratório de Biologia
Molecular do PANAFTOSA em TRIZOL para o diagnóstico molecular. Uma replica
foi enviada ao Laboratório de Diagnóstico primário para confirmação por FC50,
seguindo metodologia descrita por Alonso, 1986. (QUADRO 2).
34
QUADRO 2: Espécimes clínicos provenientes do Equador utilizados para a
implementação do RT – PCR para o diagnóstico da EV.
Identificação
Tipo de tecido
Identificação
Tipo de tecido
029 - 2
029 - 3
029 - 4
029 - 5
029 - 6
029 - 8
029 - 9
Epitélio Lingual Bovino
Epitélio Lingual Bovino
Glândula Mamária Bovino
Epitélio Lingual Bovino
Epitélio Lingual Bovino
Epitélio Lingual Bovino
Epitélio Bovino
029 - 10
029 - 11
029 - 12
029 - 18
029 - 19
029 - 20
029 - 33
Epitélio Bovino
Epitélio Lingual Bovino
Epitélio Bucal Bovino
Epitélio Bucal Bovino
Epitélio Bucal Bovino
Epitélio Gengival Bovino
Epitélio Bucal Bovino
Adicionalmente foram testadas 30 isolados diagnosticados como Febre Aftosa
por FC50 e por RT – PCR.
3.4 “PRIMERS”
Dois pares de “primers” foram inicialmente testados para a implementação da
RT - PCR (QUADRO 3).
Utilizou-se os “primers” publicados por RODRIGUEZ et al. (1993) que
reconhecem um fragmento específico do RNA dentro do gene que codifica a
fosfoproteína (gene P) e gera um fragmento de 642 pb para New Jersey ("Primer” NJ
102 / 744) e de 614 pb para Indiana (“Primer” Ind 179 / 793).
Também foram testados “primers” publicados por NÜÑEZ et al. (1998) que
delimitam uma região do gene L originando um fragmento de 301 pb para New
Jersey (“Primer” NS / NA) e de 359 pb para Indiana (“Primer” IS / IA).
35
QUADRO 3: “Primers” a serem testados na implementação da RT - PCR para a
detecção do vírus da Estomatite Vesicular.
Gene
Fragmento N° acesso *
Gene P
642
M31868
Gene L
301
M29788
Gene P
614
X04453
Gene L
359
J02428
New Jersey
Direção Iniciador
Direto NJ-P 102
Reverso NJ-P 744
Direto
NS
Reverso
NA
Indiana
Direto IN-P 179
Reverso IN-P 793
Direto
IS
Reverso
IA
Seqüência
5' GAGAGGATAAATATCTCC 3'
5' GGGCATACTGAAGAATA 3'
5’ACTCATGCGGTATTTACCCTTG 3’
5’ TTGGTTTGGAACTTGGATTC 3’
5' GCAGATGATTCTGACAC 3'
5' GACTCT(C/T)GCCTG(A/G)TTGTA 3'
5’GGTGGTTATTCCATTTTTCG 3'
5’GGTGTTGCAGACTATGTTGGAC 3’
* GenBank
3.5 EXTRAÇÃO DE RNA
Para a extração do RNA utilizou-se o produto comercial TRIZOL seguindo as
orientações do fabricante. Esse método desenvolvido por Chomczynski e Sacchi
(1987), baseia-se na desnaturação e precipitação de proteínas através do fenolclorofórmio e solução de isotiocianato de guanidina que é um poderoso inibidor da
enzima Rnase, para posterior precipitação do RNA com álcool.
Utilizou-se, aproximadamente, 1 g de epitélio dos espécimes do Equador
(epitélio) que foi macerado em 1 mL de TRIZOL.
Os sobrenadantes (suspensão virulenta) obtidos através de inoculação em
monocamada de células BHK-21 das amostras de referência VEV e a suspensão
celular (BHK-21) utilizada como controle de células foram colocadas em tubo
“eppendorf” de 1,5 mL, na proporção de 250 µL de suspensão para 750 µL de
TRIZOL e conservados a temperatura de -70°C até a data de extração.
Para a extração, os espécimes e amostras foram, separadamente
descongelados, homogeneizados e deixados por cinco minutos à temperatura
ambiente (TA) onde, após esse período, se acrescentou 200 µL de clorofórmio.
Foram incubadas por 15 minutos a TA e centrifugadas por 15 minutos a velocidade
de 12.000g em centrifuga refrigerada (4°C). A fase superior da mistura (aquosa)
onde se encontrava o RNA foi transferida para um novo tubo eppendorf de 1,5 mL
36
contendo 500 µL de isopropanol que foi brevemente homogeneizado e incubado a
TA por 15 minutos para a precipitação do RNA. Após esse período. Foi feita nova
centrifugação a 12.000 x g durante 15 minutos a 4°C onde o sobrenadante foi
descartado e o precipitado de RNA (“pellet”) lavado uma vez com 1 mL de etanol
75% e uma vez com 1 mL de etanol absoluto. O RNA viral, depois de seco à TA, foi
suspenso em 20 µL de água livre de Rnase e foi armazenado a -70°C até o
momento de uso.
3.6 TRASCRIÇÃO REVERSA (RT)
O RNA extraído serviu de molde para a produção de uma cadeia
complementar de DNA (cDNA) utilizando o sistema de pré-amplificação Superscript
para RT-PCR (Invitrogen, SP, Brasil) com “primers” randômicos.
A transcrição reversa foi feita em duas etapas. Inicialmente em uma mistura
(Mistura 1) de 4 µL de água livre de Rnase com 1 µL de “primer” randômico onde se
acrescentou 5µL do RNA em estudo. Essa mistura foi incubada no termociclador
(Applied Biosystens modelo: GeneAmp PCR System 9700) a 70° C por 10 minutos
Na segunda etapa da RT se preparou outra mistura (Mistura 2) contendo 2,5
µL de 10X tampão RT- PCR (200mM tris-HCl pH 8.4 – 500 mM KCl), 2,5 µL de
25mM MgCl, 2,5 µL de 0,1 M DTT (dithiotreitol), 1,5 µL de 10mM dNTPs, 1,0 µL da
enzima (transcriptase reversa) Superscript II 50u/µL, 0,5 µL de Rnase OUT 40u/µL e
4,5 µL de água livre de Rnase perfazendo um total de 15µL por reação, que foram
acrescentados ao tubo que continha a Mistura 1 e incubado no termociclador, por 60
minutos a 42°C seguido de 15 minutos a 70°C.
O produto da transcrição reversa, agora designadas cDNA, foi conservado a
temperatura de -70°C até sua utilização.
3.7 REAÇÃO EM CADEIA DA POLIMERASE – PCR
Para cada 5,0 µL de cDNA a ser estudado preparou-se uma mistura de 5,0 µL
de 10X PCR tampão (200mM tris-HCl pH 8.4 – 500 mM KCl), 1,5 µL de 50mM
MgCl2, 1,0 µL de 10mM dNTPs, 1,0 µL de “primer” direto (25 pmol/µL), 1,0 µL de
37
“primer” reverso (25 pmol/µL), 0,5 µL de Taq DNA polimerase 5U/µL e 35,0 µL de
água livre de Rnase totalizando 50 µL por reação.
A reação da PCR foi processada em um termociclador da Applied Biosystens
modelo: GeneAmp PCR System 9700.
As temperaturas de anelamento e quantidade de ciclos da PCR utilizadas
foram baseadas nas padronizações dos autores, com o objetivo de implementar o
teste para as variantes da América do Sul.
3.8 ELETROFORESE EM GEL DE AGAROSE
Para a observação e análise dos resultados, 5 µL do produto amplificado por
PCR foi misturado a 1µL do tampão de arrasto (azul de Bromofenol 2,5%, TBE 10X
10% e Glicerol 50%) e aplicado em gel de agarose a 1% em TBE (Tris - Borato
0,089 M e EDTA 0,002M) para tamanho de banda esperado de 642 pb ou 614 pb e
gel a 2% em TBE para tamanhos esperados de 301 pb e 354 pb, contendo brometo
de etídio na concentração final de 0,5 µg/ mL. O gel foi submetido a corrente de 100
V imerso em solução de TBE. As bandas foram visualizadas e fotografadas em um
transiluminador de luz ultravioleta. Também foi incluído no gel de agarose um
padrão de peso molecular (Marcador 100 pb, Invitrogen) para identificação do
tamanho do produto.
Os produtos amplificados que apresentaram bandas na altura esperada
foram recuperados do gel e purificados para posterior seqüenciamento.
3.9 PURIFICAÇÃO DOS PRODUTOS DA PCR
Para a purificação dos produtos da PCR utilizou-se o Kit “Concert Rapid Gel
Extraction System” (Life Technology, SP, Brasil) seguindo as orientações do
fabricante.
A quantidade de 45 µL do produto da PCR foi homogeneizado em 15 µL de
tampão de arrasto e submetido à eletroforese em gel de agarose 1%, conforme
descrito anteriormente.
38
Após a eletroforese, o pedaço do gel que continha a banda desejada foi, por
visualização de luz ultravioleta, cortado com auxílio de bisturi.
A purificação (purificação por afinidade) se baseia na diluição do gel de
agarose para a recuperação do DNA e na afinidade do DNA com a sílica. Pesou-se
a banda cortada em um “eppendorf” de 1,5 mL e acrescentou-se o tampão de
solubilização L1 e sílica (providos pelo Kit “Concert Rapid Gel Extraction System”)
nas proporções de 30 µL e 1 µL por 10 mg de agarose respectivamente. A mistura
foi incubada por 20 minutos a 50°C em bloco térmico, sendo homogeneizada a cada
três minutos e centrifugados a 12.000 x g por trinta segundos. O sobrenadante foi
descartado e o sedimento foi novamente suspendido em tampão L1 com o mesmo
volume anteriormente utilizado, seguido de nova centrifugação a 12.000 x g. Na
etapa subseqüente, a sílica contendo o DNA foi suspensa e centrifugada (12.000 x g
/ trinta segundos) por duas vezes em tampão L2 (providos pelo Kit “Concert Rapid
Gel Extraction System”) na proporção de 30 µL / 10 mg de agarose onde em cada
etapa o sobrenadante foi descartado. O tubo contendo o pellet com sílica e DNA foi
deixado aberto, a TA, por um breve período, até que se evaporasse o resíduo de L2
e o DNA foi eluído da sílica mediante a adição de 20 µL de tampão TE (providos
pelo Kit “Concert Rapid Gel Extraction System”). Após homogeneização e incubação
à 50°C por cinco minuto, DNA purificado (sobrenadante) foi recuperado por
centrifugação de 12.000 x g por trinta segundos.
3.10 QUANTIFICAÇÃO DO DNA
Para a quantificação do DNA (produto da PCR purificado ou “amplicon”),
necessário para a reação de seqüenciamento, comparou-se a intensidade da banda
do material purificado com a de um marcador de massa molecular (Low Molecular
Mass Ladder, Invitrogen), em gel de agarose a 1% em TBE, preparado e visualizado
conforme descrito anteriormente.
3.11 SEQUENCIAMENTO CÍCLICO
39
O Kit utilizado para o seqüenciamento foi o “ABI Prism Big Dye Terminator v3.
1 Cycle Sequencing” (Applied Biosystems, SP, Brasil). O método se baseia na
incorporação de dideoxinucleotídeos com marcação fluorescente às cadeias de DNA
durante as reações cíclicas de desnaturação, anelamento e extensão.
Aproximadamente 60 - 80 ng de DNA foram acrescentadas à reação que
continha: 3,2 pmoles de “primers”, 2µL de BigDye – Tampão de seqüenciamento
para BigDye v 3.1 Cycle Sequencing e 2µL de tampão de seqüenciamento (provido
pelo Kit BigDye), completando o volume final de 10 µL com água livre de Rnase.
Para cada amostra foram feitas reações com “primer” direto e reverso em reações
individuais. Os “primers” para a reação foram os mesmos utilizados para a PCR
gene P (NJ P 102/744 e Ind P 179/193). A incubação das amostras foi de 40 ciclos a
94°C por 45 segundos, 50°C por 30 segundos e 60°C por 4 minutos feitas em
termociclador já descrito.
3.12 PURIFICAÇÃO DO PRODUTO DA REAÇÃO DE SEQÜENCIAMENTO
Para a purificação do produto da reação de seqüenciamento utilizou-se a
coluna de exclusão “Centri-Sep” (Princeton Separations, Applied Biosystems). A
resina contida na coluna foi hidratada por 1 hora a TA com 800 µL de água livre de
Rnase. Após hidratação, a coluna foi centrifugada a 750g por 2 minutos dentro de
um tubo coletor, para retirar o líquido intersticial. O volume total (10 µL) do produto
da reação de seqüenciamento foi cuidadosamente colocado no centro da coluna de
exclusão e esta, dentro de um tubo “eppendorf” de 1,5 mL que foi centrifugada a
750g por mais 2 minutos. Secou-se o produto recolhido no tubo “eppendorf” em
micro centrifuga a vácuo (“Speed-Vac”) por aproximadamente 45 minutos.
Para leitura das seqüências o produto foi reconstituído em 10 µL de
formamida, aquecido a 95 °C por 2 minutos e imediatamente transferido a um banho
de gelo.
3.13 LEITURA E ANÁLISE DE SEQÜÊNCIAS
40
As leituras das seqüências foram feita em seqüenciador automático de capilar
ABI-Prism 3100 Avant genetic Analyser (Applied Biosystems) seguindo instruções do
fabricante.
Os “cromatogramas” (leitura dos comprimentos de onda das seqüências
genômicas) foram editorados utilizando o programa BioEdit 5.0.6 -2005 (HALL,
1999). Esse programa fornece funções básicas para edição, alinhamento e análise
de múltiplas seqüências de ácidos nucléicos e proteínas.
O alinhamento das seqüências foi feito para comparação entre as diversas
seqüências obtidas no presente trabalho e entre as seqüências pré-existentes nos
bancos de dados disponíveis pela Internet (GenBank, 2005).
3.14 ANÁLISE FILOGENÉTICA
Análise filogenética tem sido utilizada para estudos de classificação e
taxonomia viral, onde se observa a porcentagem de homologia entre as seqüências
estudadas em uma dada região genômica.
A árvore filogenética foi construída por comparação entre as seqüências
parciais obtidas para o gene P e entre seqüências publicadas no banco de dados
disponível na Internet (GenBanK, 2005), através do cálculo e análise das distâncias
entre elas, utilizando-se o programa MEGA versão 3.0 (KUMAR et al., 2004).
3.15 DESENHO EXPERIMENTAL
3.15.1 Estudos preliminares
3.15.1.1 Estudos preliminares de detecção por RT – PCR de amostras de referência
As amostras de referência NJ CR /66, Ind 1 CR /72, Ind 2 Rib BR /79, Ind 3
AN BR /86 foram inicialmente testadas na RT – PCR utilizando-se as mesmas
condições de temperatura de anelamento e ciclos descritos pelos autores dos
“primers”. Utilizando-se os “primers” do gene P (NJ 102 / 744 e Ind 179 / 793), a
mistura foi submetida à temperatura de 94°C por três minutos e 40 ciclos a 93°C por
41
um minuto, 50°C por um minuto e 72°C por um minuto seguido por uma extensão
final a 72°C por cinco minutos. Quando se utilizaram os “primers” para o gene L (NJ
NS / NA e Ind IS / IA) a mistura foi submetida à temperatura de 94°C por três
minutos e 30 ciclos a 93°C por um minuto, 37°C por um minuto e 72°C por dois
minutos seguidos por uma extensão de cinco minutos a 72°C.
Como controle negativo da reação utilizou-se água livre da enzima Rnase
(Sigma) e para o controle da reação, o RNA e os “primers” providos pelo Kit utilizado
para a reação de transcrição reversa (Superscript –Invitrogen).
3.15.1.2 Estudos preliminares de detecção por RT – PCR de amostras de campo
Após os estudos preliminares com amostras de referência, 14 isolados do
Equador (epitélio de animais com suspeitas clínicas de enfermidades vesiculares)
foram testadas utilizando-se os “primers” para o gene P e gene L, nas mesmas
temperaturas de anelamento e quantidade de ciclos recomendados pelos autores
(descritos no item 3.15.1.1). As amostras de referência NJ CR /66 e Ind CR /72
foram novamente incluídas no ensaio.
As amostras também foram testadas para FA em PANAFTOSA segundo o
Manual de RT-PCR y seqüenciamento cíclico para estudos de epidemiologia
molecular do vírus da Febre Aftosa – “FIEBRE AFTOSA - Instrumentos moleculares
para caracterización viral” (MALIRAT; BERGMANN, 2003).
3.15.2 Ajuste de prova
Levando em consideração os resultados obtidos nos estudos preliminares,
propôs-se um ajuste de prova para a reação de RT - PCR feita com os “primers” que
flanqueiam o gene L. Com a finalidade de melhorar o desempenho da prova
evitando o aparecimento de bandas espúrias na amplificação, se propôs
modificações na temperatura de anelamento, aumentando-se as condições de
adstringência da reação. O aumento na quantidade de ciclos também foram
propostas na tentativa de suprir a perda da sensibilidade da reação acarretada pelo
aumento na temperatura.
42
Para as modificações na temperatura de anelamento se considerou as
Temperaturas de Fusão (TM) dos “primers”. A temperatura utilizada pelo autor é de
37°C com repetição de 30 vezes por ciclo (30 ciclos). Considerando-se que as TM
dos “primers” NS / NA tem a temperatura aproximada de 51 °C e dos ”primers” IS /
IA de 50°C e recomenda-se que a temperatura de anelamento seja de 5°C abaixo da
menor TM do par de “primers” (INNIS; GELFAND, 1990) propôs-se o seguinte
ensaio esquematizado no quadro 4:
QUADRO 4: Modificações propostas na temperatura de anelamento e quantidade de
ciclos, na tentativa de ajuste de prova utilizando-se “primers” que reconhecem o
gene L do VEV: NS / NA e IS / IA.
“Primers” NJ NS / NA
“Primers” Ind IS / IA
Gene L
Gene L
Gene L
Gene L
Gene L
Gene L
45°C
30
ciclos
45°C
40
ciclos
50°C
30
ciclos
45°C
30
ciclos
45°C
40
ciclos
50°C
30
ciclos
029 - 2
029 - 5
029 - 6
029- 19
029- 20
NJ CR / 66
Ind 1 CR / 72
Para esse novo ensaio foram selecionados cinco isolados do Equador e as
amostras de referência NJ CR/66 e Ind 1 CR/72. O isolado 029-6 e a amostra de
referência Ind 1 CR / 72 foram escolhidos pelos resultados anteriores terem sido,
respectivamente, falso negativo e resultados não consistente com os “primers” para
o gene L; O isolado 029-5 por ser o único de campo positivo para Ind e os isolados
029 – 2, 19, 20 e amostra NJ CR / 66 por já terem sido analisados e serviram de
parâmetro de comparação.
Como os resultados encontrados com a proposta de ajuste de prova para os
“primers” NS / NA e IS / IA não melhoraram o desempenho observado inicialmente e
induziam a resultados falsos positivos e falsos negativos, os “primers” NJ 102 / 744 e
Ind 179 / 793 foram escolhidos em continuação ao processo de implementação da
RT – PCR.
43
3.15.3 Estudo de detecção de amplificação de subtipos do VEV
As amostras de referência NJ Eq /85, Ind 1 ES /71, Ind 1 ES /78, Ind 1 CR
/79, Ind 2 Ranc BR /66, /86, Ind 3 Esp BR /77 foram testadas na RT – PCR
utilizando-se os “primers” NJ 102 / 744 e Ind 179 / 793 mantendo-se as mesmas
condições de prova descritas pelo autor. Também foram incluídas para teste de
reação cruzada, as amostras de referência de Febre Aftosa O1 Cps BR /58, A24
Cruz BR /55 além dos controles negativo e de células. As amostras NJ CR /66, Ind 1
CR /72, Ind 2 Rib BR /79 e Ind 3 A N BR anteriormente estudas foram
acrescentadas novamente a título de confirmação dos resultados.
3.16 SENSIBILIDADE ANALÍTICA
Diluições seriadas do RNA extraído do sobrenadante de monocamada de
células BHK 1 infectada com as amostras de referência NJ CR /66 com o título de
108 dose infectante em cultura de célula 50% / mL (TCID50 / mL) e Ind CR /72 com o
título de 108,25 TCID50 / mL foram utilizadas para determinar a sensibilidade analítica
da RT – PCR. A TCID50 foi obtida por técnica de virusneutralização seguindo
metodologia descrita por Alonso, 1986. O RNA foi mensurado em espectrofotômetro
(Beckman – Model 1098) no comprimento de onda de 260 nm.
4 RESULTADOS
O RNA genômico foi extraído com sucesso utilizando-se o TRIZOL, tanto dos
espécimes clínicos (epitélio) quanto de suspensões de vírus em passagem celular
(amostras de referência).
Concentrações ótimas dos reativos para a prova de RT - PCR foram
determinadas em estudos anteriores.
Com os “primers” utilizados para amplificação do gene P foram geradas
bandas dos tamanhos esperados de aproximadamente 642 pb para os “primers” NJ
e 614 pb para os “primers” do sorotipo Ind. Na amplificação do gene L as bandas
geradas foram de aproximadamente 301 pb para NJ e de 359 pb para Ind.
4.1 ESTUDOS PRELIMINARES
4.1.1 Estudos preliminares de detecção por RT – PCR de amostras de
referência (tabela 1 e figuras 5 e 6)
- Sorotipo NJ
•
A amostra NJ CR /66 apresentou banda (POS) na altura esperada de 642 pb
com os “primers” NJ 102 / 744 e de 301 pb com os “primers” NS / NA, ambos
referidos como específicos para sorotipo NJ pelos autores.
•
Não foram observadas bandas com os “primers” Ind 179 / 793 e IS / IA.
•
Não foram observadas bandas nas amostras Ind 1 CR/72, Ind 2 Rib BR /66,
Ind 3 A N BR /86 e controle negativo.
45
- Sorotipo Ind
•
Na amostra Ind 1 CR /72, se observou banda (POS) na altura esperada de
614 pb com os “primers” Ind 179 / 793, referidos pelos autores como
específicos para o sorotipo Ind.
•
No entanto, no caso dos “primers” IS / IA também referidos pelos autores
como específicos para o sorotipo Ind, resultados não consistentes (nc) foram
obtidos sendo observado banda em alguns ensaios e em outros não.
•
Não foram observadas bandas com os “primers” NJ 102 / 744 e NS / NA.
•
Não foram observadas bandas nas amostras Ind 2 Rib BR /66, Ind 3 A N BR
/86 e controle negativo, com nenhum dos primers testados.
Em todos os casos o controle do Kit apresentou banda positiva.
TABELA 1: Resultados dos estudos preliminares de detecção por RT – PCR em
amostras de referência para os sorotipos NJ e Ind. POS: observação de banda;
NEG: não observação de banda; nc: não consistente
Amostras Referência
NJ CR / 66
Ind CR / 72
Ind 2 Rib BR /79
Ind 3 A N BR /86
Controle Negativo
NJ
NJ 102 / 744
NS / NA
POS
POS
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
Ind
Ind 179 / 793
NEG
POS
NEG
NEG
NEG
IS / IA
NEG
Nc
NEG
NEG
NEG
46
M 1 2 3 4 5 6 7 8 9 10 11 12
600pb
FIGURA 5: Gel de agarose dos produtos obtidos por RT – PCR das amostras de
referência NJ CR /66 (colunas 1 e 7), Ind CR /72 (colunas 2 e 8), Ind 2 Rib BR /79
(colunas 3 e 9), Ind 3 A N BR /86 (colunas 4 e 10), controle negativo (colunas 5 e 11)
e controle do Kit (colunas 6 e 12) utilizando-se os “primers” para o gene P. Colunas
1 a 6: “primers” NJ 102 / 744; colunas 7 a 12: “primers” Ind 179 / 793.
M 1 2 3 4 5 6 7 8 9 10 11 12
M 1 2 3 4 5 6 7 8 9 10 11 12
300pb
FIGURA 6: Gel de agarose dos produtos obtidos por RT – PCR das amostras de
referência NJ CR /66 (colunas 1 e 7), Ind CR /72 (colunas 2 e 8), Ind 2 Rib BR /79
(colunas 3 e 9), Ind 3 A N BR /86 (colunas 4 e 10), controle negativo (colunas 5 e 11)
e controle do Kit (colunas 6 e 12) utilizando-se os “primers” para o gene L. Colunas 1
a 6: “primers” NJ NS / NA; colunas 7 a 12: “primers” Ind IS / IA.
47
4.1.2 Estudos preliminares de detecção por RT – PCR de amostras de campo
Os resultados obtidos na RT – PCR para ambos os “primers” são mostrados
no tabela 2 onde se compara com os resultados obtidos por FC50.
- Sorotipo NJ
•
Na detecção do VEV sorotipo NJ pela RT - PCR, utilizando-se os “primers” NJ
102 / 744 e NS / NA foram observadas bandas (POS) para os isolados
caracterizados como NJ por FC50: 029 – 2, 3, 8, 9, 10, 11, 18, 19, 20 e 33 e
na amostra NJ CR /66.
•
No isolado 029-6, observou-se banda com os “primers” NJ 102 / 744, porém
não foi detectada amplificação com os “primers” NS / NA.
•
Não foi observada banda (NEG) nos isolados 029-4, 5 e 12 e amostra Ind CR
/72 com nenhum dos “primers” para NJ.
- Sorotipo Ind
•
Quando o ensaio foi feito para a detecção de Ind, bandas foram observadas
no isolado 029-5 e na amostra Ind 1 CR /72 para os “primers” Ind 179 / 793.
•
Com os “primers” IS / IA bandas foram observadas no isolado 029-5, mas
resultados não consistentes (nc) continuaram a aparecer com a amostra Ind 1
CR /72, visualizando-se banda em alguns ensaios e em outros não.
•
Não se observou banda nos isolados 029 – 2, 3, 4, 6, 8, 9, 10, 11, 12, 18, 19,
20 e 33 e na amostra NJ CR /66 com nenhum dos “primers” para Ind.
48
TABELA 2: Resultado dos estudos de amplificação por RT – PCR dos isolados do
Equador e amostras de referência utilizando-se “primers” que flanqueiam diferentes
genes do genoma do VEV nas condições de prova recomendadas por seus autores,
em comparação com os resultados obtidos por FC50. POS: observação de banda;
NEG: não observação de banda; nc: não consistente; nr: não realizado.
FC50
Material
estudado
029 – 2
029 – 3
029 – 4
029 – 5
029 – 6
029 – 8
029 – 9
029 – 10
029 – 11
029 – 12
029 – 18
029 – 19
029 – 20
029 – 33
NJ CR /66
Ind1 CR /72
Equador
NJ
NJ
NJ
Ind
NJ
NJ
NJ
NJ
NJ
NJ
NJ
NJ
NJ
NJ
nr
nr
"Primer" NJ
Gene P
Gene L
PANAFTOSA
NJ 102 / 744 NS / NA
NJ
POS
POS
NJ
POS
POS
NEG
NEG
NEG
Ind
NEG
NEG
NJ
POS
NEG
nr
POS
POS
nr
POS
POS
NJ
POS
POS
nr
POS
POS
NEG
NEG
NEG
NJ
POS
POS
NJ
POS
POS
NJ
POS
POS
NJ
POS
POS
NJ
POS
POS
Ind 1
NEG
NEG
"Primer" Ind
Gene P
Gene L
Ind 179 / 793
IS / IA
NEG
NEG
NEG
NEG
NEG
NEG
POS
POS
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
NEG
POS
nc
Exemplos das amplificações referidas são mostrados na FIGURA 7. Pode-se
observar bandas geradas por amplificação do cDNA viral por RT – PCR para
detecção do VEV NJ utilizando-se os “primers” que reconhecem o gene P: NJ 102 /
744 (FIGURA 7 – A) e que reconhecem o gene L: NS / NA (FIGURA 7 – B). Para os
“primers” que reconhecem o gene P, os produtos da RT - PCR apresentam bandas
do tamanho esperado somente para isolados caracterizados na FC50 como NJ (no
exemplo os isolados 029-3, 6, 9, 10, 33 e amostra NJ CR /66).
Utilizando-se os “primers” para o reconhecimento do gene L, o isolado 029-6
(tipificado NJ por FC50 e em amplificação pelos “primers” para o gene P , específicos
para o sorotipo NJ) resulta negativo (coluna 4 – FIGURA 7 – B). A falha na
amplificação dessa amostra reforça a observação de que esses “primers” seriam
menos adequados para a detecção do VEV por RT – PCR do que os que
49
reconhecem o gene P. Adicionalmente, pode-se observar bandas espúrias (de
tamanhos diferentes do esperado) na reação de RT-PCR utilizando esses ”primers” .
A: “primers” NJ 102 / 744
B: “Primers” NJ NS / NA
M 1 2 3 M4 1 5 2 63 47 5 8 69 7108 M9 10 M
M 1 2 3 4 5 6 7 8 9 10 M
M 1 2 3 4 5 6 7 8 9 10 M
300 pb
600 pb
FIGURA 7: Gel de agarose dos produtos obtidos por RT – PCR dos isolados do
Equador e amostra de referência. Colunas 1 a 7 correspondem aos isolados 029-3,
4, 5, 6, 9, 10, 33; a coluna 8 é o controle negativo (água), a coluna 9 é a amostra de
referência NJ CR /66 e a coluna 10, o controle do Kit. M é o marcador de peso
molecular de 100 pb.
As amostras resultaram todas negativas por RT-PCR para FA quando se
utilizou o Manual de y seqüenciamento cíclico para estudos de epidemiologia
molecular do vírus da Febre Aftosa – “FIEBRE AFTOSA - Instrumentos moleculares
para caracterización viral” (MALIRAT; BERGMANN, 2003),
4.2 AJUSTE DE PROVA
Nos resultados obtidos (TABELA 3) observa-se que nas condições
recomendadas pelo autor, a amostra Ind 1 CR /72 continuou a apresentar resultados
50
não consistente (nc) com os “primers” para o gene L (IS / IA), mesmo nas diferentes
condições de temperatura e ciclos testados, chegando a registrar resultados
negativos.
O espécime 029-6 que por FC50 e PCR com “primers” para o gene P foi
diagnosticado como NJ, não apresentou banda com os “primers” NJ para o gene L
(NS / NA) nas condições recomendadas pelo autor (37°C com 30 ciclos). Somente
quando se aumentou o número de ciclos para 40 e a temperatura para 45°C esse
isolado foi amplificado. No entanto, nessa mesma temperatura e quantidade de
ciclos, foi também amplificado para os “primers” Ind para o gene L (IS / IA).
Os outros isolados NJ apresentaram resultados positivos inclusive em
condições de maior temperatura de pelo menos até 45°C e de 50°C para a amostra
de referência NJ CR /66.
TABELA 3: Resultados de RT – PCR observados no ajuste de prova proposto para
os “primers” NS / NA e IS / IA que flanqueiam o gene L do VEV. POS: observação
de banda; NEG: não observação de banda; nc: não consistente.
Material
Estudado
“Primers” NJ
“Primers” NJ
“Primers” Ind
“Primers” Ind
NJ 102/744
NS / NA
Ind 179/793
IS / IA
Gene P
50°C
40 ciclos
Gene L
37°C
45°C
45°C
Gene P
50°C
30 ciclos 30 ciclos 40 ciclos 30 ciclos
50°C
40 ciclos
Gene L
37°C
45°C
45°C
50°C
30 ciclos 30 ciclos 40 ciclos 30 ciclos
029 – 2
POS
POS
POS
POS
NEG
NEG
NEG
NEG
NEG
NEG
029 – 5
NEG
NEG
NEG
NEG
NEG
POS
POS
POS
POS
POS
029 – 6
POS
NEG
NEG
POS
NEG
NEG
NEG
NEG
POS
NEG
029- 19
POS
POS
POS
POS
NEG
NEG
NEG
NEG
NEG
NEG
029- 20
POS
POS
POS
POS
NEG
NEG
NEG
NEG
NEG
NEG
NJ CR / 66
POS
POS
POS
POS
POS
NEG
NEG
NEG
NEG
NEG
Ind CR / 72
NEG
NEG
NEG
NEG
NEG
POS
nc
NEG
nc
NEG
Na figura 8 podemos observar o resultado do ajuste de prova para o isolado
029-6. Resultado positivo utilizando-se os “primers” NJ 102 / 744 pode ser
observado com banda na altura esperada de 642 pb com temperatura de
anelamento de 50°C por 40 ciclos (coluna 1). Resultado negativo utilizando-se os
“primers” NS / NA com a temperatura de anelamento a 37°C por 30 ciclos se
observa na coluna 2 apresentando resultado positivo (coluna 3) com esses mesmos
51
“primers” com banda na altura esperada de 301pb com a temperatura de
anelamento de 45°C por 40 ciclos.
Nessa mesma tabela podemos observar os resultados utilizando-se os
“primers” para VEV Ind. Resultado negativo foi obtido utilizando-se os “primers” Ind
179 / 793 na temperatura de 50°C por 40 ciclos (coluna 4) e na coluna 5 com os
“primers” IS / IA na temperatura de 37°C por 30 ciclos. Na coluna 6 aparece como
positivo com banda na altura de 359 pb apareceram utilizando-se os “primers” IS / IA
na temperatura de 45°C por 40 ciclos.
M 1 2 3 4 5
600 pb
6 M
300 pb
FIGURA 8: Gel de agarose dos produtos obtidos por RT – PCR para detecção do
VEV do isolado do Equador 029-6 no ajuste de prova proposto. Coluna 1: “primers”
NJ 102 / 744 a 50°C – 40 ciclos. Colunas 2 e 3: “primers” NJ NS / NA a 37°C – 30
ciclos e 45 °C – 40 ciclos respectivamente. Coluna 4: “primers” Ind 179 / 793 a 50°C
– 40 ciclos. Colunas 5 e 6: “primers” Ind IS / IA a 37°C – 30 ciclos e 45 °C – 40 ciclos
respectivamente. M é o marcador de peso molecular de 100 pb.
4.3 ESTUDO DE DETECÇÃO DE AMPLIFICAÇÃO DE SUBTIPOS DO VEV
52
Os seguintes resultados foram obtidos e que estão resumidos na tabela 4.
•
As amostras NJ CR /66 e NJ Eq / 85 apresentaram banda (POS) na altura
esperada de 642 pb com os “primers” NJ 102 / 744.
•
Nas amostras Ind 1 CR /72, Ind 1 ES / 71, Ind 1 ES / 78, e Ind 1 CR /79
foram observadas bandas (POS) na altura esperada de 614 pb com os
“primers” Ind 179 / 793.
•
Não foram observadas bandas nas amostras Ind 2 Ranc BR /66, Ind 2 Rib BR
/79, Ind 3 A N BR /86, Ind 3 Esp BR /77.
•
Resultados negativos foram registrados com os dois pares de “primers” para
as amostras do vírus da Febre Aftosa testadas, O1 Cps BR /58, e A24 Cruz
BR /55.
•
Não foram registradas bandas com o controle negativo e controle de célula
com nenhum dos dois “primers” e o controle do Kit apresentou banda positiva.
TABELA 4: Resultados observados no teste de RT – PCR para as amostras de
referência e controles utilizando-se “primers” NJ 102 / 744 e Ind 179 / 793. POS:
observação de banda; NEG: não observação de banda.
Amostras de Referência PCR Gene P PCR Gene P
e controles
NJ
Ind
NJ CR /66
POS
NEG
NJ Eq /85
POS
NEG
Ind 1 CR /72
NEG
POS
Ind 1 ES /71
NEG
POS
Ind 1 ES /78
NEG
POS
Ind 1 CR /79
NEG
POS
Ind 2 Ranc BR /66
NEG
NEG
Ind 2 Rib BR /79
NEG
NEG
Ind 3 A N BR /86
NEG
NEG
Ind 3 Esp BR /77
NEG
NEG
O1 Cps BR /58
NEG
NEG
A24 Cruz BR /55
NEG
NEG
Controle Negativo
NEG
NEG
Controle BHK – 21
NEG
NEG
53
4.4 SENSIBILIDADE ANALÍTICA
Diluições de 10 -1até 10 -5 da cepa NJ CR /66 foram amplificada com sucesso
e a diluição 10 -6 não pode ser visualizada (FIGURA 9).
M 1 2 3 4 5 6 7 8 9
600 pb
FIGURA 9: Diluição seriada do RNA extraído de células BHK – 21 infectada com
VEV NJ CR /66. Coluna 1: 108 TCID50 / mL, coluna 2: diluição 10-1, coluna 3: diluição
10-2, coluna 4: diluição 10-3, coluna 5: diluição 10-4, coluna 6: 10-5, coluna 7: diluição
10-6, coluna 8, 10-7, coluna 9: controle negativo (água).
No teste de sensibilidade para a amostra de referência Ind CR /72 diluições
de 10 -1 até 10 -3 puderam ser observadas, não sendo observadas bandas da diluição
10-4 em diante (FIGURA 10).
54
M12 34 56 7 89
600pb
FIGURA 10: Diluição seriada do RNA extraído de células BHK – 21 infectada com
VEV Ind CR /72. Coluna 1: 108,25 TCID50 / mL, coluna 2: diluição 10-1, coluna 3:
diluição 10-2, coluna 4: diluição 10-3, coluna 5: diluição 10-4, coluna 6: 10-5, coluna 7:
diluição 10-6, coluna 8, 10-7, coluna 9: controle negativo (água).
4.5 SEQÜENCIAMENTO
Foram seqüenciadas as amostras amplificadas por RT – PCR com os
“primers” P. Cada seqüência foi determinada em reações individuais com os dois
“primers” (direto e reverso) para cada sorotipo e foi repetida duas vezes para a
confirmação dos dados. Um total de 18 seqüências parciais do gene da
fofosproteína (gene P) foi obtida.
•
Amostras seqüenciadas utilizando-se os “primers” NJ 102 / 744: isolados do
Equador 029-2, 3, 6, 8, 9, 10, 11, 18, 19, 20 e 33 e as amostras NJ CR /66 e
NJ Eq /85.
•
Amostras seqüenciadas utilizando-se os “primers” Ind 179 / 793: o isolado do
Equador 029-5 e as amostras Ind CR /72, Ind ES /71, Ind ES /78, e Ind CR
/79.
Esses fragmentos foram utilizados para o alinhamento entre eles e entre as
seqüências publicadas no GeneBank.
55
O número de acesso das seqüências obtidas no GenBank para o alinhamento
podem ser observadas no Quadro 5. Seqüências parciais do gene P utilizadas
foram as publicadas por RODRIGUEZ et al. (2002). Utilizou-se sete seqüências do
sorotipo New Jersey, cinco de focos ocorridos no México nos anos de 1986, 1989,
1996 e 1997 com números de acesso AF252230, AF252232, AF252234, AF252236
e AF252238 e dois dos Estados Unidos dos anos de 1995 e 1997, números de
acesso AF252233 e AF252253. Para Ind 1 foram selecionadas 11 seqüências
parciais sendo uma de um foco ocorrido no México em 1997, número de acesso
AF252217 e dez de focos ocorridos nos Estados Unidos nos anos de 1997 e 1998
com números de acesso AF252218, AF252219, AF252220, AF252221, AF252222,
AF252223, AF252224, AF252225, AF252226, AF252227.
Também se utilizou as seqüências completas do gene P publicada por Bilsel
et al. (1990) com número de acesso M31868 para o sorotipo NJ. Para o sorotipo Ind,
a seqüência completa do gene P utilizada foi a com número de acesso X04453 Ind
publicada por Vandepol e Holland (1986).
QUADRO 5; Seqüências do GenBank utilizadas para alinhamento e o cálculo e
análise das distâncias genéticas em comparação com as seqüências obtidas nesse
trabalho. A: Seqüências para o sorotipo NJ. B: Seqüências para o sorotipo Ind 1.
B
Sorotipo Indiana
A
Seqüência completa do gene P
Sorotipo New Jersey
N° Acesso
Origem
Seqüência completa do gene P
X04453
Estados Unidos (EU)
N° Acesso
Origem
M31868
Estados Unidos (EU)
Seqüência parcial do gene P
N° Acesso
Origem
AF252217
México (Mex)
N° Acesso
Origem
AF252218
Estados Unidos (EUA)
AF252230
México (Mex)
AF252219
Estados Unidos (EUA)
AF252232
México (Mex)
AF252220
Estados Unidos (EUA)
AF252234
México (Mex)
AF252221
Estados Unidos (EUA)
AF252236
México (Mex)
AF252222
Estados Unidos (EUA)
AF252238
México (Mex)
AF252223
Estados Unidos (EUA)
AF252233
Estados Unidos (EUA)
AF252224
Estados Unidos (EUA)
AF252253
Estados Unidos (EUA)
AF252225
Estados Unidos (EUA)
AF252226
Estados Unidos (EUA)
AF252227
Estados Unidos (EUA)
Seqüência parcial do gene P
56
Todas as seqüências foram editoradas, analisadas e interpretadas com
sucesso utilizando o programa BioEdit 5.0.6. Nenhuma inserção ou deleção foi
observada em comparação com as seqüências publicadas e as mutações foram
pontuais.
As seqüências obtidas nesse trabalho abrangem fragmentos entre os
nucleotídeos 110 e 720 do gene P para NJ e entre os nucleotídeos 190 e 680 do
gene P Ind aproximadamente (FIGURA 11 e 12).
57
FIGURA 11: Alinhamento entre as seqüências parciais do gene P do VEV obtidas
nesse trabalho utilizando-se os “primers” 102 / 744 para NJ com seqüências
publicadas no GeneBank (programa de editoração BioEdit 5.0.6).
58
FIGURA 11: Continuação
59
FIGURA 11: Continuação
60
FIGURA 11: Continuação
61
FIGURA 12: Alinhamento entre as seqüências parciais do gene P do VEV obtidas
nesse trabalho utilizando-se os “primers” 179 / 793 para Ind com seqüências
publicadas no GeneBank (programa de editoração BioEdit 5.0.6).
62
FIGURA 12: Continuação.
63
FIGURA 12: Continuação.
64
FIGURA 12: Continuação.
65
O cálculo e análise das distâncias genéticas na região estudada foram
utilizados para a construção de uma árvore filogenética. Na Tabela 5 temos o cálculo
entre as distâncias genéticas (em percentagem) entre as seqüências do gene P do
VEV obtidas nesse trabalho e as publicadas no GeneBank utilizando-se o programa
MEGA versão 3.0. Constata-se que os sorotipos NJ e Ind podem ser facilmente
distinguidos, separando-se nitidamente os dois grupos que diferenciam entre si de
aproximadamente 54 % (destaque em verde), confirmada na topologia da árvore
(FIGURA 13). A topologia da árvore também mostra claramente dois grupos
genéticos distintos.
Nessa tabela também podemos observar no destaque em rosa, que dentro
dos sorotipos Ind a diferença foi de no máximo 21%. Entre os NJ (destaque em
amarelo), valores menores de 23% foram encontrados entre os isolados do Equador
e amostras de referência e do GenBank. Entre os isolados do Equador e amostra de
referência NJ Eq/85 se observa homologia de pelo menos 94% (destaque em
amarelo, negrito).
66
TABELA 5: Cálculo das distâncias genéticas entre as seqüências parciais do gene P
do VEV obtidas nesse trabalho e as publicadas no GeneBank utilizando-se o
programa MEGA versão 3.0. Seqüências NJ: 1 a 19; Seqüências Ind: 20 a 36.
Identificação
1
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
M 31868 NJ
2
NJ CR/66
3
AF252230 NJ
17
2 17
4
AF252232 NJ
2 17 3
5
AF252233 NJ
3 19 4
3
6
AF252234 NJ
3 16 4
4
5
7
AF252253 NJ
3 19 4
3
0
8
NJ Eq /85
5
20 10 21 20 22 20 22
9
029 - 2
18 9 19 19 21 18 20 4
10
029 - 3
21 12 22 21 23 21 23 2
6
11
029 - 6
21 12 21 21 23 21 22 3
5
2
12
029 - 8
22 12 22 21 23 21 23 2
6
0
3
13
029 - 9
21 12 22 21 23 21 23 2
6
0
2
0
14
029 - 10
22 12 22 21 23 22 23 2
6
1
3
0
1
15
029 - 11
21 12 22 21 23 21 23 2
6
0
2
0
0
1
16
029 - 18
18 9 19 19 21 18 20 4
1
6
5
6
6
6
6
17
029 - 19
21 12 22 21 23 21 23 2
6
0
2
0
0
1
0
6
18
029 - 20
21 12 22 21 23 21 23 2
6
0
2
0
0
1
0
6
0
19
029 - 33
22 12 22 21 23 21 23 2
6
0
3
1
0
1
0
6
0
20
X 04453 Ind
53 52 54 53 53 52 53 55 54 56 55 55 56 56 56 54 56 56 56
21
Ind CR /72
52 51 52 52 51 52 51 51 52 51 51 52 51 52 51 51 51 51 52 20
22
Ind CR /79
55 54 56 55 55 54 55 55 55 55 55 55 55 56 55 55 55 55 56 15 20
23
Ind ES /78
54 53 54 54 54 53 54 55 54 56 55 55 56 56 56 54 56 56 56 5 21 15
24
Ind ES /71
55 52 55 55 55 53 55 55 54 56 55 55 56 56 56 54 56 56 56 5 20 14 1
0
25
AF252217 Ind 53 51 54 54 53 52 54 54 53 54 54 54 54 54 54 52 54 54 55 4 19 14 5
4
26
AF252218 Ind 54 51 54 54 54 53 54 54 53 55 54 54 55 55 55 53 55 55 55 5 19 14 5
4
1
27
AF252219 Ind 54 51 54 54 54 53 54 54 53 55 54 54 55 55 55 53 55 55 55 5 19 14 5
4
1
1
28
AF252220 Ind 54 51 54 54 54 53 54 54 53 55 54 54 55 55 55 53 55 55 55 5 19 15 6
5
1
1
0
29
AF252221 Ind 53 51 54 54 53 52 54 54 53 54 54 54 54 54 54 52 54 54 55 4 19 14 5
4
1
0
0
1
30
AF252222 Ind 54 51 54 54 54 53 54 54 53 55 54 54 55 55 55 53 55 55 55 5 19 14 5
4
1
1
0
0
0
31
AF252223 Ind 54 51 54 54 54 53 54 54 53 54 54 54 54 54 54 52 54 54 55 5 19 14 6
5
1
1
0
1
1
0
32
AF252224 Ind 54 51 54 54 54 53 54 54 53 55 54 54 55 55 55 53 55 55 55 5 19 14 5
4
1
0
1
1
0
1
1
33
AF252225 Ind 54 51 54 54 54 53 54 54 53 55 54 54 55 55 55 53 55 55 55 5 19 14 5
4
1
1
1
1
0
1
1
1
34
AF252226 Ind 53 51 54 54 53 52 54 54 53 54 54 54 54 54 54 52 54 54 55 4 19 13 5
4
3
3
3
3
3
3
3
3
35
AF252227 Ind 54 52 54 54 54 53 54 54 53 55 54 55 55 55 55 53 55 55 55 5 19 15 6
5
1
0
1
1
1
1
1
0
1
3
7
5
5
5
6
5
5
6
5
5
5
36
029 - 5
52 51 53 52 53 52 52 54 53 55 54 55 55 55 55 53 55 55 55 6 19 14 7
3
6
67
029 20
029 33
029 19
029 11
029 9
029 3
029 8
029 10
NJEq85
0.04
029 6
029 2
0.03
029 18
0.04
NJCR66
0.16
AF252234NJ Mexico
AF252230NJ Mexico
0.07
M31868 NJ EUA
AF252232NJ Mexico
AF252233NJ EUA
AF252253NJ EUA
0.11
IndCR72
0.08
0.15
IndCR79
0.03
029 5
0.03
IndES78
IndES71
0.04
0.02
X04453 Ind EUA
AF252226IND EUA
AF252217IND Mexico
AF252219IND EUA
AF252222IND EUA
AF252220IND EUA
AF252223IND EUA
AF252225IND EUA
AF252221IND EUA
AF252218IND EUA
AF252224IND EUA
AF252227IND EUA
0.05
FIGURA 13: Árvore filogenética (Neighbor-joining) baseado na seqüência parcial do
gene P do VEV NJ e Ind. Vírus com seqüência total do gene P em destaque. A
árvore foi obtida através do programa Mega 2.01.
5 DISCUSSÃO
A EV é uma enfermidade de reconhecida importância em saúde animal com
graves conseqüências sócio–econômicas (MASON, 1978). Sua presença é um fator
limitante para o comércio internacional de animais e seus subprodutos (HAYEK et
al.,1998). Além do prejuízo na produtividade do bovino, assume um papel importante
para os programas de saúde animal por ser indistinguível clinicamente da Febre
Aftosa, em suínos e bovinos (FERRIS; DONALDSON, 1988).
Até o momento, poucos trabalhos de pesquisas têm sido desenvolvidos na
área de diagnóstico do VEV por RT – PCR (RODRIGUEZ et al., 1993, NÜÑEZ et al.,
1998, HOFNER et al., 1994, RASMUSSEN el al, 2005). O presente estudo foi
utilizado para o desenvolvimento e implementação dessa técnica o que permitiu a
detecção e diferenciação dos dois principais sorotipos do VEV: NJ e Ind1 utilizandose variantes da América do Sul.
A extração por TRIZOL mostrou ser um procedimento rápido e simples para a
obtenção de RNA de boa qualidade de amostras em suspensão celular e
principalmente em diferentes tipos de tecido epitelial. A grande vantagem do teste de
detecção viral por RT – PCR desenvolvido no presente trabalho está no fato de se
agilizar o diagnóstico para EV, utilizando-se um método que detecta o RNA
diretamente de epitélio, não havendo necessidade de passagens em células,
processo que demanda tempo retardando o diagnóstico conclusivo e dificultando
com isso respostas e medidas sanitárias direcionadas.
A diferença de resultados observados nos isolados 029-4 e 029-12 que foram
diagnosticados como NJ em prova de FC50 realizada no Equador e negativos por
esta mesma técnica em PANAFTOSA e também por RT – PCR, pode ser explicado
pela má conservação do material ou problemas ocorridos durante o transporte
69
ao ser enviado para diagnóstico em nosso laboratório.
Com o propósito de se evitar a etapa de quantificação do RNA, agilizando-se
a resposta diagnóstica utilizou-se nesse estudo a quantidade de 5 µL de RNA para
todas as reações baseados em resultados obtidos por RODRIGUEZ et al. (1993)
que testaram 1, 5 e 10 µL de RNA em diferentes ensaios obtendo-se sempre os
mesmos resultados com quaisquer volume.
Para a implementação da técnica de RT – PCR utilizou-se um total de 14
isolados do Equador e 12 amostras de vírus de referência. Os resultados indicaram
homologia entre os dados obtidos por RT – PCR utilizando - se os “primers” que
flanqueiam o gene P com os resultados da FC50, tanto para NJ quanto para Ind,
apesar de muitos isolados terem sido processados por RT – PCR alguns meses
depois da FC50 ; além de proporcionarem excelentes bandas que puderam ser
recuperadas e seqüenciadas e que permitiu a confirmação do agente.
A eleição dos “primers” para o gene P para a implementação da técnica de
RT – PCR permitiu a visualização de bandas do tamanho de 642 pb para NJ e 614
para Ind 1 conforme descrito por RODRIGUEZ et al. (1993). Não foram observadas
bandas para os subtipos Ind 2 e Ind 3. Apesar da importância na detecção desses
dois subtipos, o sorotipo NJ e o subtipo Ind 1 são os de maior importância para o
diagnóstico na América do Sul. Mais estudos com diferentes amostras devem ser
realizados, variando-se inclusive as condições de ciclagem e temperatura utilizando
dados descritos na literatura quando se utiliza “primers” degenerados ou
selecionando-se novos “primers”.
A necessidade de continuação dos estudos para a melhoria da sensibilidade
na detecção do sorotipo Ind foi corroborada pelos resultados obtidos no teste de
sensibilidade analítica. O teste de RT – PCR utilizando-se o “primer” NJ 102 / 744
mostrou sensibilidade comparável com a descrita na literatura onde pôde se detectar
a quantidade de até 250 TCID50 do VEV sorotipo NJ. No entanto para o “primer” Ind
179 / 793 essa sensibilidade foi de 4.445 TCID50 para o subtipo Ind 1 não detectando
os subtipos Ind 2 e Ind 3.
Os resultados obtidos com as amostras de FA O Cps BR / 58 e A24 Cruz BR
/55 confirmam a especificidade dos “primers” importante para o diagnóstico
diferencial.
Nos ensaios para teste com os “primer” NS / NA para reconhecimento do VEV
tipo NJ e o “primer” IS / IA para Ind os resultados não foram conclusivos. O
70
espécime 029–6, diagnosticado como NJ por FC50 e RT – PCR gene P e confirmado
por seqüenciamento, não apresentou banda (falso negativo) ao se utilizar o “primer”
para gene L NS / NA. As modificações propostas na temperatura de anelamento e
quantidade de ciclos para detecção do NJ fizeram com que o espécime 029-6 desse
resultado positivo somente quando se elevou a temperatura de 37°C para 45 °C
acrescido dez ciclos na reação. Porém nessas condições também foi observado
banda (falso positivo) quando usado os “primers” Ind.
Para os “primers” IS / IA resultados não consistente foram observados quando
se testou a amostra de referência Ind 1 CR / 72 onde em diversas repetições, nas
mesmas condições de prova, esse material por vezes aparecia como positivo e por
vezes negativo.
Os resultados falso positivo e falso negativo encontrado nesse ensaio para o
gene L podem ser explicados pelo fato dos autores terem padronizado o uso desses
”primers” em uma reação de Multiplex PCR objetivando a amplificação do RNA de
três agentes etiológicos que causam importantes enfermidades vesiculares em
suínos: Febre Aftosa, Enfermidade Vesicular Suína e Estomatite Vesicular. Nesse
experimento, diversos “primers” foram utilizados para a amplificação de RNA dessas
enfermidades em uma única reação. A temperatura de anelamento proposta pelo
autor, de 37°C, proporciona grande sensibilidade à prova, mas diminui a sua
especificidade. Além do que, o referido trabalho utilizou para a reação de transcrição
reversa o “primer” NA para NJ e o “primer” IA para Ind. O uso de “primer” reverso
específico pode também melhorar a qualidade do produto amplificado. O autor não
utilizou isolados para testar a prova, apenas sobrenadantes obtidos através de
inoculação dos vírus NJ e Ind, em monocamada de células BHK-21. NÜÑEZ et al.,
(1998) já especulava a necessidade de estudos aprofundados para se testar a
sensibilidade em isolados (amostras de campo) além de necessidade de
experiências utilizando os “primers” NS / NA e IS / IA em outras espécies animais
diferentemente de suínos.
A árvore filogenética observada na Figura 13 foi obtida da seqüência parcial
do gene P. A topologia da árvore mostra a correlação entre o comportamento
sorológico e parentesco genético das variantes onde se observa nitidamente a
divisão das seqüências discriminando os dois grupos distintos, NJ e Ind1,
corroborando os resultados obtidos por RT – PCR.
71
A seqüência nucleotídica do gene P tem sido utilizada para as análise
filogenéticas do VEV. Essas análises sugerem que o fator geográfico tem maior
influência na evolução deste vírus do que o fator temporal (NICHOL et al., 1989)
sendo o fator ecológico mais influente na evolução do VEV em locais onde ocorre de
forma endêmica do que a seleção imunológica (RODRIGUEZ et al., 1996). Esse fato
também foi observado no presente trabalho onde as variantes do surto de campo do
Equador mostram homologia de pelo menos 94% com a amostra do Equador (NJ Eq
/ 85) isolado à 20 anos atrás. Por se manterem muito tempo com poucas variações,
as linhagens genéticas, dentro de áreas geográficas definidas permitem o uso de
análise filogenética para especular a posição geográfica e em alguns casos a zona
ecológica da qual o vírus se originou (RODRIGUEZ et al., 1996).
Três domínios funcionais têm sido descritos para a proteína P do VEV.
Domínio 1 (nucleotídeos 1 a 411) que é responsável pela associação da proteína P
com a proteína L, Domínio II (nucleotídeos 687 a 726) essencial para o processo de
transcrição e o Domínio III (nucleotídeos 729 a 795) que liga a proteína P à proteína
N – RNA. A seqüência dos aminoácidos da proteína P é muito variável indicando
uma grande pressão evolucionária nessa proteína. A maior parte dessa variação
está na região hipervariável da proteína localizada entre os nucleotídeos 459 e 615
(RODRIGUEZ et al., 2002; BILSEL et al., 1990)
Os resultados obtidos no presente trabalho nos permitem utilizar a RT - PCR
para a detecção do VEV tanto de isolados quando de suspensão virulentas obtidas
por inoculação do vírus em monocamada de células. A implementação do RT – PCR
permitirá a rápida detecção do VEV em auxílio às respostas de episódios de
enfermidades vesiculares.
A padronização feita com “primers” que reconhecem o gene que codifica a
proteína P permite que o produto da reação seja seqüenciado e utilizado para
estudos filogenéticos. Isso permitirá, em continuação a esse trabalho, a formação de
um banco de dados com cepas representantes de focos ocorridos na América do Sul
e a análise filogenética auxiliará a entender os mecanismos e fatores que
determinam os focos nessa região.
6 CONCLUSÃO
A técnica da RT – PCR mostrou ser uma ferramenta rápida, sensível e
específica que pode ser usada como um método alternativo na detecção do vírus,
com a vantagem da não exigência de um laboratório de segurança para a sua
realização, uma vez que o vírus é inativado com fenol-clorofórmio. Como vantagem
adicional, temos que o RNA pode ser extraído de suspensões celulares infectadas
pelo VEV e principalmente, diretamente de amostras clínicas (epitélio) agilizando a
resposta diagnóstica. A RT – PCR provém ainda DNA suficiente para o
seqüenciamento e seus dados podem ser utilizados em análises filogenéticas para
futuros estudos epidemiológicos.
Mais estudos são necessários para assegurar a detecção de um maior
número de variantes.
7 OBRAS CITADAS
ALLENDE, R.; SEPÚLVEDA, L. M.; ALONSO, A.; RANGEL FILHO, F.B. An enzymelinked immunosorbent assay for the detection of vesicular stomatitis virus antibodies.
Preventive Veterinary Medicine, v.14, p. 293-301, 1992.
ALONSO, F. A. Laboratório de referência par alas Américas. Diagnostico de
enfermedades vesiculares. Centro Panamericano de Fiebre Aftosa (OPS/OMS),
Serie de manuales didácticos, v.12, 50p., 1983.
ALONSO, F. A. Manual de diagnostico de Laboratorio de las Enfermedades
Vesiculares. Centro Panamericano de Fiebre Aftosa (OPS/OMS), Serie de manuales
didácticos, v.15, 50p., 1986.
ALONSO, A.; MARTINS, M.A.; GOMES, M. P. D.; ALLENDE, R., SÖNDAHL, M. S.
Development and evaluation of an enzyme-linked immunosorbent assay for
detection, typing and sub typing of vesicular stomatitis virus. Journal of Veterinary
Diagnostic Investigation, v.3, p. 287–292, 1991.
ANDRADE, C. M.; ROSAS, C. E. E.; AMORIN, L. M.; MOTA, J. P.; TEIXEIRA E. N.;
SANTOS, N. F. Vesicular stomatitis in Brazil: isolation and identification of the
Alagoas strain. Anais de Microbiologia, v. XXV, p. 81-87, 1980.
ARBOLEDA, J. J.; TRUJILLO, C. M. La estomatitis vesicular: algunos aspectos
históricos, clínicos, eco-epidemiológicos virológicos, de prevención y control. Revista
Colombiana Ciencias y Pecuaria, v. 15, n. 3, p. 356-367, 2002.
ARTSOB, H.; SPENCER, L. Growth of vesicular stomatitis virus in mosquito cell
lines. Canadian Journal of Microbiology, v. 20, p. 329-336, 1974.
ASTUDILLO, V. M.; ESTUPINÃN, J.; ROSENBERG, F.J.; DA SILVA, A.J.M.; DORA,
J.F.P. Vesicular stomatitis in south America: description of data taken from the
continental vesicular diseases surveillance system. In: PROCEEDINGS OF AN
INTERNATIONAL CONFERENCE ON VESICULAR STOMATITIS, 1984, Mexico, p.
23-61.
74
BILSEL, P.A.; ROWE, J. E.; FITCH W. M.; NICHOL S. T. Phosphoprotein and
Nucleocapsid Protein Evolution of Vesicular Stomatitis Virus New Jersey. Journal of
Virology, v. 64, n. 6, p. 2498-2504, 1990.
BIOEDIT: BIOLOGICAL SEQUENCE ALIGNMENT EDITOR. Disponível em: <http://
www.mbio. ncsu.edu/BioEdit/bioedit.htmL>. Acesso em:10 jun. 2005.
BISHOP, D. H. Rhabdoviruses. Boca Ratón, Florida: CRC Press, Inc., 1979. v. 1,
cap. 1, p. 1-21.
BONUTTI, D. W.; FIGUEIREDO, L. T. M. Diagnosis of Brazilian vesiculoviruses by
reverse transcription-polymerase chain reaction. Memorias do Instituto Oswaldo
Cruz, v. 100 (2), p. 193-196, 2005.
CALLIS, J. J.; DARDIRI, A. H.; FERRIS, D. H.; JUAN GAY, G.; WILDER, F. W.;
MASON, J. Manual ilustrado para el reconocimiento y diagnostico de ciertas
enfermedades de los animales. Centro de enfermedades de los animales de Plum
Island, Departamento de Agricultura de los E.U. (USDA), 5 ed., 1981.
CARTER, G.R.; WISE, D.J.; FLORES, E.F. A Concise Review of Veterinary Virology.
International Veterinary Information Service. Disponível em: < http://www.ivis.org. >.
Acesso em: 06 dez 2004.
CHOMCZYNSKY, P.; SACCHI, N. Single step method of RNA isolation by acid
guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry,
v.162, p. 56-159, 1987.
COMER, J.A.; CORN, J. L.; STALLKNECHT, D. E.; LANDGRAF, J.G.; NETTLES,
V.F. Titers of vesicular stomatitis virus, New Jersey serotype, in naturally infected
male and female Lutzomyia shannoni (Diptera: Psychodidae) in Georgia. Journal of
Medical Entomology, v. 29, n. 2, p. 368-370, 1992.
DEWHURST, S. Rhadbovirus. Disponível em; <http://www.urmc.rochester.edu>.
Acesso em: 4 abr. 2005.
DE STEFANO, E.; ARAÚJO, W. P.; PASSOS, E. C.; PITUCO, E.M. Revisão
Bibliográfica: Estomatite Vesicular. Arquivos do Instituto Biológico, v. 69, n. 3, p. 127133, 2002
DE STEFANO, E.; ARAÚJO, W. P.; PASSOS, E. C.; PITUCO, E.M. Pesquisa de
anticorpos contra o vírus da Estomatite Vesicular em bovinos de corte criados na
região de Araçatuba, Estado de São Paulo, Brasil em 2000. Brazilian Journal of
Veterinary Research and Animal Science, v. 40, p. 29-35, 2003.
EMERSON, S. U. Vesicular Stomatitis virus: structure and function of virion
components. Corrents Topics in Microbiology and immunology, v. 73, p. 1-34, 1976.
FEDERER, K.E.; BURROWS, R.; BROOKSBY, J.B. Vesicular stomatitis virus (the
relation between some strains of the Indiana serotype. Research in Veterinary
Science, v. 8, p. 103-117, 1967.
75
FENNER, F.; McAUSLAN, B. R.; MIMS, C. A.; SAMBROOK, J.; WHITE, D. O. The
Biology of Animal Viruses. London: Academic Press, Inc., 1974. Cap. 6, p. 258-262.
FERRIS, N. P.; DONALDSON, A. I. An enzyme-linked immunosorbent assay for the
detection of vesicular stomatitis virus antigen. Veterinary Microbiology, v. 18, p. 243258, 1988.
GENBANK. Disponível em; <http://www.ncbi.nlm.nih.gov>. Acesso em: 6 jun. 2005.
HALL, T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis
program for Windows 95/98/NT. Nucleic Acids. Symposium Series, v.41, p. 95-98.
1999.
HANSON, R.P. The natural history of vesicular stomatitis. Bacteriological Reviews,
v.16, p.179-204, 1952.
HANSON, R.P. Vesicular Stomatitis. In: GIBBS, E. P. J. Virus Diseases of food
animals. London: Academic Press, Inc. 1981. v. 2, cap.21, p. 517-539.
HANSON, R.P. Vesicular stomatitis: Introduction and overview. Proceedings of an
international conference on vesicular stomatitis, Mexico D.F., 1984.
HAYEK, A. M.; MCCLUSKEY, B. J.; CHAVEZ, G. T.; SALMAN M. D. Financial
impact of the 1995 outbreak of vesicular stomatitis on 16 beef ranches in Colorado.
Journal of the American Veterinary Medical Association, v. 212, p. 820-823, 1998.
HOFNER, M.C.; CARPENTER, W. C.; FERRIS, N. P.; KITCHING R.P.; F. ARIZA
BOTERO, F. A hemi-nested PCR assay for the detection and identification of
vesicular stomatitis virus nucleic acid, Journal of Virological Methods, v. 50, p.11-20,
1994.
HOWATSON, A. F. Vesicular stomatitis and related viruses. Advances in Virus
Research, v. 16, p. 196-256, 1970.
ICTVdb: INTERNATIONAL COMMITTEE ON TAXONOMY OF VIRUSES. Disponível
em: <http://www.ncbi.nlm.nih.gov/ICTVdb/index.htm>. Acesso em: 10 jun. 2005.
INNIS, M.A.; GELFAND, D.H. Optimization of PCR. In: INNIS, M. A.; GELFAND, D.
H.; SNINSKY, J. J.; WHITE, T.J.
PCR Protocols: A Guide to methods and
Applications. California: Academic Press, Inc., 1990. 482 p.
KUMAR, S.; TAMURA, K.; NEI, M. MEGA3: Integrated software for Molecular
Evolutionary Genetics Analysis and sequence alignment. Briefings in Bioinformatics,
v. 5, n. 2, p. 150-163, 2004.
LETCHWORTH, G.J.; RODRIGUEZ, L.L.; BARRERA, J.D.C. Vesicular Stomatitis.
Veterinary Journal, v.157, p. 239-260, 1999.
76
LÓPEZ I. A. et al. Distribución Histórica de la Estomatitis Vesicular en Brasil. Boletín
Centro Panamericano de Fiebre Aftosa (OPS/OMS), v.62-63, 1996 – 1997.
MALIRAT, V.; BERGMANN, I. Fiebre aftosa - Instrumentos moleculares para
caracterización viral. . Centro Panamericano de Fiebre Aftosa (OPS/OMS), Serie
de manuales didácticos, n.17, 2003.
MASON J. The epidemiology of vesicular stomatitis. Boletin Centro Panamericano de
Fiebre Aftosa (OPS/OMS), v. 29–30, p. 35–53, 1978.
MASS J. VESICULAR STOMATITIS. Disponível em <http:// www.vetmed.ucdavis.
edu>. Acesso em: 10 jun. 2005.
MURPHY F. A. SCHOOL OF VETERINARY MEDICINE, UNIVERSITY OF
CALIFORNIA, DAVIS. Disponível em: <http://www.vetmed.ucdavis.edu/viruses
/download.htmL>. Acesso em: 2 nov. 2005.
NICHOL, S.T.; ROWE, J.E.; FITCH, W.M. Glycoprotein evolution of vesicular
stomatitis virus New Jersey. Virology, v. 168, p.281-291. 1989.
NICHOL, S. T.; ROWE, J. E.; FITCH, W. M. Punctuated equilibrium and positive
Darwinian evolution in vesicular stomatitis virus. Proceedings of the National
Academy of Sciences, v. 90, p.10424-10428, 1993.
NÜÑEZ, J. I.; BLANCO, E.; HERNÁDEZ, T.; GÓMES-TEJEDOR, C.; MARTÍN, M. J.;
DOPAZO, J.; SOBRINO, F. A RT-PCR assay for the differential diagnosis of
vesicular viral diseases of swine. Journal of Virological Methods, v. 72, p. 227-235,
1998.
OIE ver WORLD ORGANISATION FOR ANIMAL HEALTH.
OLASCOAGA, R. C.; GOMES, I.; ROSENBERG, F. J.; AUGÉ DE MELLO, P.;
ASTUDILLO, V.; MAGALLANES, N. Fiebre Aftosa. São Paulo:Atheneu, 1999. 458 p.
PANAFTOSA. CENTRO PAN-AMERICANO DE FEBRE AFTOSA. Disponível em: <
http://www.panaftosa.org.br >. Acesso em: 10 jun 2005.
PIRAZZI, A. J. G.; CAGGIANO, C. H. FERNÁNDEZ, A. A. Estomatitis Vesicular:
constatación de la enfermedad y aislamiento del virus. Gaceta Veterinaria, v. 28
(187), p. 85-91, 1966.
PRINGLE, C.R. The composition and structure of rhabdoviruses. Revue scientifique
et technique (International Office of Epizootics).v. 5(2), p. 429-442, 1986.
PRINTZ, P. Adaptation du virus de la stomatite vesiculaire a Drosophila
melanogaster. Annais Instituto Pauster, v. 119, p. 520-537, 1970.
PUSTIGLIONE NETTO, L.; PINTO, A. A.; SUGA, O; YIDA, O. Ocorrência da febre
Aftosa e estomatite Vesicular no Estado de São Paulo, no Biênio 1967-1968.
Arquivos do Instituto biológico, v. 36, n. 3, 1969.
77
RASMUSSEN, T. B.; UTTENTHAL, A.; FERNANDEZ, J.; STORGAARD, T.
Quantitative Multiplex Assay for Simultaneous Detection and Identification of Indiana
and New Jersey Serotypes of Vesicular Stomatitis Virus. Journal of Clinical
Microbiology, v. 43, n.1, p. 356–362, 2005.
RODRIGUEZ, L. L.; LETCHWORTH, G. J.; SPIROPOULOU, C. F.; NICHOL, S. T.
Rapid detection of vesicular stomatitis virus New Jersey serotype in clinical samples
by using polymerase chain reaction. Journal of Clinical Microbiology, v. 31, p. 20162020, 1993.
RODRIGUEZ, L. L.; FITCH, W.M.; NICHOL, S.T. Ecological factors rather than
temporal factors dominate the evolution of Vesicular Stomatitis virus. Proceedings of
the National Academy of Sciences of the United States of America, v 93, n. 23, p.
13030-13035,1996.
RODRIGUEZ, L. L; PAUSZEK, S. J.; BUNCH, T. A.; SCHUMANN, K. R. Full-length
genome analysis of natural isolates of vesicular stomatitis virus (Indiana 1 serotype)
from North, Central and South America. Journal of General Virology, v. 83, p. 24752483, 2002.
SCHUBERT, M.; HARMISON, G. G.; MEIER, E. Primary structure of the vesicular
stomatitis virus polymerase (L) gene: Evidence for a high frequency of mutations.
Journal of Virology, v. 51, p. 505-514, 1984.
THOMPSON, R. C. A.; CONSTANTINE, C. C.; MORGAN, U. M. Overview and
significance of molecular methods: what role for molecular epidemiology?
Parasitology, v.117, p. 161-175, 1998,
VANDEPOL, S.B.; HOLLAND, J.J. Evolution of vesicular stomatitis virus in athymic
mude mice: mutations associated with natural killer cell selection. Journal of General
Virology, v. 67, p. 441-451, 1986.
VANLEEUWEN, J. A.; RODRÍGUEZ, L. L.; WALTNER-TOEWS, D. American Journal
of Tropical Medicine and Hygiene, v. 53, p. 342-350, 1995.
WAGNER, R.R. Rhabdoviridae: The viruses and their replication. In: FIELDS, B. N.;
KNIPE, D.M. et al. Fundamental Virology. 2 ed. New Jersey: Raven publisher, 1991.
3280 p. cap. 19, p. 489-503.
WEAVER, S.C.; TESH, R. B.; GUZMAN, H. Ultrastructural aspects of replication of
the New Jersey serotype of vesicular stomatitis virus in a suspected sand fly vector,
Lutzomyia Shannoni (Diptera: Psychodidae). The American Journal of Tropical
Medicine and Hygiene, v. 46(2), p. 201-210, 1992.
WHELAN, S. P. J.; WERTZ, G. W. Transcription and replication initiate at separate
sites on the vesicular stomatitis virus genome. Proceeding of the National Academy
of Sciences, v. 99, n. 14, p. 9178-9183, 2002.
78
WORLD ORGANISATION FOR ANIMAL HEALTH. Manual of diagnostic test and
vaccines for Terrestrial Animals. Disponível em: < http://www.oie.int. >. Acesso em:
10 nov 2005.
8 OBRAS CONSULTADAS
AFSHAR, A.; SHAKARCHI, N.H.; DULAC, G.C. Development of a competitive
enzyme linked immunosorbent assay for detection of bovine, equine, ovine and
porcine antibodies to vesicular stomatitis virus. Journal of Clinical Microbiology, v.31,
p. 1860 -1865, 1993.
ALONSO, F. A.; SÖNDAHL, M.S. Antigenic and immunogenic characterization of
various strains of the Indiana serotype of vesicular stomatitis isolated in Brazil.
Boletin Centro Panamericano de Fiebre Aftosa (OPS/OMS), v. 51, p. 25–30, 1985.
ANDREW, L. B.; CAROL N. W. Order of transcription of genes of vesicular stomatitis
virus. Proceedings of the National Academy of Sciences, v.73, n.2, p. 442-446,
1976.
BANERJEE, A. K.; RHODES, D.P.; GILL, D. S. Complete nucleotide sequence of the
mRNA coding for the N protein of vesicular stomatitis virus (New Jersey serotype).
Virology, v. 137, p. 432 - 438, 1984.
BANERJEE, A. K. The transcription complex of vesicular stomatitis virus. Cell, v. 48,
p. 363–364, 1987.
BANERJEE, A. K.; CHATTOPADHYAY, D. Structure and function of the RNA
polymerase of vesicular stomatitis virus. Advances in Virus Research, v.38, p. 99124,1990.
BANERJEE, A. K.; BARIK, S. Gene expression of vesicular stomatitis virus genome
RNA. Virology, v. 188, p. 417–428, 1992.
BARRERA, J. C.; LETCHWORTH, G. J. Persistence of vesicular stomatitis virus New
Jersey RNA in convalescent hamsters. Virology, v.219, p. 453 – 464, 1996.
CARTWRIGHT, B.; Brown, F. Serological relationships between different strains of
vesicular stomatitis. The Journal of General Virology, v.16, p. 391–398, 1972.
FELDHAUS, A.L.; LESNAW, J.A. Nucleotide sequence of the L gene of vesicular
stomatitis virus (New Jersey): identification of conserved domains in the New Jersey
and
Indiana
L
proteins.
Virology,
v.163,
p.
359-368.
1988.
80
HOWARD, M.; WERTZ, G. Vesicular stomatitis virus RNA replication: a role for the
NS protein. The Journal of General Virology, v. 70, p. 2683 - 2694, 1989.
NICHOL, S.T. Molecular epizootiology and evolution of vesicular stomatitis virus new
Jersey. Journal of virology, apr., p.1029-1036, 1987.
RODRIGUEZ, L. L. et al.. Serological monitoring of vesicular stomatitis New Jersey
virus in enzootic regions of Costa Rica. The American of Journal Tropical Medicine
and Hygiene, v. 42, p. 272-281, 1990.
SUTMOLLER, P. Vesicular diseases. In: RICHMOND, V.A. Foreign Animal Diseases.
Committee on Foreign Animal Diseases of the United States Animal Health
Association. Food and Agriculture Organization of the United Nations (FAO) 1992 p.
368–382.
TESH, R. B.; PERALTA P. H.; JOHNSON K. M. Ecological studies of vesicular
stomatitis virus. I. Prevalence of infection among animals and humans living in an
area of endemic VSV activity. American Journal of Epidemiology, v. 90, p. 255-268,
1969.
TESH, R. B.; CHANIOTIS, B. N.; JOHNSON, K. M. Vesicular stomatitis virus (Indiana
serotype): transovarial transmission by phlebotomine sandflies. Science, v.175, p.
1477-1479, 1972.
TESH, R. B. et al... Natural infection of humans, animals, and phlebotomine sand
flies with the Alagoas serotype of vesicular stomatitis virus in Colombia. The
American Journal of Tropical Medicine and Hygiene, v. 36, p. 653–661,1987.
VERNON, S., L.; RODRIGUEZ, L.L.; LETCHWORTH. G. J. Vesicular stomatitis New
Jersey virus glycoprotein gene sequence and neutralizing epitope stability in an
enzootic focus. Virology, v. 177, p. 209-215, 1990.