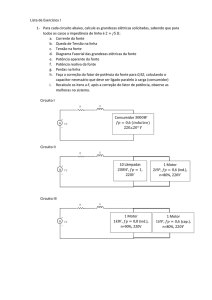
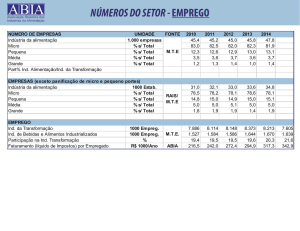
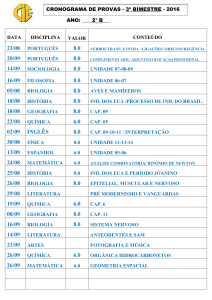
Exercícios de reações de neutralização
1. A cafeína pode ser dosada em meio não aquoso com ácido perclórico. Uma amostra=a de chá pesando
14,5235 g foi colocada em um Becker e acrescentaram-se 12,5 mL de anidrido acético em aquecimento e
sob constante agitação. Após 30 min a solução foi transferida para um balão de 100 mL e completada com
anidrido acético. Então uma alíquota de 50 mL foi titulada com ácido perclórico de concentração 0,0051 M e
fc = 0,901, gastando 5,3 mL. Encontrar a quantidade de cafeína em mg/kg (ppm) de cafeína no chá.
HClO4 + C8H10N4O2 PRODUTOS
n HClO4
n C8H10N4O2
= 1
1
C. fc . V(L) = m (g)
massa molar
RESPOSTA: 651 ppm
2. a pureza da matéria prima sulfito de sódio ( M = 126,1 g/mol) utilizado como conservante em sucos de
frutas, foi verificada. Uma solução padrão de HCl de C= 0,25 M e fc = 0,8594, gastou um volume de 22,8 mL
na titulação de 0,3482 g de sulfito de sódio. Qual a pureza da matéria prima?
2HCl + Na2SO3 produtos
RESPOSTA: 89%
3. O conservante ácido benzóico é empregado em diversas conservas de alimentos como aditivo químico. A
legislação permite50 ppm (mg/kg) no máximo. Uma análise de uma conserva de carne para determinar este
conservante foi realizada. Foi pesadas 30,5432 g de amostra e agitado com água por 2 h em agitação
magnética e aquecimento e depois de transferido para um balão de 100 mL e completado. Uma alíquota de
50 mL foi titulada com NaOH de C = 0,001 M e fc – 0,9735 e gastou-se um volume de 5,4 mL. O alimento
está dentro ou fora da legislação?
NaOH + C7H6O2 PRODUTOS
RESPOSTA: 41,5 ppm
4. O ácido fosfórico é utilizado com conservante em refrigerantes a base de cola. Uma solução de concentração
duvidosa foi comprada para utilização como parte do xarope. Então 15 mL desta solução foram adicionados
em balão de 500 mL e completado o volume com água destilada. Uma alíquota de 25 mL foi titulada com
NaOH C = 0,5 M, fc = 0,9804 e gastou-se um volume de 65,8mL. Qual a concentração em mol/L da solução
desconhecida?
H3PO4 + 3 NaOH Na3PO4 + 3 H2O
RESPOSTA: 3,27 mol/L
SOLUÇÕES TAMPÃO
1. Qual o pH de um tampão formado pela mistura de 52,4 mL de ácido acético de concentração 1,83 M com
acetato de sódio C = 0,48 M e de volume 47,6 mL? Ka ácido = 1,75 x 10-5
RESPOSTA: pH = 4,14
2. Qual o pH de uma solução tampão formada de 30 mL de 0,1 M de ácido lático com 40 mL de 0,5 M de
lactato de sódio. Ka = 1,4, x 10-4
RESPOSTA: pH = 4,66
3. qual o pH de uma solução tampão formado pela mistura de 35 mL de ácido benzóico de concentração
0,042M com benzoato de potássio de concentração 0,41 M e volume 62 mL. Ka ácido = 6,28 x 10 -5
RESPOSTA: pH = 5,44
4. Encontrar o pH de uma solição de malato de sódio 0,084 M e volume 200 mL e seu sal malato de dissódico
2,4 M e volume de 40 mL. Ka1= 1,23 x 10-2 e ka2 = 4.66 x 10-7
ESCOLHA DO MELHOR INDICADOR
1. Escolher o melhor indicador para a titulaçção de etanolamina c = 0,35 M e v = 50 mL com uma silução
padrão de HCl 0,20 M e fc = 0,942. Kb = 1,8 x 10 –5.
HCl + etanolamina = produtos
( ) azul de timol pK ind = 1,7
( ) fenolftaleína pH ind = 9,6
( X ) púrpura de bromocresol pHind = 6,1
2. Qual dos indicadores abaixo você escolheria para uma titulação entre NaOH e ácido caprólico 0,05 M. Ka =
1,31 x 10 –5.
(
) vermelho de clorofenol pH ind = 5,5
( X ) fenolftaleína pH ind = 9,6
( ) amarelo de metila pK ind = 3,2
3. Qual o indicador apropriado para a titulação de HCl volume 50 mL com NaOH 0,02 M e volume gasto de 23,5
mL?
(
) azul de timol pH ind = 2
( X ) azul de bromotimol pH ind = 7,1
( ) timolftaleína pK ind = 9,3
4. Qual o indicador mais apropriado para a titulação de 50 mL de anilina com HCl 0,2 M e volume gasto de 23,5
mL?
( x ) azul de timol pH ind = 2
(
) verde de bromocresol pH ind = 4.7
(
) timolftaleína pK ind = 9,3