UNIVERSIDADE FEDERAL DA PARAÍBA
UNIVERSIDADE FEDERAL RURAL DE PERNAMBUCO
UNIVERSIDADE FEDERAL DO CEARÁ
PROGRAMA DE DOUTORADO INTEGRADO EM ZOOTECNIA
ANATOMIA FOLIAR E VALOR NUTRITIVO DE
POINCIANELLA PYRAMIDALIS (TUL.) L. P. QUEIROZ
EM DIFERENTES FASES FENOLÓGICAS
ANDREZZA ARAÚJO DE FRANÇA
Zootecnista
AREIA-PB
JULHO - 2012
ANDREZZA ARAÚJO DE FRANÇA
ANATOMIA FOLIAR E VALOR NUTRITIVO DE
POINCIANELLA PYRAMIDALIS (TUL.) L. P. QUEIROZ
EM DIFERENTES FASES FENOLÓGICAS
Tese apresentada ao Programa de
Doutorado Integrado em Zootecnia,
da Universidade Federal da Paraíba
do qual participam a Universidade
Federal Rural de Pernambuco, e
Universidade Federal do Ceará, como
requisito parcial para obtenção do
título de Doutora em Zootecnia.
Área de Concentração: Forragicultura
Comitê de Orientação:
Professor Dr. Divan Soares da Silva – Orientador Principal
Professor Dr. Alberício Pereira de Andrade – Co-orientador
Professor Dr. José Carlos Batista Dubeux Jr – Co-orientador
AREIA-PB
JULHO-2012
Ficha Catalográfica Elaborada na Seção de Processos Técnicos da
Biblioteca Setorial do CCA, UFPB, Campus II, Areia – PB.
F814a
França, Andrezza Araújo de.
Anatomia foliar e valor nutritivo de Poincianella pyramidalis (Tul.) L. P. Queiroz. /
Andrezza Araújo de França. - Areia: UFPB/CCA, 2012.
80 f. : il.
Tese (Doutorado em Zootecnia) – Centro de Ciências Agrárias. Universidade
Federal da Paraíba, Areia, 2012.
Bibliografia.
Orientador: Divan Soares da Silva.
1. Forragicultura 2. Planta nativa – semiárido 3. Caatinga – Poincianella
pyramidalis 4. Poincianella pyramidalis I. Silva, Divan Soares da (Orientador) II.Título.
UFPB/CCA
CDU: 633.2(043.2)
ii
ANDREZZA ARAÚJO DE FRANÇA
ANATOMIA FOLIAR E VALOR NUTRITIVO DE
POINCIANELLA PYRAMIDALIS (TUL.) L. P. QUEIROZ
EM DIFERENTES FASES FENOLÓGICAS
Tese defendida e aprovada pela Comissão Examinadora em 30 de Julho de 2012
Comissão Examinadora:
________________________________________
Professor Dr. Divan Soares da Silva
Presidente
Universidade Federal da Paraíba/DZ/CCA – Campus II
________________________________________
Professor Drª. Geane Dias Gonçalves Ferreira
Examinadora
Universidade Federal Rural de Pernambuco/DZ/UAG – Garanhuns-PE
________________________________________
Professor Drª. Juliana Espada Lichston
Examinadora
Universidade Federal do Rio Grande do Norte/CB – Natal-RN
__________________________________________
Professor Dr. Josean Fechine Tavares
Examinador
Universidade Federal da Paraíba/DCF – Campus I
___________________________________________
Professor Dra Mércia Virgínia Ferreira dos Santos
Examinadora
Universidade Federal Rural de Pernambuco/DZ – Recife-PE
AREIA-PB
JULHO-2012
iii
DADOS CURRICULARES DO AUTOR
Andrezza Araújo de França – nasceu em Natal/ RN, aos 14 dias de julho de 1979,
filha de Sérgio Luiz de França e Maria das Neves Araújo de França. Cursou Zootecnia
pela Universidade Federal do Rio Grande do Norte-UFRN, no período de 2000 a 2005;
ano em que ingressou no curso de Mestrado em Zootecnia, pelo Programa de PósGraduação em Zootecnia da Universidade Federal de Pernambuco-UFRPE, defendendo
dissertação, na área de Produção Animal, em fevereiro de 2007; durante este ano,
participou de atividades educacionais no Serviço Nacional de Aprendizagem RuralSENAR/RN. Em 2008 lecionou como professora substituta, as disciplinas Zootecnia
Geral, Animais de Médio e Grande Porte e Suinocultura, na Escola Agrícola Federal de
Vitória de Santo Antão/PE. Em outubro deste mesmo ano, ingressou no curso de
Doutorado em Zootecnia do Programa de Doutorado Integrado em Zootecnia pela
Universidade Federal da Paraíba-UFPB, concentrando os estudos na área de
Forragicultura, submetendo-se a defesa de tese em julho de 2012.
iv
“... não há limites para fazer livros, e o
muito estudar é enfado da carne; no entanto,
tudo quanto vier à mão para fazer, faze-o
conforme as tuas forças...
...Pois não há coisa melhor do que
alegrar-se o homem nas suas obras, visto que
esta é a sua recompensa, assim, alegra-te, teme a
Deus e guarde os seus mandamentos, pois isto é o
dever de todo homem”
Salomão, 935 a.C
“Oh profundidade da riqueza, tanto da
sabedoria como do conhecimento de Deus!
Quão insondáveis os seus juízos e
inescrutáveis os seus caminhos!
Quem, pois conheceu a mente do Senhor?
Ou quem foi seu conselheiro?
Quem primeiro deu a Ele e depois recebeu?
Porque Dele, e por meio Dele, e para Ele
são todas as coisas.
A Ele, pois, a glória eternamente, Amém!”
Paulo, 57-58 d.C
v
Dois se fazem Um
amam-se, geram e amam
sua Cria que um dia se irá...
amam, educam, sofrem, alegram-se, choram, amam.
E embora ela vá,
continuam a proteger, cuidar, segurar, amar.
E os dois continuam a se amar, pois
em amor Àquele que os uniu,
estarão sempre a lhe amar...
À Sérgio e Neves
Dedico
vi
AGRADECIMENTOS
“Àquele que atrai para si as gotas de água que de seu vapor destilam em chuva,
a qual as nuvens derramam e gotejam sobre o homem abundantemente”
Ao Povo brasileiro, pelos impostos pagos.
Ao Centro Nacional de Desenvolvimento Científico e Tecnológico – CNPq pela
concessão de bolsa.
Às instituições públicas de ensino e pesquisa, em especial à Universidade
Federal da Paraíba.
Ao Professor Divan Soares da Silva, pela orientação e ensinamentos, por sua
confiança e liberalidade, por permitir o desenvolvimento desta pesquisa e o alcance de
encontros e descobertas.
Aos Professores co-orientadores Alberício Pereira de Andrade José Carlos
Batista Dubeux Junior, pelos ensinamentos e incentivos à percepção de novos
conhecimentos.
Ao Professor Edson Mauro, à Jacilene Castro e colegas da área de forragicultura:
Daniele Guedes, Jussara Telma, Francinilda, Luiza Daiana, Ariane, Dinara, Ana Paula,
Leonardo e Henrique, pela convivência e contribuições acadêmicas.
Ao Professor Severino Gonzaga e demais professores da Pós-Graduação por
todas as contribuições durante a realização do curso de doutorado.
À Graça Medeiros, por seus serviços como secretária do Programa de PósGraduação em Zootecnia.
Ao Professor Ariosvaldo Medeiros, pela pronta atenção e contribuição às
atividades desta pesquisa no laboratório de nutrição animal.
Aos Professores Paulo Sérgio e Patrícia Givisiez, aos colegas Alexandre, Fátima
e Geovânia, pelo apoio e uso de equipamentos no laboratório de produtos de origem
animal.
À Professora Riselane de Lucena, pelos incentivos e à Camila Azevedo e
Givanildo pela ajuda inicial com os cortes anatômicos.
Aos Professores Lenny Neves, Américo Perazzo, Luciana Cordeiro e Manoel
Bandeira, pelas colaborações acadêmicas.
vii
Ao Professor Leonardo Félix, pelas contribuições em seu laboratório e durante a
qualificação de doutorado.
À Dona Carmem, aos funcionários da Biblioteca Central em Areia, ao Sr. Saulo
e à Srª. Francisca, funcionários do Departamento de Botânica, por sempre bem
receberem.
Ao Sr. José Moraes coordenador da Estação Experimental em São João do Cariri
e ao Sr. Alessandro, pelas contribuições durante as avaliações de campo.
Ao Professor Josean Fechine Tavares, pela solicitude em contribuir com as
análises de compostos secundários no Laboratório de Tecnologia Farmacêutica de
UFPB, e ainda por sua avaliação e contribuições durante a defesa da tese.
Ao Sr. Nonato, técnico do LTF, por sua atenção e contribuições com as análises.
Aos Professores da UFRPE: Adriana Guim, Ângela Maria, Marcelo Ferreira e
Rejane Pimentel, por todo incentivo sempre prestado.
À Professora Mércia Virgínia dos Santos, por sua avaliação e contribuições
durante a qualificação e defesa de tese.
À Professora Geane Dias Gonçalves Ferreira, por sua importante contribuição e
incentivo à continuidade do estudo anatômico de forrageiras, e pela participação na e
contribuições na avaliação da defesa de tese.
Ao Professor Egídio Bezerra Neto, pela realização de análises no laboratório de
química agrícola da UFRPE.
À Professora Juliana Espada Lichston, do Centro de Biociências da UFRN, por
sua atenção e prontidão inicial em resposta a questões, contato este que se tornou ainda
mais valioso, por sua participação durante a qualificação e defesa de tese.
Ao Professor Djalma da Silva e à Artejose Revoredo, responsável técnico do
Núcleo de Estudos em Petróleo e Gás Natural/UFRN, pela realização das
eletromicrografias de varredura.
Aos professores de Zootecnia da UFRN, que muito contribuíram através de seus
ensinos: Henrique Medeiros, Luiz Henrique, Nésio de Barros, Dinarte Aeda e Magna
Guilhermino.
À Professora Márcia Rita F. Machado e ao colega Leandro Martins da
Universidade Estadual Paulista, em Jaboticabal e à Mateus Avilé, pela atenção e grande
contribuição na obtenção e mensuração das imagens de microscopia ótica.
viii
À Kelen Bastos e André Leonardo, pelo importante apoio durante os trabalhos
realizados naquela instituição.
Aos Professores, de diversas instituições, com os quais, a momentânea
convivência, contribuiu para construção de valiosos conhecimentos: Ana Cláudia
Rugiere, Beatriz Lempp, Cacilda do Valle, Celso Carrer, Elizanilda Ramalho, Jacob
Souto, José Moraes, Jim Muir, Magno Cândido, Odilon Pereira, Ricardo Reis e Walter
Pereira.
Aos professores dos tempos de outrora, cujos ensinamentos também foram base
para a conclusão deste trabalho: Ana Lúcia, Ilza Medeiros, Conceição Lemos,
“Cidinha”, “Bila”, Verônica, Ferdinando, Rejane, Áurea, Valdete, Vilelme, Alexandre
Viana e Karina Praxedes.
Àqueles que, mesmo sem saber, ensinaram e sustentaram a realização desta
etapa que se conclui: Sérgio Luiz e Neves de França, Euraci de Araújo e Andréia Araújo
de França, pelo amor, cuidado e proteção.
À Ana Maria Duarte Cabral, verdadeiramente “há amigo mais chegado que um
irmão”.
À Lígia Maria Barreto e Jone Pereira, Rinaldo Souto Maior Jr e Regina, pelos
momentos em família, por todos os exemplos, pela convivência e amizade sincera.
À Aldivan Rodrigues, Alenice Ramos, Anaiane Pereira, Aurinês Borges,
Caroline Cavalcanti, Cláudio Junior, Darklê Luiza, Luana Paula, Manuela Tosto,
Romildo, pela ótima convivência e ajudas acadêmicas, pela companhia, risadas e
alegria de viver de cada um.
À Vanessa Santos e Adda, por espontaneamente distribuírem amizade.
À Ângela Gracindo e Genildo Pereira, Andrea Guimarães, Flávia Alessandra,
Kedes Pereira, Marcelo Ferreira, Tibéria Vanessa e Wellington Samay, por terem feito
parte.
Àqueles amigos e familiares de longe e de perto, aos de antes e de agora, aos de
sempre.
A todas as pessoas importantes para o que hoje há; para o que amanhã será!
ix
SUMÁRIO
Lista de Tabelas....................................................................................................
Lista de Figuras....................................................................................................
Resumo Geral.......................................................................................................
Abstract.................................................................................................................
Página
ix
x
xii
xiv
Considerações Iniciais........................................................................................
1
Capítulo 1- Referencial Teórico - Referencial Teórico - Anatomia Foliar e
Valor Nutritivo de Poincianella pyramidalis (tul.) L. P. Queiroz em Diferentes
Fases Fenológicas ................................................................................................
Componentes da Caatinga.................................................................................
Fatores qualitativos das plantas forrageiras.......................................................
Importância do estudo anatômico na avaliação de plantas forrageiras.............
Catingueira - Poincianella pyramidalis.............................................................
Referências Bibliográficas.................................................................................
3
6
7
10
12
15
Capítulo 2 - Padrão Histo-Anatômico e Degradabilidade dos Tecidos de
Poincianella pyramidalis (Tul.) L. P. Queiroz em Diferentes Fases
fenológicas.............................................................................................................
Resumo...............................................................................................................
Abstract..............................................................................................................
Introdução..........................................................................................................
Material e Métodos............................................................................................
Resultados e Discussão......................................................................................
Conclusões.........................................................................................................
20
21
22
23
25
30
40
Referências Bibliográficas.................................................................................
41
Capítulo 3 - Composição Química e Degradabilidade de Poincianella
pyramidalis (Tul.) L. P. Queiroz em Diferentes Fases fenológicas......................
Resumo..............................................................................................................
Abstract..............................................................................................................
Introdução..........................................................................................................
Material e Métodos............................................................................................
Resultados e Discussão......................................................................................
Conclusões.........................................................................................................
Referências Bibliográficas.................................................................................
Considerações Finais...........................................................................................
44
45
46
47
49
52
59
60
64
x
LISTA DE TABELAS
Capítulo 2 - Padrão Histo-Anatômico e Degradabilidade dos Tecidos de
Poincianella pyramidalis (Tul.) L. P. Queiroz em Diferentes Fases fenológicas
Página
Tabela 1. Características dos períodos de coleta de folíolos e pecíolos de
Poincianella pyramidalis em São João do Cariri-PB.........................
Tabela 2. Proporção média dos tecidos de folíolos e pecíolos de Poincianella
pyramidalis em diferentes fenofases..................................................
Tabela 3. Correlação entre a proporção média dos tecidos do folíolo e os totais de
precipitação em milímetros.........................................................................
28
30
34
Capítulo 3 - Composição Química e Degradabilidade de Poincianella pyramidalis
(Tul.) L. P. Queiroz Diferentes Fases fenológicas
Página
Tabela 1. Porcentagem de nutrientes, taninos e degradabilidade in situ de MS
e FDN de Poincianella pyramidalis em diferentes fenofases............
Tabela 2. Presença ou ausência de compostos secundários em Poincianella
pyramidalis.........................................................................................
53
55
LISTA DE FIGURAS
Capítulo 2 - Padrão Histo-Anatômico e Degradabilidade dos Tecidos de
Poincianella pyramidalis (Tul.) L. P. Queiroz em Diferentes Fases fenológicas
Página
Figura 1.
Figura 2.
Figura 3.
Totais diários de precipitação de chuva (mm), temperatura (ºC) e
umidade relativa do ar - URA (%), ocorridas na estação
experimental de São João do Cariri-PB, no período de janeiro a
agosto de 2010..................................................................................
Vista geral de Poincianella pyramidalis nas fenofases: A.
Vegetativa inicial; B. Vegetativa plena; C. Floração; D.
Frutificação; E. Senescência foliar e F. Detalhe da folha marcada.
Distribuição diária de precipitação (mm) e número de plantas de
Poincianella pyramidalis apresentando emissão foliar (EmFol),
25
26
27
xi
Figura 4.
Figura 5.
Figura 6.
Figura 7.
Figura 8.
Figura 9.
botões florais (BtFlor), flores (Flor), frutos (Frut) e senescência
foliar (SenFol)
Folíolo e pecíolo de Poincianella pyramidalis após 48h de
incubação ruminal. A-B. Aspecto dos fragmentos de folíolos e
pecíolos logo após retirada do rúmen indicando barreira física
(setas); C,D. Eletromicrografias de varredura da superfície
externa dos fragmentos folíolo (C) e pecíolo (D).
Vistas transversais e paradérmicas de folíolos de P. pyramidalis.
A. Região da nervura central. B. Estômato e câmera estomática na
epiderme abaxial (seta). C. Detalhe da camada de cutícula sobre
epiderme abaxial. D. Epiderme abaxial indicando tricomas
tectores (seta). E. Camada de cera epicuticular em forma de
cristais. F. Tricoma peduncular.
Vistas transversais e paradérmicas de folíolos e pecíolos de P.
pyramidalis. A,B. Tricomas tectores (setas). C,D. Tricoma
peduncular (setas). E,F. Tricoma peduncular rompido (setas).
Vistas transversais de folíolos e pecíolos de P. pyramidalis. A.
Bainha do feixe vascular, células lignificadas (seta). B. Ducto
secretor no limbo foliar (seta) e cristais ao redor das fibras (setas
tracejadas). C. Ductos secretores no pecíolo. D. Parênquima
medular do pecíolo com grânulos de amido (seta)
Histoquímica com Iodo para identificação de amido em folíolos e
pecíolos de Poincianella pyramidalis em diferentes fenofases. A.
Fase vegetativa inicial; B. Fase vegetativa plena; C. Floração; D.
Frutificação; E. Senescência foliar. (negro=amido).
Vistas transversais de folíolos e pecíolos de Poincianella
pyramidalis. A. Sistema vascular central detalhe da espessura das
células de esclerênquima e dos cristais entorno destas (setas). B.
Detalhe dos vasos de xilema e cristais em torno de fibras de
esclerênquima no pecíolo (setas)
31
32
33
35
37
38
Capítulo 3 - Composição Química e Degradabilidade de Poincianella pyramidalis
(Tul.) L. P. Queiroz em Diferentes Fases fenológicas
Página
Figura 1.
Figura 2.
Figura 3.
Figura 4.
Totais diários de precipitação de chuva (mm), temperatura (ºC) e
umidade relativa do ar - URA (%), ocorridas na estação
experimental de São João do Cariri-PB, no período de janeiro a
agosto de 2010..................................................................................
Vista geral e detalhe das folhas de Poincianella
pyramidalis.......................................................................................
RMN 1H espectro de Poincianella pyramidalis [200 MHz,
CD3OD]............................................................................................
- RMN 13C espectro de Poincianella pyramidalis [50 MHz,
CD3OD]............................................................................................
48
48
57
58
xii
ANATOMIA FOLIAR E VALOR NUTRITIVO DE POINCIANELLA
PYRAMIDALIS (TUL.) L. P. QUEIROZ EM DIFERENTES FASES
FENOLÓGICAS
RESUMO GERAL
As características anatômicas e nutritivas das plantas forrageiras da caatinga, bioma
exclusivo do semiárido brasileiro, estão em função das condições climáticas próprias
deste ambiente, o qual pode influenciar a maturidade vegetal e relacionar-se a aspectos
de seu aproveitamento pelos microrganismos ruminais, portanto, objetivou-se com este
estudo foi descrever o padrão anatômico de folíolos e pecíolos de Catingueira
(Poincianella pyramidalis), estudar os efeitos da degradação ruminal in situ e in vitro
em seus tecidos e avaliar a bromatologia e degradabilidade de catingueira, em diferentes
fases fenológicas. Os períodos foram distintos por cinco fenofases: vegetativa inicial e
plena, floração, frutificação e senescência e os seguintes quantitativos de chuva: 126,5;
46,7; 75,4; 156,7; 19,4 mm, respectivamente. A avaliação anatômica antes e após a
degradação ruminal foi realizada por meio de microscopia ótica e eletrônica. A partir de
seções transversais foram realizadas mensurações, em µm², das áreas ocupadas pelos
tecidos da epiderme, mesofilo e sistema vascular, as quais foram expressas em
percentual. A composição bromatológica e a degradabilidade de matéria seca (MS) e
fibra em detergente neutro (FDN) foi obtida a partir de amostras composta por folhas e
ramos com até 0,5 cm de diâmetro. Foi realizada detecção da presença de compostos
secundários e determinação do teor de taninos. Através da estrutura anatômica
observou-se diferentes aspectos anatômicos e fisiológicos: 1. Presença de grãos de
amido, nos folíolos, em quantidade visualmente diferenciada; 2. Fenômeno de
rompimento em tricomas pedunculados, somente na senescência foliar; 3. Diferenças
estatísticas e correlação positiva à precipitação hídrica das proporções de parênquima
medular da nervura central dos folíolos; 4. A formação de uma barreira física nos
fragmentos foliares restringiu a degradação dos tecidos, o que pode estar relacionado às
respostas de defesa vegetal. Observou-se correlação negativa do percentual de MS com
o total de precipitação hídrica de cada período, enquanto os teores de proteína bruta,
matéria mineral e fibra em detergente neutro variaram de acordo com o avanço das
xiii
fenofases. Ao longo de todo o período fenológico, a degradabilidade dos componentes
da parede celular foi afetada pelo alto teor de taninos e lignina, a presença destes
compostos fenólicos foi elevada e deve ser considerada quanto aos seus potenciais anti
nutricionais. Fragmentos foliares de até 1cm² apresentam limitações à degradação pelos
microrganismos ruminais, contudo a composição química e os valores degradabilidade
in situ de Catingueira, indicam potencialidades forrageiras desta espécie nativa, no
entanto, pesquisas devem ser desenvolvidas visando avaliar a resposta de variadas
formas de fornecimento aos animais, de modo a se promover a utilização dos recursos
naturais do semiárido.
Palavras-chave: compostos fenólicos; planta nativa; parede celular; semiárido
xiv
LEAF ANATOMY AND NUTRITIONAL VALUE OF POINCIANELLA
PYRAMIDALIS (Tul.) L. P. QUEIROZ IN DIFFERENT PHENOLOGICAL
PHASES
ABSTRACT
The characteristics of the fodder plants from the Caatinga, biome exclusive of the
Brazilian semiarid are according to the climatic conditions of this environment, which
can influence the vegetal maturity and aspects of utilization by rumen microorganisms.
So aim of this study was to describe the anatomical pattern of folioles and petioles
Catingueira (Poincianella pyramidalis), studying the effects of in situ ruminal
degradation and in vitro in their tissues and evaluate the nutritional quality in terms of
bromatology and degradability in different phenological phases of plants. characterized
by different rainfall amount and phenological phases, respectively: initial vegetative,
full vegetative, flowering, fructification, and senescence and 126,5; 46,7; 75,4; 156,7;
19,4 mm respectively. The anatomical measurement before and after ruminal
degradation was performed using images obtained by scanning optical microscopy. The
occupied area was measured, in µm2, by epidermal tissues; mesophyll; medullar
parenchyma; vascular tissues; whose percentages of proportion were analyzed
according to the variety between the seasons. The chemical composition was
determined, the tannins content, and the degradability in situ of dry matter and fiber in
neutral detergent for 48 hours, obtained from samples consisting of leaves and thin
branches up to 0.5 cm in diameter. Through anatomical structure observed different
anatomical and physiological aspects: 1. Presence of starch grains, in folioles, visually
differentiated in quantity 2. Phenomenon of disruption in trichomes stalked, only leaf
senescence; 3 Statistical differences and positive correlation with precipitation water in
the proportion of pith parenchyma of the midrib of the folioles; 4. The formation of a
physical barrier in the fragments of leaves restricted tissue breakdown, which may be
related to plant defense responses. As for nutrition, correlation was observed in the
percentage of DM with total precipitation water of each period, while the crude protein,
mineral matter and neutral detergent fiber vary according to the progress of their
phenophases. Throughout the phenological period, the degradation of cell wall
components was affected by the high content of tannins and lignin.
Keywords: cell wall, compounds phenolic, native plant, semiarid
1
CONSIDERAÇÕES INICIAIS
A pesquisa e a utilização racional dos recursos naturais da Caatinga são
extremamente necessárias para que se mantenham a diversidade e a sustentabilidade do
ecossistema, das quais depende a sobrevivência de diversas populações habitantes do
semiárido brasileiro. As características climáticas do semiárido determinam todos os
aspectos de sua vegetação e fauna, e de forma integrada os componentes da pastagem
nativa da caatinga (planta – solo – animal – clima) interferem entre si, proporcionando
diferentes respostas à produção animal. A água, em vista de sua função nos diversos
processos biológicos, é o componente climático mais definitivo das relações ocorridas
no ambiente semiárido, principalmente, por distribuir-se em baixos níveis de
precipitação, cuja frequência é bastante irregular dentro de um ano.
A Catingueira é uma espécie nativa da Caatinga, cuja abundância na composição
botânica da pastagem e a participação na dieta de pequenos ruminantes do semiárido
têm sido apontadas por diversos estudos. Sua participação na alimentação de pequenos
ruminantes dá-se especificamente, quando esta planta encontra-se me fase de
senescência, tendo em vista o alto teor de taninos nas fases vegetativas, e por isso é um
importante recurso para o período seco.
As características climáticas influenciam o tempo de maturidade da forrageira e,
portanto, suas características qualitativas, as quais determinam o aproveitamento do
potencial nutricional das forrageiras, em vista do espessamento e lignificação das
paredes celulares dos tecidos vegetais, como também em face da mobilização de
nutrientes ao longo do tempo. De acordo com cada tipo de tecido, os microrganismos
presentes no sistema digestivo dos ruminantes, após acessarem o interior das partículas
de forragem, previamente mastigadas, degradam com maior ou menor velocidade as
paredes celulares, aproveitando os nutrientes em diferentes gradientes.
Portanto, o estudo anatômico sobre o arranjo e proporção dos tecidos de plantas
forrageiras é uma importante ferramenta na avaliação da qualidade de forragens, o qual,
através de ensaios da degradação de tecidos, promove conhecimentos específicos sobre
os agentes promotores do aproveitamento da forragem em nível ruminal.
Adicionalmente, permite inferências sobre as relações anatômicas com o teor de
nutrientes e fatores anti-qualitativos das plantas forrageiras.
2
Deste modo, a fim de conhecer características nutritivas de Poincianella
pyramidalis ao longo de seu ciclo fenológico foi desenvolvida esta pesquisa a qual se
apresenta em três capítulos: 1 – Referencial Teórico; 2 – Padrão histo-anatômico e
degradabilidade dos tecidos de catingueira Poincianella pyramidalis em diferentes fases
fenológicas e 3 - Bromatologia e degradabilidade de Catingueira (Poincianella
pyramidalis) em diferentes fases fenológicas.
3
CAPÍTULO I
Referencial Teórico
Anatomia foliar e valor nutritivo de
Poincianella pyramidalis (Tul.) L. P. Queiroz
em diferentes fases fenológicas
4
REFERENCIAL TEÓRICO
No nordeste brasileiro, a pastagem nativa da região semiárida, denominada
Caatinga, é influenciada pelos componentes edafoclimáticos próprios deste ambiente; as
atividades fisiológicas das plantas como produção de biomassa, fixação de carbono e
ciclo fenológico tem seu início e duração em resposta aos pulsos de precipitação (Noy
Meir, 1973; Huxman et al., 2004; Karnieli, 2003). Além disto, os tipos funcionais da
composição botânica da pastagem apresentam diferentes respostas aos componentes
climáticos e, portanto, proporcionam diferentes respostas de produção animal (Karnieli,
2003).
A caatinga apresenta grande diversidade botânica e embora apresente diversos
níveis de degradação, sua riqueza e potencialidades são utilizadas por diversas cadeias
de produção (Sampaio, 2010). Como substrato para pecuária de pequenos ruminantes
sustenta-se nela, a maior parte do efetivo nacional de caprinos e ovinos, de 90,6 e
56,9%, respectivamente, (IBGE, 2009), cujas cadeias produtivas ainda apresentam
baixos índices. Estes índices reforçam a importante necessidade de se investigar mais
profundamente as potencialidades nutricionais das forrageiras nativas da caatinga,
região, cuja disponibilidade territorial deve ser adequadamente aproveitada para o
plantio de forrageiras nativas potencialmente nutritivas, viabilizando uma maior oferta
de alimentos (Costa et al., 2008).
Estas plantas têm sido avaliadas recentemente (Sampaio, 2010; Santos et al.,
2010), contudo, são necessários conhecimentos que possibilitem alternativas de
utilização e aumento da disponibilidade botânica das pastagens, de acordo com as
condições ambientais em que se encontram.
Desta forma, a investigação sobre os atributos de qualidade nutricional das
diversas espécies de plantas forrageiras da caatinga tem no estudo histo-anatômico uma
importante ferramenta para determinações sobre seu aproveitamento pelos pequenos
ruminantes. E o conhecimento a respeito das influências entre os componentes do
ecossistema proporcionará ferramentas para uma adequada utilização podendo ainda,
contribuir e instigar, não apenas a comunidade científica, mas instituições
governamentais e não governamentais, ao lançamento de estratégias para utilização
5
sustentável destas espécies vegetais e como também a conservação e preservação do
ecossistema de pastagem como um todo, atualmente em progressivo processo de
degradação (Dias-Filho, 2011), inserindo assim, as atividades de pesquisa e produção
científica no contexto da sustentabilidade (Barbosa, 2006; Leff, 2000).
Os potenciais qualitativos das plantas forrageiras estão diretamente relacionados
ao conjunto de interelações ocorridas dentro da própria estrutura do vegetal submetidas
à influência das diversas variáveis do ecossistema de pastagens, como também ao
próprio ciclo de vida do vegetal (maturidade).
As células, ligadas entre si pela lamela média - a qual funciona como um
cimento entre as paredes celulares - formam os mais variados tipos de tecidos, que
podem desenvolver apenas uma parede celular, ou ainda a parede celular secundária, a
qual pode possuir até três camadas. Além de diversas funções biológicas, como a
proteção do conteúdo celular, a associação da celulose com lignina na parede celular,
faz com que esta seja definida como uma estrutura complexa e variável que promove
sustentação e defesa aos diferentes tipos de espécies vegetais (Leningher, 2002; Taiz e
Zeiger, 2009; Wilson, 1993).
Contudo, a energia contida nas células vegetais é eficientemente obtida pelos
ruminantes, estes animais possuem microrganismos ruminais capazes de quebrar a
parede celular e promover energia para manutenção e produção animal. De acordo com
Wilson e Mertens (1995), o modo como a parede celular é atacada pelas bactérias
ruminais acontece a partir da superfície interior (lúmen) das células, visto que a lamela
média da parede primária é consistentemente indigestível.
Os tecidos da planta estão organizados conforme a função que exercem no
interior dos diferentes órgãos; apresentam diferentes potenciais de digestão, em virtude
da espessura, quantidade de camadas e lignificação de suas paredes celulares. Segundo
Wilson (1993), a anatomia da planta influencia diretamente sua ingestão pelo animal,
através da facilitação na quebra de suas partículas e a natureza destas partículas, que
consequentemente refletem na sua taxa de passagem pelo rúmen, determinando uma
maior ou menor digestibilidade.
6
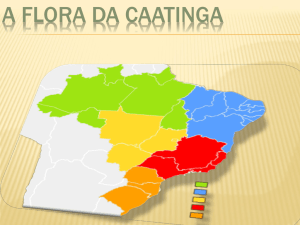
Caracterização da caatinga
A Caatinga ocupa uma área de 844.453 km² do nordeste brasileiro (BRASIL,
2011), em um ambiente de clima semiárido, determinado por condições singulares
quanto à quantidade e distribuição da precipitação pluviométrica; de acordo com NoyMeir (1973) existem três atributos correlacionados que caracterizam este ambiente:
a) a baixa precipitação torna a água um fator dominante, que controla todos os
processos biológicos; b) a precipitação é altamente variável durante o ano e ocorre em
discretos eventos; c) a alta variabilidade da precipitação é um componente casualizado
(imprevisível);
Em geral, de acordo com a localidade, as precipitações médias anuais são em
torno de 300 a 1000 mm de chuva (Sampaio, 2010), distribuídas em pulsos e interpulsos
de precipitação (Noy-Meier, 1973; Andrade et al., 2006). Adicionalmente, as médias
anuais do potencial de evapotranspiração são entre 1500-2000 mm e de temperatura
entre 25-30 ºC; há alta incidência solar, e em geral os solos sobre o embasamento
cristalino podem ser rasos, argilosos e pedregosos, com rochas afloradas na forma de
lajedos. Estes solos são classificados como litossolos, regossolos e brunos não-cálcicos.
Os localizados sobre superfícies sedimentares são profundos e arenosos, geralmente
classificados como latossolos, podzólicos e areias quartzosas (Sampaio, 2010).
Em conjunto, estes fatores promovem uma grande diversidade de tipos de
vegetação, cujas características adaptativas conferem às plantas a qualidade de xerófitas
(Fahn e Cutler, 1992). Esta diversidade está em função de grandes extensões
geomorfológicas e à variação na intensidade do déficit hídrico, topografia e condições
físicas e químicas do solo locais, as quais são determinantes também na ocorrência dos
eventos fenológicos. Como exemplo, Queiroz (2009) cita que os ritmos fenológicos da
vegetação ocorrida nas áreas sedimentares, não apresentam a sazonalidade marcante
apresentada pelas áreas situadas sobre o cristalino.
As espécies vegetais da Caatinga são, em sua maioria, caducifólias,
característica que justifica o nome indígena dado a esta vegetação, visto perderem suas
folhas no período seco. Além disto, apresentam acúleos e espinhos, algumas são
suculentas (como as cactáceas) e há predominância de arbustos e árvores de pequeno
porte, e em geral, as herbáceas são anuais.
7
De acordo com Sampaio (2010) as principais famílias encontradas na caatinga
conforme o número de espécies são: Leguminosae, Convolvulaceae, Euphorbiaceae,
Malpighiaceae, Poaceae e Cactaceae. Sendo importantes nas áreas de transição entre
mata e cerrado, as famílias: Rubiaceae, Cyperaceae, Melastomataceae, Myrtaceae.
Dentre todas estas espécies, muitas são palatáveis e têm qualidades nutricionais
que as potencializam como forrageiras, e enquanto pastagem nativa, a composição
botânica da caatinga pode fornecer, de acordo com a localidade e época do ano, além da
combinação de animais em pastejo, variações entre as proporções de gramíneas,
leguminosas e outras eudicotiledôneas herbáceas e lenhosas (Santos et al., 2008).
Evidentemente, caprinos e ovinos aproveitam melhor do que bovinos a
diversidade e disponibilidade forrageira neste tipo de pastagem nativa, no entanto, há
uma carência por estudos que visem o estabelecimento de taxas de lotação de acordo
com os mais variados ambientes, uma vez que dado o hábito de pastejo e seletividade
destas espécies animais, a composição botânica poderá ser alterada, conforme relatado
por Pereira Filho et al. (1997).
Somadas, as características adaptativas das plantas da caatinga e a alta taxa de
exploração das pastagens, podem interferir no aproveitamento das plantas forrageiras
pelos animais, em termos qualitativos e principalmente quantitativos.
Fatores qualitativos das plantas forrageiras
A qualidade das plantas forrageiras pode ser descrita pelo nível com que ela
atende a demanda nutricional do animal, e depende do seu valor nutritivo, do consumo e
do potencial animal (Allen et al. 2011). A qualidade das plantas forrageiras da caatinga
está diretamente relacionada às suas características xeromórficas, as quais proporcionam
sua adaptação ao clima semiárido, portanto, a disponibilidade hídrica é um fator
preponderante nos atributos qualitativos destas espécies forrageiras.
Para adaptar-se às variações de déficit hídrico, estas plantas desenvolvem fatores
de adaptação em sua anatomia interna e morfologia externa, a fim de reduzir a perda de
água; contudo, estes fatores caracterizam a facilidade de quebra da forrageira em
menores partículas pelos ruminantes, as quais, de acordo com sua natureza podem
apresentar maior ou menor degradabilidade ruminal influenciando a taxa de passagem e,
8
portanto, o consumo. Além disto, os tecidos da planta estão organizados conforme as
funções que exercem no interior dos diferentes órgãos da planta e por isso, apresentam
diferentes potenciais de digestão (Wilson, 1993).
Uma série de modificações histo-anatômicas podem ser desenvolvidas pelas
plantas, caracterizando-as como xerófitas, dentre elas, destacam-se a produção de mais
de uma camada de epiderme foliar em uma ou ambas as faces, menor tamanho de
células, cutícula espessa (alta deposição de cera), poucos espaços intercelulares, maior
proporção de tecidos mecânicos, fibras gelatinosas, várias camadas de tecido paliçádico,
criptas estomatais, lignificação celular, acúmulo de corpos de sílica. E ainda, estas
plantas podem ter a área foliar reduzida, ou, folhas compostas por pequenos folíolos,
folhas coriáceas, além de grande quantidade de acúleos e espinhos (Fanh e Cutter, 1992,
Dickson, 2000).
Como estratégia de adaptação e defesa, as plantas xerófitas desenvolvem uma
série de compostos secundários, alguns, se destacam como antiqualitativos de acordo
com a quantidade presente na planta forrageira, pois reduzem a palatabilidade das
plantas ou provocam efeitos tóxicos aos animais, suas principais classes são: compostos
fenólicos (lignina, taninos, flavonóides); terpenos (saponinas) e compostos nitrogenados
(alcalóides, glicosídeos cianogênicos).
De acordo com Pereira Filho e Bakke (2010), os taninos são os compostos mais
relatados para as forrageiras da caatinga; em geral, estes compostos provocam
diminuição da degradabilidade ruminal da matéria seca e da proteína bruta da forragem.
Porém pode exercer efeito positivo sobre parasitas gastrointestinais (Muir, 2011) e
podem aumentar a qualidade de produtos ruminantes como carne, leite e derivados,
tendo recebido atenção de pesquisadores da região mediterrânea, em vista dos
benefícios que estes produtos podem oferecer para uma alimentação humana saudável
(Vasta e Luciano, 2011; Zervas e Tsiplakou, 2011).
Os terpenos mais conhecidos como antinutricionais são as saponinas, contudo há
outros tipos, como os óleos essenciais. Villalba et al. (2006) relataram que o efeito
antibacteriano dos terpenos afeta a fermentação ruminal e a digestibilidade de MS,
retardando a digestão da celulose e reduzindo a produção de ácidos graxos voláteis.
A importância dos glicosídeos cianogênicos, presentes em plantas do gênero
Manihot, tem sido bastante destacada nas pesquisas sobre a utilização estratégica de
9
maniçoba para alimentação de rebanhos na caatinga; com a hidrólise dos glicosídeos há
formação imediata do ácido cianídrico, a qual de acordo com a dosagem consumida, o
mínimo de 2,4 mg HCN kg-1 de peso vivo animal, pode causar diversos transtornos
metabólicos e até a morte do animal (Soares, 2000). No entanto, o ácido cianídrico é
quase totalmente volatizado (em torno de 80%) quando as folhas e partes de caules da
maniçoba são cortadas e/ou trituradas e exposto ao ar para emurchecimento ou secagem,
(Matos et al. 2005; França et al. 2010).
Há poucos relatos sobre o efeito de flavonóides e outros compostos secundários
como os alcalóides em ruminantes, contudo, estes assumem relevante importância
farmacológica e são responsáveis pelo uso medicinal das plantas da caatinga
(Albuquerque et al. 2007).
A lignina é um composto fenólico de grande importância dentro da planta, pois
participa ativamente do metabolismo primário conferindo resistência e sustentação ao
vegetal, presente em todos os seus tecidos, como constituinte da parede celular (Taiz e
Zeiger, 2009). A lignina, de acordo com a quantidade e localização, juntamente com a
celulose e a hemicelulose, constituem-se os principais componentes químicos que
estabelecem barreiras à degradação da forrageira pelos microrganismos ruminais,
(Wilson, 1993). Já a fibra em detergente neutro (FDN) está presente em elevadas
proporções no conteúdo de matéria seca das plantas da caatinga e pode apresentar
variados níveis de degradação.
Contudo, apesar do conteúdo de lignina presente na FDN, de acordo com Wilson
e Mertens (1995) e França et al. (2010) a indegradabilidade dos tecidos está mais
diretamente ligada à espessura das paredes celulares em virtude de sua deposição ao
longo do crescimento e maturação da planta. Adicionalmente, a taxa de degradação
microbiana da parede celular, pode ser limitada, pois se desenvolve somente a partir da
superfície interior (lúmen), visto que a lamela média adjacente é indigestível (Wilson e
Mertens, 1995).
O espessamento da parede celular ocorre com o encerramento do crescimento
primário da planta, e segue ao longo da vida do vegetal, podendo haver formação de até
três paredes celulares secundárias, ricas em lignina. Portanto, o aumento no teor de fibra
está particularmente relacionado com a maturidade do vegetal (Taiz e Zeiger, 2009).
Como consequência disto, em geral, há aumento no acúmulo de matéria seca e redução
10
do valor nutricional, visto a diminuição da área luminar no interior das células e pela
mobilização de nutrientes para estruturas reprodutivas (Wilson, 1993; Van Soest, 1994).
As diferenças anatômicas e fisiológicas das plantas da caatinga, também estão
relacionadas à via de assimilação de carbono, distinguindo-as entre C3, C4 e CAM
implicando em diferentes graus de aproveitamento destas forrageiras. Gramíneas C 4
possuem uma camada de células que envolvem os feixes vasculares, chamada de bainha
vascular, a qual pode conferir maior resistência à degradabilidade das folhas, enquanto
as leguminosas, plantas C3, além de apresentarem um arranjo anatômico de mais fácil
degradação em geral, possuem maior teor de proteína que gramíneas.
Além da maturidade, a associação de alguns componentes do ecossistema
semiárido como, radiação, temperatura ambiente, disponibilidade hídrica e fertilidade
do solo, afeta fortemente a estrutura dos vegetais da caatinga, influenciando diretamente
sua composição química, em termos de nutrientes e compostos secundários. E ainda, os
elementos interagem entre si, afetando suas distribuições dentro da planta. Como
exemplo, pode-se citar os carboidratos que fornecem energia e esqueletos de carbono
para síntese de aminoácidos, proteínas e enzimas (Marenco e Lopes, 2009).
Portanto, a qualidade das plantas forrageiras da caatinga está diretamente
relacionada às influências ambientais que interferem nos parâmetros de aproveitamento
das forrageiras pelos ruminantes, através dos diversos processos adaptativos à
sobrevivência e maturidade do vegetal (Taiz e Zeiger, 2009).
Importância do estudo anatômico na avaliação de plantas forrageiras
O estudo botânico sobre a anatomia vegetal é atualmente uma importante
ferramenta na avaliação da qualidade de forragens, pois promove um conhecimento
profundo e específico sobre os agentes promotores do aproveitamento da forragem em
nível ruminal (Lempp, 2007). O conhecimento sobre a proporção e a forma como estão
arranjados os tecidos das plantas forrageiras nativas da caatinga quando associado às
características de maturação, proporcionam informações para promoção da melhor
utilização destas plantas como forrageiras, e ainda enriquecendo os conhecimentos a
respeito destas espécies vegetais.
11
Além disto, estes estudos promovem elucidações sobre o nível de degradação
dos tecidos vegetais submetidos à microbiota ruminal, visto que o aproveitamento do
conteúdo celular e dos carboidratos constituintes da parede celular é alcançado,
principalmente, após o rompimento da folha e consequente quebra das paredes
celulares, sendo o ataque de tecidos de paredes espessas realizado a partir do lúmen para
o exterior das células (Wilson e Mertens, 1995).
As pesquisas iniciais datam da década de 70, a partir da incubação in vitro de
cortes histológicos, das folhas e colmos de gramíneas temperadas, desenvolvidas por
Danny E. Akin principal precursor desta extraordinária linha de pesquisa.
No Brasil, os estudos anatômicos de tecidos degradados de forrageiras têm sido
realizados desde o final da década de 90, principalmente com gramíneas dos gêneros
Brachiaria, o capim-araúna - Panicum maximum, capim-elefante - Pennisetum
purpureum, dentre outros (Lempp, 1997; Alves de Brito et al., 1999; Alves de Brito e
Deschamps, 2001; Lima et al., 2001).
A avaliação anatômica contribui para distinguir anatomicamente as mais
variadas espécies forrageiras. Silva et al. (2007) caracterizaram diferentes variedades de
palma forrageira – Opuntia sp. Recentemente, forrageiras nativas da caatinga como
maniçoba - Manihot sp, jurema - Mimosa caesalpiniifolia, mororó -
Bauhinia
cheilantha e forrageiras adaptadas ao semiárido como a leucena - Leucaena
leucocephala, têm sido avaliadas quanto às suas características anatômicas e
qualitativas (França et al., 2010; Silva, 2011).
A proporção de tecidos tem sido correlacionada ao seu potencial nutritivo,
geralmente sendo medida a área relativa em seções transversais das frações da planta.
Segundo Wilson (1993), devido ao arranjo paralelo longitudinal das principais
estruturas de tecidos, essas medidas aproximam-se do volume de cada tipo de tecido,
contudo em folhas de leguminosas, em função de sua venação reticulada, esta área deve
ser previamente delimitada. É possível, portanto, a partir das proporções dos tecidos,
determinar correlações entre suas medidas com mais variáveis nutritivas, como proteína
bruta, fibra em detergente neutro e lignina (Pacciullo, 2002; Ferreira et al., 2007), como
também determinar a taxa e extensão de digestão diferenciadas de diferentes tipos de
tecidos (Akin et al, 1974; Akin e Amos, 1975).
12
De modo geral, a proporção de mesofilo relaciona-se positivamente com a
digestibilidade e negativamente com o teor de parede celular. As proporções de bainha
parenquimática dos feixes, tecido vascular e esclerênquima, ao contrário, relacionam-se
negativamente com a digestibilidade e positivamente com o teor de parede celular,
enquanto que a epiderme não tem apresentado correlações consistentes; enfatiza-se,
portanto, a evidência do papel da anatomia sobre o aproveitamento das forrageiras pelos
ruminantes (Queiroz et al., 2000).
Adicionalmente, a avaliação anatômica de forrageiras de plantas da caatinga,
principalmente, pode contribuir com a identificação e localização dos locais de acúmulo
de metabólitos secundários. A coloração nos tecidos e estruturas vegetais, própria de
cada classe de produtos formada pela reação com o corante utilizado, possibilita a
identificação dos metabólitos e seus locais de acúmulo, sendo visualizados por
microscopia óptica de luz (Johansen, 1940).
As avaliações anatômicas de plantas forrageiras, a respeito do potencial de
digestão e valor nutritivo, contribuem para a escolha de cultivares e ou genitores,
visando o desenvolvimento de novas cultivares por meio de seleção ou cruzamentos
(Lempp, 2007).
Catingueira - Poincianella pyramidalis
A espécie Poincianella pyramidalis, conhecida popularmente como Catingueira,
é uma Leguminosae, pertencente a sub família das Caesalpinioidae, tribo Caesalpinieae,
gênero Poincianella; é arbustiva, endêmica da Caatinga com características
morfofisiológicas promotoras de sua tolerância ao ambiente semiárido, dentre eles o
mecanismo de caducifólia, perda das folhas na época seca (Queiroz, 2009).
Os arbustos podem apresentar um tronco único ou múltiplo troncos, com casca
acinzentada a amarronzada; sua altura varia de 1 a 6 metros e a copa pode ser densa ou
aberta, os ramos jovens podem ou não apresentar tricomas, sendo o eixo foliar com
tricomas glandulares pedunculados densos ou esparsos; tricomas plumosos presentes ou
ausentes nos eixos da inflorescência; os folíolos são alternos, variando de cartáceos
(lâmina fina, rígida e quebradiça) a coriáceos (lâmina espessa, consistente, rígida, mas
flexível), mais longos do que largos, glabros ou esparsamente pubescentes na face
13
adaxial; a nervura principal é oblíqua e excêntrica na base, juntamente com as
secundárias e as terciárias salientes e reticuladas em ambas as faces (Queiroz, 2009).
Apresenta crescimento rápido e boa capacidade de rebrota, às vezes se
comportando como uma espécie colonizadora. Segundo Araújo Filho e Carvalho
(1998), o ciclo fenológico de catingueira dura aproximadamente 238 dias, culminando
com a queda das folhas, época em que é preferida pelos ruminantes.
Essa espécie está amplamente distribuída na caatinga com elevados valores de
freqüência e densidade apontados por diversos estudos florísticos e fitossociológicos
(Amorim et al., 2009; Santos e Santos, 2010). Recentemente, estudos têm apontado
para as relações entre as variações climáticas e a dinâmica fenológica desta espécie
(Sousa, 2011; Lima, 2011).
De acordo com Sousa (2011) e Amorim et al., (2009) a fenologia desta espécie
está diretamente relacionada à disponibilidade hídrica, ambos os autores observaram a
influência da distribuição da precipitação sobre as fenofases de formação de folhas,
floração e frutificação.
É uma planta utilizada pela população regional para fins energéticos, medicinais
e forrageiros, cujos potenciais têm sido demonstrados por diversas pesquisas (Araújo
Filho e Carvalho, 1998; Gonzaga Neto et al., 2004; Figuerôa et al., 2008; Silva et al.,
2009; Bahia et al., 2010).
Sobre suas características forrageiras, Araújo Filho e Carvalho (1998) apontam
as variações da composição química em relação às fenofases da planta. De acordo com
estes autores, esta planta tem um consumo reduzido no início de sua fase vegetativa,
devido ao elevado teor de taninos, que influem em sua palatabilidade, mas as folhas são
bastante consumidas logo após a fase reprodutiva, quando secam e caem.
O teor de proteína bruta varia de acordo com a maturidade de 17 a 11% (Araújo
Filho e Carvalho, 1998), quando avaliado durante fase de frutificação os autores
Gonzaga Neto et al., (2001); Mendonça Jr et al., (2008) e Valadares Filho, (2006)
encontraram os seguintes teores de proteína bruta 11,25%, 12,31% e 11,58%,
respectivamente.
Já a digestibilidade in vitro da matéria seca de Catingueira foi estudada por
Araújo Filho e Carvalho, (1998) ao longo das fases fenológicas da planta, demonstrando
o aproveitamento da matéria seca nas fases vegetativa (58%) de floração (52,5%) e
14
fruitificação (50,4%), e durante a senescência (30,9%), enquanto Valadares Filho (2006)
encontrou o teor de 31, 8% de digestibilidade in vitro de matéria seca.
A participação desta espécie durante a fase de senescência, na dieta de ovinos a
pasto foi de 6,5% (Santos et al., 2008). Adicionalmente, Araújo et al., (2010) relatam
que no período seco do semiárido, os caprinos ingerem cascas dos troncos de
catingueira, fato que está relacionado a adaptabilidade destes animais.
Quanto ao desempenho de produção animal submetidos a dietas com
catingueira, não se tem relatos, contudo Gonzaga Neto et al., (2004) estudando o
balanço protéico e energético de ovinos alimentados com 3 níveis (0, 50 e 100%) de
feno de catingueira constataram não haver diferenças no aproveitamento destes
nutrientes com aumento da inclusão do feno desta forrageira na dieta, indicando que
este pode ser bem aproveitado pelos animais.
Desta forma, a fim de garantir forragem para o período seco e evitar o
extrativismo vegetal, esta forragem pode ser utilizada como feno, a qual confere
aumentos no consumo de PB, como relatado por Gonzaga Neto et al., (2001), pois
apresenta considerável teor protéico independente da fase vegetativa (Araújo Filho e
Carvalho, 1998) ou ainda, como silagem (Guim et al., 2004).
15
REFERÊNCIAS BIBLIOGRÁFICAS
AKIN, D.E.; AMOS, H.E. Rumen bacterial degradation of forage cell walls investigated
by electron microscopy. Applied Microbiology, v. 29, n.5, p. 692-701, 1975
AKIN, D.E.; et al. Rumen bacterial interrelationships with plant tissue during
degradation revealed by transmission electron microscopy. Applied Microbiology, v.
27, n.6, p. 1149-1156, 1974
ALBUQUERQUE, U.P.; et al. Medicinal plants of the caatinga (semi-arid) vegetation
of NE Brazil: A quantitative approach. Journal of Ethnopharmacology v.114 p.325–354,
2007
ALLEN, V.G. et al. An international terminology for grazing lands and grazing animals.
Grass and Forage Science, 66, 2–28, 2011
ALVES DE BRITO, C.J.F.; DESCHAMPS, F.C. Caracterização Anatômica em
Diferentes Frações de Cultivares de Capim-elefante (Pennisetum purpureum
Schumach.) Rev. Bras. Zootec., v.30, n.5, p.1409-1417, 2001
ALVES DE BRITO, C.J.F.; et al. Anatomia quantitativa e degradação in vitro de
tecidos em cultivares de capim-elefante (Pennisetum purpureum Schumach.). Rev.
Bras. Zootec., v.28, n. 2, p.223-229, 1999.
AMORIM, I.L.; et al. Fenologia de espécies lenhosas da caatinga do seridó, RN.
Revista Árvore, v.33, n.3, p.491-499, 2009
ANDRADE, A.P.; et al. Produção Animal no Bioma Caatinga: Paradigmas dos “Pulsos
– Reservas”. In: Reunião Anual da Sociedade Brasileira de Zootecnia, 43, 2006, João
Pessoa, Anais...João Pessoa, 2006
ARAÚJO K.D.; et al. Uso de species da caatinga na alimentação de rebanhos no
município de São João do Cariri-PB. O Espaço Geográfico em Análise, n.20, p157-171,
2010
ARAUJO FILHO, J.A.; CARVALHO, F.C. Fenologia e valor nutritivo de espécies
lenhosas caducifólias da caatinga. Sobral: Embrapa Caprinos – Centro Nacional de
Pesquisa de Caprinos, 1998 (Comunicado Técnico n. 39).
BAHIA, M.V.; et al. Occurrence of biflavones in leaves of Caesalpinia pyramidalis
specimens. Quim. Nova, v. 33, n. 6, p. 1297-1300, 2010.
BARBOSA,S.B. O ensino da Zootecnia no Brasil: 40 anos de experiência e
perspectivas. In: Reunião Anual da Sociedade Brasileira de Zootecnia, 43, 2006, João
Pessoa, Anais...João Pessoa,2006
16
BRASIL, Ministério do Meio Ambiente – MMA. Caatinga. Disponível em:
http://www.mma.gov.br/sitio/index.php?ido=conteudo.monta&idEstrutura=203. Acesso
em: 10 out. 2011
COSTA, R.G.; et al. Caracterização do sistema de produção caprino e ovino na região
semiárida do estado da Paraíba. Brasil. Arch. Zootec. v. 57, n. 218, p. 195-205, 2008.
DICKSON, W.C. Integrative Plant Anatomy. Harcourt – Academic Press, 2000. 533p.
FAHN, A.; CUTLER, D.F. Xerophytes. Gebrüder Borntraeger. Berlin, 1992. 178p.
FERREIRA, G.D.G.; et al. Caracterização morfoanatômica do colmo de híbridos de
milho para avaliar a qualidade de silagem. Acta Scientarium. Animal Sciences, v. 29, n.
3, p. 249-254, 2007
FIGUERÔA, J. M.; et al. Variações sazonais na sobrevivência e produção de biomassa
de Caesalpinia pyramidalis Tul. após corte raso e implicações para o manejo da
espécie. R. Árvore, Viçosa-MG, v.32, n.6, p.1041-1049, 2008
FRANÇA, A.A. et al.; Anatomia e cinética de degradação do feno de Manihot glaziovii.
Acta Scientiarum. Animal Sciences.,v.32, n.2, p.131-138, 2010
GONZAGA, S.N. et al.; Composição bromatológica, consumo e digestibilidade in vivo
de dietas com diferentes níveis de feno de Catingueira (Caesalpinea bracteosa)
fornecidas para ovinos Morada Nova. Rev. Bras. Zootec., v.30, n2, p.553-562, 2001.
GONZAGA, S.N.; et al. Efeito da Adição de Feno de Catingueira (Caesalpinea
bracteosa) na Ração sobre o Balanço de Energia e de Nitrogênio em Ovinos Morada
Nova. Rev. Bras. Zootec., v.33, n.5, p.1325-1331, 2004.
GUIM, A.; et al. Estratégias alimentares para caprinos e ovinos no semi-árido. In: I
Simpósio Internacional de Conservação de Recursos Genéticos de Caprinos e Ovinos,
2004, Recife. Anais... Recife: UFRPE, p.73-102, 2004
HUXMAN, T. E., et al. Precipitation pulses and carbon fluxes in semiarid and arid
ecosystems. Oecologia, v. 141, 254–268, 2004
INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA – IBGE. Produção
Pecuária municipal. Rio de Janeiro, v. 37, p.1-55, 2009
JOHANSEN, D.A. Plant Microtechnique. McGraw-Hill, New York, 1940. 523p.
KARNIELI, A. Natural vegetation phenology assessment by ground spectral
measurements in two semi-arid environments. Int. J. Biometeorol v. 47,179-187, 2003
LEFF, E. Complexidade, Interdisciplinaridade e Saber Ambiental. In: PHILIPPI Jr., A.;
TUCCI, C.E.M.; HOGAN, D.J.; NAVEGANTES, R. (Ed) Interdisciplinaridade em
Ciências Ambientais. São Paulo: Signus Editora, 2000
17
LEMPP, B. Avanços metodológicos da microscopia na avaliação de alimentos. Revista
Brasileira de Zootecnia, v. 36, suplemento especial, p. 315-329, 2007.
LIMA, C. R. Avaliações ecofisiológicas em sementes de Caesalpinia Pyramidalis
(Tul). (Tese de Doutorado), Areia: UFPB, 2011. 93p.
LIMA, L. M. S., et al.. Degradação ruminal dos tecidos vegetais e composição
Bromatológica de cultivares de Axonopus scoparius (Flüegge) Kuhlm. e Axonopus
fissifolius (Raddi) Kuhlm. Ciência Rural, v. 31, n. 3, p. 509-515, 2001
MARENCO R.A.; LOPES, N.F. Fisiologia Vegetal: fotossíntese, respiração, relações
hídricas e nutrição mineral. Viçosa: UFV, 2009
MATOS, D. S.; et al. Composição química e valor nutritivo da silagem de maniçoba
(Manihot epruinosa). Archivos de Zootecnia, v. 54, n. 208, p. 619-629, 2005.
MENDONÇA JR., A.F.; et al. Composição bromatológica, consumo e digestibilidade in
vivo de dietas com diferentes níveis de feno de catingueira (Caesalpinea pyramidalis
Tul), fornecidas para ovinos SRD. Revista de Biologia e Ciências da Terra, v.8, n.1,
p.190-197, 2008.
MUIR, J.P. The multi-faceted role of condensed tannins in the goat ecosystem. Small
Ruminant Research 98 (2011) 115–120
NOY-MEIR, I. Desert Ecosystems: Environment and Producers. Annual Review of
Ecology and Systematics. v.4, 25-51, 1973
PACCIULLO, D. S. C. et al. Degradação in vitro de tecidos da lâmina foliar e do colmo
de gramíneas forrageiras tropicais em função do estádio de desenvolvimento. Revista
Brasileira de Zootecnia, v. 31, n. 2, p. 900-907, 2002.
PEREIRA FILHO, J.M. e BAKKE, O.A. Produção de Forragem de Espécies Herbáceas
da Caatinga. In: GARIGLIO,M.A. et al.(Ed). Uso sustentável e conservação dos
recursos florestais da caatinga. Brasília: Serviço Florestal Brasileiro, 2010
PEREIRA FILHO, J.M. et al. Variações plurianuais da composição florística do estrato
herbáceo de uma caatinga raleada, submetida ao pastejo alaternado ovino-caprino. Rev.
Bras. Zootec., v.26, n.2, p.234-239, 1997
QUEIROZ, D. S. et al. Avaliação da Folha e do Colmo de Topo e Base de Perfilhos de
Três Gramíneas Forrageiras. 2. Anatomia. Rev. bras. zootec., v.29, n.1, p.61-68, 2000
QUEIROZ, L. P. Leguminosas da Caatinga. 1. ed. Feira de Santana: Universidade
Estadual de Feira de Santana, 2009. v. 1. 443 p.
18
SAMPAIO, E.V.S.B. Caracterização do Bioma Caatinga: Características e
Potencialidades. In: GARIGLIO,M.A. et al.(Ed). Uso sustentável e conservação dos
recursos florestais da caatinga. Brasília: Serviço Florestal Brasileiro, 2010
SANTOS, G.R.A.; et al. Determinação da composição botânica da dieta de ovinos em
pastejo na Caatinga. R. Bras. Zootec., v.37, n.10, p.1876-1883, 2008
SANTOS, M. J. C.; SANTOS, F. R. Levantamento florístico e fitossociológico em
sistema agrosilvipastoril como fonte de alimentos para a ovinocultura no semiárido
sergipano. Acsa. v.06, n.02, p.15-20, 2010
SANTOS, M.V.F. et al. Potential of Caatinga forage plants in ruminant feeding. R.
Bras. Zootec., v.39, p.204-215, 2010 (supl. especial)
SILVA, L. B.; et al. Anatomia e densidade básica da madeira de Caesalpinia
pyramidalis Tul. (Fabaceae), espécie endêmica da caatinga do Nordeste do Brasil. Acta
Bot. Bras. v. 23, n.2, p. 436-445, 2009.
SILVA, M.A. Caracterização de leguminosas arbustivo-arbóreas em Pernambuco. Tese
(Doutorado em Zootecnia) – Universidade Federal Rural de Pernambuco, 2011. 129 p.
SILVA, M.G.S.; et al. Anatomia de diferentes variedades de palma forrageira (Opuntia
sp) In: International Congresso On Cactus Pear and Cochineal, 6. Proceedings...João
Pessoa, 2007.
SOARES, J. G. G. Avaliação da silagem de maniçoba – Teor de ácido cianídrico.
Petrolina: Embrapa -Semiárido, 2000. (Embrapa -Semiárido , Comunicado Técnico, n.
93).
SOUSA, D. M. M. Fenologia, avaliação do tubo polínico e maturação de frutos e
sementes de Poincianella pyramidalis (Tul.) L.P. Queiroz. (Tese de Doutorado), Areia:
UFPB, 2011. 117p.
TAIZ, L. e ZEIGER, E. Fisiologia Vegetal. 4 ed. Porto Alegre: Artmed, 2009. 848p.
VALADARES FILHO, S.C., et al. Tabelas Brasileiras de Composição de Alimentos
para Bovinos. 2 ed.Viçosa: UFV, 2006.
VAN SOEST, P. J. Nutritional ecology of the ruminant. 2. ed. Ithaca: Cornell
University Press, 1994.
VASTA, V.; LUCIANO, G. The effects of dietary consumption of plants secondary
compounds on small ruminants products quality. Small Ruminant Res., 2011,
doi:10.1016/j.smallrumres.2011.09.035.
Disponível
em:
www.
elsevier.com/locate/smallrumres. Acesso em: 03 de nov. de 2011
19
VILLALBA, J.J.; et al. Terpenes and carbohydrate source influence rumen
fermentation, digestibility, intake, and preference in sheep. J. Anim. Sci. n. 84, v. 9,
p.2463–2473, 2006.
WILSON, J. R. Organization of forage plant tissue. In: JUNG, H. G.; BUXTON, D. R.;
HATFIELD, R. D.; RALPH, J. (Ed.). Forage cell wall structure and digestibility.
Madison: ASA/CSSA/SSSA, 1993.
WILSON, J. R.; MERTENS, D. R. Cell wall accessibility and cell structure limitations
to microbial digestion of forage. Crop Science, v. 35, n. 1, p. 251-259, 1995.
ZERVAS, G., TSIPLAKOU, E. The effect of feeding systems on the characteristics of
products
from
small
ruminants.
Small
Ruminant
Res.,
2011
Doi:10.1016/j.smallrumres.2011.09.034,
Disponível
em:
www.
elsevier.com/locate/smallrumres. Acesso em: 03 de nov. de 2011
20
CAPÍTULO II
Padrão Histo-Anatômico e Degradabilidade dos Tecidos de
Poincianella pyramidalis (Tul.) L. P. Queiroz em Diferentes Fases
Fenológicas
21
Padrão Histo-Anatômico e Degradabilidade dos Tecidos de Poincianella
pyramidalis (Tul.) L. P. Queiroz em Diferentes Fases fenológicas
RESUMO
As características das plantas forrageiras da caatinga, bioma exclusivo do semiárido
brasileiro estão em função das condições climáticas próprias deste ambiente, o qual
pode influenciar a maturidade vegetal e consequentemente seus aspectos anatômicos e
fisiológicos, estudos relacionando os aspectos de aproveitamento dos tecidos de
leguminosas forrageiras por microrganismos ruminais são escassos, assim objetivou-se
determinar o padrão anatômico e a degradabilidade dos tecidos foliares de Poincianella
pyramidalis em distintas fenofases, relacionando-as à precipitação hídrica. Coletaram-se
folíolos e pecíolos de 10 plantas adultas em cinco períodos cujas fenofases foram:
vegetativa inicial, vegetativa plena, floração, frutificação e senescência foliar. Realizouse ensaios de degradação ruminal in situ e in vitro por 48h, protegendo-se os fragmentos
foliares de qualquer ação mecânica. Lâminas semipermanentes dos pecíolos e da região
mediana dos folíolos foram obtidas a partir de seções transversais confeccionadas à mão
livre. Obtiveram imagens por microscopia ótica e eletrônica de varredura. Mediu-se a
área ocupada, em µm2, por tecidos epidérmicos; mesofilo; parênquima medular; feixes
vasculares; cujos percentuais de proporção foram analisados quanto à variância entre os
períodos, segundo um delineamento inteiramente casualizado e as médias comparadas
pelo teste Tukey a 5% de probabilidade, as quais foram correlacionadas aos dados de
precipitação ocorrida de cada período. O padrão anatômico e a degradabilidade de
catingueira não apresentaram variações entre os períodos, contudo a degradação dos
tecidos de catingueira, em ambos os métodos de avaliação, foi restringida devido a uma
barreira física, atribuída a mecanismos de defesa vegetal.
Palavras-chave: anatomia; defesa vegetal; microrganismos ruminais; parede celular
22
Anatomical Pattern and Degradability of Tissues Poincianella pyramidalis (Tul.)
L.P. Queiroz in Different Phenological Phases
ABSTRACT
The characteristics of the fodder plants from the Caatinga, biome exclusive of the
Brazilian semiarid are according to the climatic conditions of this very environment,
which can influence the vegetal maturity and consequently its anatomic and physiologic
aspects, Studies relating the aspects of usage of the tissues of fodder plants by ruminal
microorganisms are scarce, so the aim was to detect the anatomic pattern and the
degradability of the foliar tissues of Poincianella pyramidalis in different phenophases,
relating them to the rainfalls. Folioles were collected and petioles of 10 adult plants in
five periods whose phenophases were: initial vegetative, full vegetative, flowering,
fructification and foliar senescence. Experiments of ruminal degradation in situ and in
vitro were performed for 48 hours, protecting the foliar fragments from any mechanic
action. Semi-permanent blades of the petioles and from the median region of the
folioles were obtained from handmade transversal sections. Images were obtained by
scanning optical microscopy. The occupied area was measured, in µm2, by epidermal
tissues; mesophyll; medullar parenchyma; vascular tissues; whose percentages of
proportion were analyzed according to the variety between the seasons, according to a
delimitation entirely randomized and the average rates compared by the Tukey’s test at
5% of probability, which were correlated to the data about rainfalls which occurred each
season. The anatomic pattern and the degradability of Catingueira did not show
variations between the seasons; however, the degradation of the tissues in both the
evaluation methods, was limited due to a physical barrier, attributed to mechanisms of
vegetal defense.
.Keywords: anatomy, cell wall, plant defense, rumen microorganisms
23
INTRODUÇÃO
As avaliações anatômicas de forrageiras leguminosas e outras famílias ainda são
escassas, principalmente em se tratando de plantas nativas da caatinga, bioma cuja
diversidade e potencial forrageiro tem sido exaustivamente relatados (Sampaio, 2010;
Bakke et al., 2010; Santos et al., 2010). A espécie Poincianella pyramidalis endêmica
da Caatinga conhecida popularmente como catingueira, é uma leguminosa arbustiva
caducifólia (Queiroz, 2009). De acordo com Araújo Filho e Carvalho (1988) esta planta
é preferida pelos ruminantes na última fase de seu ciclo fenológico. Ela apresenta
elevados teores de proteína, contudo, o teor de taninos parece ser limitante para o
consumo das folhas jovens. Portanto, a avaliação e o estudo conjunto das interelações
entre as entradas de precipitação no ambiente semiárido e as respostas das espécies
forrageiras (fenologia, aspectos anatômicos, morfo-fisiológicos e nutricionais) podem
promover ferramentas que auxiliem no melhor aproveitamento desta espécie.
De acordo com Noy Meir, (1973) a irregularidade da distribuição pluviométrica
de ambientes áridos e semiáridos pode ser definida pela ocorrência de pulsos e
interpulsos de precipitação, os quais influem diretamente nas respostas dada pela
vegetação em termos principalmente, de composição botânica, produção de fitomassa, e
ciclo fenológico, fatores importantes quanto a disponibilidade e maturidade de plantas
forrageiras. Plantas nativas destes ambientes demonstram adaptabilidade às condições
climáticas através de sua periodicidade fenológica, ou seja, o tempo de ocorrência e
duração dos eventos fenológicos. Adicionalmente, o padrão fenológico de uma espécie
vegetal, está sob influência dos demais fatores bióticos e abióticos do ecossistema
(Lesica e Kittelson, 2010; Karnieli, 2003).
A avaliação anatômica de como estão arranjados as células e tecidos vegetais
pode proporcionar dentre outros conhecimentos, elucidações sobre o aproveitamento do
conteúdo celular e dos componentes de suas paredes, pelos microrganismos ruminais.
Esta determinação ao longo das fenofases de cada planta torna-se ainda mais
importante, em vista do efeito que a maturidade pode exercer no espessamento da
parede celular, adicionado pela influência das variações ambientais como precipitação e
temperatura (Wilson et al., 1991; Wilson, 1993; Lempp, 2007).
Os tecidos vegetais apresentam diferentes níveis de degradação ruminal devido,
principalmente, ao tipo de parede celular de cada unidade constituinte e do grau de
24
lignificação destas paredes (Wilson, 1993). Em geral, o acesso dos microrganismos ao
interior dos tecidos é proporcionado pelo rompimento da folha e consequente quebra
das paredes celulares; o ataque de tecidos de paredes espessas se dá do lúmen para o
exterior das células (Wilson e Mertens, 1995). Assim, os tecidos podem ser
classificados quanto à velocidade e proporção de degradação, sendo de rápida e alta
degradação as paredes internas da epiderme, os parênquimas clorofilianos e os tecidos
do floema, enquanto os tecidos formados por esclerênquima e os feixes da bainha
vascular são parcialmente e vagarosamente degradáveis; já os tecidos de xilema não são
degradáveis (Akin e Amos, 1975; Akin, 1989; Wilson, 1993; Wilson e Mertens, 1995).
Assim, objetivou-se determinar o padrão anatômico e a degradabilidade dos
tecidos de folíolos e pecíolos de Poincianella pyramidalis em distintas fenofases da
planta e suas relações com a precipitação hídrica.
25
MATERIAL E MÉTODOS
A pesquisa foi desenvolvida em uma área de Caatinga, de aproximadamente 10
ha, na Estação Experimental da UFPB, no município de São João do Cariri-PB. O clima
local da região é BSh, Semiárido quente, segundo classificação de Köppen,
caracterizado por chuvas pobres e irregulares. A estação experimental tem médias
históricas anuais de umidade relativa do ar, temperatura e precipitação de 71,8%, 25,6ºC
e 517 mm, respectivamente. A área apresenta uma cobertura florística arbustiva-árborea
com quatro espécies predominantes Poincianella pyramidalis, Croton sonderianus,
Aspidosperma pyrifolium, Jatropha mollissima além de cactáceas e diversas espécies
herbáceas e sub-arbustivas; o solo é franco arenoso, com clareiras e afloramentos
rochosos (Andrade et al., 2009).
O período total de avaliação foi de janeiro a agosto de 2010, no gráfico 1
apresenta-se a distribuição diária dos índices climatológicos durante estes meses, os
quais foram obtidos na Bacia Escola da estação, integrante da Área de Engenharia de
Recursos Hídricos da Universidade Federal de Campina Grande (UFCG).
Figura 1. Totais diários de precipitação de chuva (mm), temperatura (ºC) e umidade
relativa do ar - URA (%), ocorridas na estação experimental de São João do
Cariri-PB, no período de janeiro a agosto de 2010.
26
Foram selecionadas ao acaso e identificadas, dez plantas adultas da espécie
Poincianella pyramidalis, as quais apresentavam aproximadamente 3m de altura de 3,
caules ramificados, copa densa e folhas impari-bipinadas com 5 pinas de folíolos
alternos, em geral coriáceos (Figura 2).
A
B
C
D
E
F
Figura 2.A-F. Vista geral de Poincianella pyramidalis nas fenofases: A.
Vegetativa inicial; B. Vegetativa plena; C. Floração; D.
Frutificação; E. Senescência foliar e F. Detalhe da folha
marcada.
Em cada planta foram marcadas 3 folhas, cujos folíolos estavam completamente
expandidos, livres de sombreamento, a uma altura média de 1,5m do nível do solo.
27
As coletas foram realizadas em 5 períodos, distintos pela quantidade e
distribuição de precipitação e pela fenofase apresentada pela planta (Gráfico 2 e Tabela
1). No gráfico 2 apresenta-se o pulso de precipitação, gatilho para a rebrota foliar (em
dezembro de 2009) e a duração dos eventos fenológicos, em conseqüência dos demais
pulsos de precipitação durante o período de avaliação.
As dez plantas marcadas foram observadas a cada dois dias, conforme o
surgimento e duração de folhas, botões florais, flores e frutos, senescência e abscisão
foliar. Os períodos de coleta foram designados de acordo com a ocorrência de cada
fenofase em, no mínimo, 70% das plantas.
O período 1 foi caracterizado pelo início da fase vegetativa, onde havia emissão
de novas folhas e desenvolvimento das folhas completamente expandidas. O período 2
foi marcado por altas temperaturas e um acumulado de 46,7 mm de precipitação,
distribuídos em 3 dias, provocando sintomas de estresse hídrico nas folhas. Os períodos
3 e 4 foram marcados pelas fenofases de reprodução, sendo a 3ª coleta realizada quando
as plantas encontravam-se em início de floração, e a 4ª coleta no início da frutificação.
O 5º período foi marcado pela fase de senescência foliar, quando as folhas
encontravam-se totalmente amarelas e em abscisão.
Figura 3. Distribuição diária de precipitação (mm) e número de plantas de Poincianella
pyramidalis apresentando emissão foliar (EmFol), botões florais (BtFlor),
flores (Flor), frutos (Frut) e senescência foliar (SenFol).
28
Tabela 1. Características dos períodos de coleta de folíolos e pecíolos de Poincianella
pyramidalis em São João do Cariri-PB.
Períodos de
Coleta
Data de
Coleta
Total de
Chuvas
(mm)
/período
Dias
com
chuvas
Dias
sem
chuvas
Fenofase da
planta
Desenvolvimento
Foliar
Período 1
06/fev
126,5
7
30
24
Vegetativa
inicial
Vegetativa
plena
5
26
Floração
156,7
13
32
19,4
11
31
Frutificação
Senescência
foliar
Completamente
expandido
Completamente
expandido
Completamente
expandido
Completamente
expandido
Período 2
05/mar
46,7
3
Período 3
05/abr
75,4
Período 4
20/maio
Período 5
11/ago
Senescência
A cada período foi coletado 1 folíolo completamente expandido, de umas das
pinas intermediárias de cada folha marcada e os pecíolos foram retirados de 3 folhas
aleatórias; totalizando 10 amostras de folíolos e pecíolos para cada ensaio. As coletas
eram sempre realizadas pela manhã no intervalo compreendido entre às 5:30h e 6:30h.
Para determinação do padrão anatômico as amostras em estado natural foram
mantidas íntegras, armazenadas em solução de formol:ácido acético: álcool 50 (FAA
50) para fixação dos tecidos.
Para o estudo da degradação de tecidos, as amostras foram preparadas de modo a
permitir acesso dos microrganismos ruminais ao interior das células; os pecíolos foram
cortados logo acima do pulvino até 1,2 cm de cumprimento do eixo foliar e os folíolos
foram cortados em sua base e ápice, formando fragmentos de aproximadamente 1 cm²,
ambos foram armazenados juntos, em cassetes plásticos histológicos, a fim de não
permitir ação mecânica ruminal, seguindo metodologia adaptada de Lima et al., (2001)
Para avaliação da degradabilidade dos tecidos in situ, os cassetes histológicos
contendo os fragmentos foliares foram transportados em isopor com gelo ao local de
incubação, colocados em uma bolsa de náilon, com porosidade de 45 µm, a qual
permaneceu no rúmen de um caprino adulto fistulado por um período de 48h. Após este,
a bolsa foi retirada, colocada em água com gelo para paralisação da atividade ruminal e
os resíduos dos fragmentos de cada cassete foram lavados com água destilada e
armazenados em potes identificados contendo solução fixadora FAA 50. Para avaliação
da degradação dos tecidos in vitro os cassetes histológicos foram incubados em rúmen
29
artificial Daisy II Ankon® com líquido ruminal de um caprino adulto e soluções tampão
A e B por 48h, após este período, o material foi tratado como no ensaio in situ.
Lâminas semipermanentes dos pecíolos e da região da nervura central dos
folíolos foram obtidas a partir de seções transversais confeccionadas à mão livre, para
avaliação do padrão anatômico antes e após a degradação dos tecidos. As seções
transversais foram clarificadas em solução comercial de hipoclorito de sódio a 50%,
neutralizadas em água acética a 1:500, lavadas em água destilada, coradas com
Safranina e Azul de Alcian, montadas em glicerina a 50% e as lamínulas lutadas com
esmalte de unhas incolor. Para identificação de amido e substâncias lipídicas foram
utilizados Iodo a 2% e Sudam Black, respectivamente (Johansen, 1974).
Utilizou-se microscópio ótico com câmera Leica, DM5000 B para obtenção das
imagens e o software Leica LAS v.3.6 para realização das medidas de área (µm2)
ocupada pelos tecidos.
Os resíduos de fragmentos dos folíolos e pecíolos foram fotografados e a área
degradada foi obtida por diferença entre a área total e a residual, medida através do
software Sigma Scan Pro 5, expressa em percentual.
Imagens dos tecidos também foram obtidas por microscópio eletrônico de
varredura (MEV) modelo: XL-30 – ESEM/Phillips no Núcleo de Estudos e Pesquisa em
Gás Natural e Petróleo (NEPGN) da Universidade Federal do Rio Grande do Norte
(UFRN), onde as amostras conservadas em FAA 50 foram submetidas à desidratação
alcoólica, e após secas, metalizadas em equipamento metalizador "Sputter Coater"
modelo: SCD-005/BAL-TEC.
As proporções da área ocupada pela epiderme abaxial e adaxial; parênquima
paliçádico
e
lacunoso
(mesofilo);
parênquima
medular;
feixes
vasculares
(esclerênquima, floema, xilema) foram avaliadas quanto à variância entre os períodos
segundo um delineamento inteiramente casualizado e comparadas pelo teste Tukey a
5% de probabilidade. Aplicou-se teste de correlação entre as proporções dos tecidos e os
totais de precipitação de cada período avaliado, utilizando-se SAS (Statistical Analysis
System, versão 9.2.)
30
RESULTADOS E DISCUSSÃO
Em todos as fases fenológicas, as plantas avaliadas de Catingueira (Poincianella
pyramidalis) apresentaram o mesmo padrão para a proporção dos tecidos (Tabela 02), a
degradabilidade dos tecidos (Figura 4) e o arranjo anatômico de folíolos e pecíolos
(Figuras 5 a 8).
De acordo com Wilson (1993), as proporções teciduais representam a quantidade
de área ocupada por tecidos de maior ou menor facilidade de degradação, com relação à
espessura de suas paredes e lignificação. Segundo este autor, em uma lâmina foliar, os
diferentes tipos de tecidos não apresentam variações de suas proporções, de acordo com
a idade, no entanto, esclerênquima e tecidos vasculares podem apresentar maior ou
menor proporção de acordo com a região ou inserção foliar.
Tabela 2. Proporção média dos tecidos de folíolos e pecíolos de Poincianella
pyramidalis em diferentes fenofases.
Folíolo
Fenofases
Pecíolo
EPI
MES
PAR
FV
EPI+PAR
FV
Vegetativa inicial
15,16ª
38,31ª
16,39b
30,84ª
35,58ª
64,42ª
Vegetativa plena
14,75ª
38,62ª
17,24ª
30,53ª
37,25ª
62,75ª
Floração
13,05ª
34,25ª
15,98b
30,68ª
32,68ª
67,32ª
Frutificação
14,12ª
37,00a
18,95a
30,55ª
35,26ª
64,82ª
c
30,45ª
35,22ª
64,78ª
19,69
7,72
14,42
Senescência foliar
15,28ª
41,83ª
12,43
Coeficiente de Variação
14,62
14,51
21,65
EPI – epiderme adaxial e abaxial; MES – mesofilo: parênquima paliçádico e esponjoso; PAR–
parênquima de preenchimento medular; EIC+PAR – espaço intercelular + parênquima; FV –
fibras de esclerênquima, elementos de vaso de floema e xilema.
Médias seguidas pela mesma letra, na coluna, não diferem pelo Teste de Tukey (P>0,05).
De modo geral, as características físicas dos tecidos de folíolos e pecíolos de
Catingueira demonstraram haver possibilidade de degradação por microrganismos
ruminais, dentro do que está estabelecido para cada tecido (Akin, 1989; Wilson e
Mertens, 1995). Contudo, a degradação dos fragmentos foliares em ambos os ensaios de
degradação in situ e in vitro por 48h, foi impedida, aparentemente, devido a um
mecanismo de defesa vegetal, visto a presença e alto teor de compostos fenólicos (ver
31
capítulo 3), o qual indica um aspecto adaptativo da planta (Barbehenn e Constabel,
2011). Os flavonóides e taninos presentes na plantas podem sofrer oxidação e causar
morte celular (Taiz e Zeiger, 2009), provocando a formação de uma barreira física o que
parece ter sido impedimento à entrada de microrganismos no interior dos fragmentos.
Além disto, o tempo de 48h de incubação é suficiente para degradar parcialmente até os
tecidos de paredes mais espessas, como esclerênquima e fibras gelatinosas (Akin, 1989;
Wilson e Mertens, 1995; Lima et al, 2001; França et al, 2010).
A
B
C
D
Figura 4.A-D. Folíolo e pecíolo de Poincianella pyramidalis após 48h
de incubação ruminal. A-B. Aspecto dos fragmentos de
folíolos e pecíolos logo após retirada do rúmen indicando
barreira física (setas); C,D. Eletromicrografias de
varredura da superfície externa dos fragmentos folíolo
(C) e pecíolo (D). Barras: A,B= 1 cm; C= 100 µm.; D=500
µm.
A epiderme de folíolos e pecíolos de catingueira é unisseriada (Figura 5A,B), os
estômatos nos folíolos apresentam-se apenas na face abaxial, são do tipo anomocíticos e
estão sobre pequenas câmaras estomáticas (Figura 5C). A cutícula, presente em ambas
as faces da epiderme apresentou 2,26 µm de espessura no início da fase vegetativa
(Figura 5D) e a camada de cera epicuticular pode possuir forma de cristais em locais
diferenciados (Figura 5E). Em geral, os microrganismos podem ter sua entrada
facilitada para o interior dos tecidos, via estômatos ou fissuras no tecido foliar, visto a
32
cutícula ser um forte impedimento à adesão destes (Alves de Brito et al., 1999),
contudo, na forrageira em estudo este mecanismo não foi utilizado, certamente em
virtude do fechamento dos ostíolos no momento de coleta das amostras (Figura5C).
ESC
PP
PAR
PAR
ESC
XIL
PAR
XIL
EPI
FLO
FLO
OP
PP
PE
EPI
PAR
A
B
PE
EPI
E
C
D
E
Figura 5. A-H. Vistas transversais e paradérmicas de folíolos de P. pyramidalis. A. Região da
nervura central. B. Estômato e câmera estomática na epiderme abaxial (seta).
C. Detalhe da camada de cutícula sobre epiderme abaxial. D. Epiderme abaxial
indicando tricomas tectores (seta). E. Camada de cera epicuticular em forma de
cristais. F. Tricoma peduncular. Barras: A,E=500µm; B,C= 20µm; D=10µm. EPI –
Epiderme; PP – parênquima paliçádico; PE – parênquima esponjoso; PAR –
parênquima fundamental; ESC – esclerênquima; FLO – floema; XIL - xilema; FVS –
Feixe vascular secundário;
Detectou-se a presença de tricomas tectores em ambas as faces da epiderme do
folíolo e também do pecíolo (Figura 6 A,B); na Figura 6 C,D percebe-se a ocorrência de
tricomas multicelulares de formato peduncular em folíolos e pecíolos respectivamente,
os quais apesar da morfologia não demonstram característica glandular, visto a
coloração da cabeça não apresentaram reação com sudanblack. Além disto, nos folíolos
este tipo de tricoma, apresentou rompimento quando durante a fase de senescência
foliar, observados tanto em cortes transversais por microscopia ótica (Figura 6E), como
em vista paradérmica por eletromicrografia de varredura (Figura 6F).
33
Ambos os tipos de tricomas, devem ser considerados quanto a sua influência
sobre a palatabilidade da forrageira, tendo em vista sua densidade e tamanho; os
tricomas pedunculados presentes nos pecíolos, como relatados por Queiroz (2009) são
estruturas morfológicas visíveis a olho nu, eles apresentam-se em uma consistência
levemente rígida e em densidade considerável. Portanto, embora não pareçam ser
limitantes diretos à degradação, a lignificação de ambos os tricomas pode contribuir
negativamente no aproveitamento da planta como um todo.
A
B
150 µm
C
E
D
F
Figura 6. A-F. Vistas transversais e paradérmicas de folíolos e pecíolos de P.
pyramidalis. A, B. Tricomas tectores (setas). C,D. Tricoma
peduncular (setas). E,F. Tricoma peduncular rompido (setas).
Barras: A=500µm; B= 200µm; C=300µm. E=200µm, F=50µm.
34
Não há relatos sobre o rompimento de tricomas de qualquer tipo, como o que
ocorreu nesta espécie, este fato pode indicar alguma função fisiológica da planta para o
período ou apenas pode ser resultante de uma infestação por patógenos, portanto, há
necessidade de estudos para elucidações sobre esta estrutura morfológica.
O mesofilo dorsiventral constitui-se de duas camadas de parênquima paliçádico
densamente justapostas, e três ou quatro camadas de células do parênquima esponjoso
com poucos espaços intercelulares (Figura 7A). A proporção deste tecido na região da
nervura central, juntamente com o parênquima medular ocuparam maior área que os
tecidos vasculares (Tabela 02), e devido à presença apenas de paredes primárias (Akin,
1989) destes tecidos isto pode representar bom aproveitamento pelos microrganismos
ruminais.
Ao longo de todo o limbo foliar podem ocorrer vários ductos secretores com até
57 µm de diâmetro, assim como nos pecíolos (Figura 7 B,C). As substâncias produzidas
pelos ductos de folíolos e pecíolos podem ser fenólicas e, ou, óleos essenciais (Fanh e
Cutter, 1992; Apezzato da Glória e Carmello-Carneiro, 2006). A presença de compostos
fenólicos, como os taninos, é de fundamental importância no aproveitamento de
nutrientes como a proteína, mas eles podem ser rapidamente oxidados em folhas
injuriadas, formando quinonas, caracterizadas pela coloração marrom da extremidade
rompida (Barbehenn e Constabel, 2011), fato que pode estar ligado à formação da
barreira física que impede a degradação desta forrageira.
A proporção de parênquima fundamental na região cortical da nervura central
dos folíolos de Catingueira variou significativamente entre as fenofases (Tabela 02), e
apresentou fraca correlação positiva (Tabela 03) com os totais de precipitação em cada
período avaliado, fato que pode estar relacionado à turgidez destes tecidos (Marenco e
Lopes, 2009).
Tabela 03 - Correlação entre a proporção média dos tecidos do folíolo
e os totais de precipitação em milímetros.
mm
p
*<0,05
EPI
-0,13539
0,3867
MES
-0,19883
0,2012
PAR
0,34315*
0.0243
FV
0,08810
0,5743
35
PP
EPI
FVS
EPI
PE
EPI
A
C
B
D
Figura 7. A-D. Vistas transversais de folíolos e pecíolos de P. pyramidalis. A.
Bainha do feixe vascular, células lignificadas (seta). B. Ducto
secretor no limbo foliar (seta) e cristais ao redor das fibras (setas
tracejadas). C. Ductos secretores no pecíolo. D. Parênquima
medular do pecíolo com grânulos de amido (seta). Barras:
A=50µm; B,= 20µm; C=300µm D=20µm. EPI – Epiderme; PP –
parênquima paliçádico; PE – parênquima esponjoso; PAR – parênquima
fundamental; FVS – Feixe vascular secundário.
No pecíolo, o parênquima fundamental encontrado na região cortical ocupou,
juntamente com a epiderme, uma área média de 35%, embora suas células não
desenvolvam parede secundária, a impregnação de lignina, pode tornar este tecido
indigestível (Wilson, 1993). Além disto, podem apresentar monocristais, drusas de
oxalato de cálcio, ductos secretores (Figura 7B) os quais podem se acumular ao longo
do ciclo vegetal, sendo importantes sobre a quantidade de minerais na planta forrageira,
visto que podem passar intactos pelo trato digestivo, mas também, se digeridos,
influenciar a absorção de outros minerais (Alvarez et al., 2010; Nicodemo e Laura,
2001).
A medula parenquimática e córtex dos pecíolos e os tecidos clorenquimáticos do
folíolo, apresentaram de acordo com a fenofase, variada quantidade de grânulos de
36
amido (Figura 7D e 8), fato que pode estar relacionado aos resultados do processo de
fixação fotossintética de C atmosférico; em virtude deste, ocorre normalmente, aumento
na concentração de amido nos cloroplastos que pode representar, no final do período
fotossintético, 10-30% da matéria seca da folha ( Sousa et al., 2005). Em geral o amido
acumulado durante o dia é mobilizado e translocado durante a noite para outras partes
da planta, ocorrendo redução no conteúdo de açúcares da folha, atingindo valores
mínimos próximo ao amanhecer do dia seguinte (Taiz e Zeiger 2009), o que depende de
um sistema de transporte especializado como o floema (Travaglia et al., 2012).
Nas folhas sob condições de semiárido, onde a incidência luminosa é alta, a
proporção de amido observada nas primeiras horas do dia, pode estar relacionada à
estratégia da planta em limitar sua taxa fotossintética como resposta à luminosidade e
temperatura, em vistas a aumentar a eficiência no uso da água, tendo como
consequência o aumento da estocagem de carboidratos (Marenco e Lopes, 2009). Isto
implica, portanto, no conteúdo e composição da fração de carboidratos não estruturais
desta forrageira, favorecendo sua qualidade nutricional.
O sistema vascular dos folíolos é reticulado, tanto a nervura central como as
secundárias são circundadas por células parenquimáticas que formam a endoderme
(bainha do feixe) podendo apresentar monocristais, e ainda paredes lignificadas (Figura
7A). As fibras de esclerênquima possuem paredes celulares altamente lignificadas, com
média de 3,45 µm de espessura (Figura 9A), na região da nervura central dos folíolos,
apresentando-se também em algumas nervuras secundárias.
A área ocupada por feixes vasculares nos folíolos é três vezes maior que a
relatada para leguminosas por Wilson (1993). Silva (2011) demonstrou que a área
ocupada por tecidos vasculares é de 10,8% em duas leguminosas forrageiras adaptadas a
caatinga, Leucaena leucocephala, (Leucena) e Bauhinia cheuilantha (Mororó). Devido
à espessura e lignificação que conferem resistência às paredes destes tecidos, a
proporção destes tecidos implica em baixa degradabilidade da forrageira (Wilson,
1993).
Em média, 30 elementos de vasos de xilema compõem os feixes vasculares da
nervura central, havendo em média 11 grandes vasos com diâmetro médio de 7,68 µm
(Figura 9A). No pecíolo, os vasos de xilema podem variar de 110 a 160 unidades por
pecíolo, havendo em média 45 elementos de diâmetro médio de 17 µm (Figura 9B).
37
A
B
C
D
E
Figura 8. A-E. Histoquímica com Iodo para identificação de amido em
folíolos e pecíolos de Poincianella pyramidalis em
diferentes fenofases. A. Fase vegetativa inicial; B. Fase
vegetativa plena; C. Floração; D. Frutificação; E.
Senescência foliar. (negro=amido). Barras A-E=300 µm
38
Nos pecíolos, os tecidos de sistema vascular ocupam até 70% da área (incluindo
floema que é um tecido de fácil degradação), fato que indica um sistema de condução de
água e fotossimilados bem desenvolvido, mas que, no entanto, representa limitações à
degradação do teor de fibra, como componente nutricional.
Verifica-se que as características do padrão anatômico de catingueira promovem
sua capacidade de adaptação ao ambiente semiárido ao longo de seu ciclo fenológico,
padronizando-a como planta xerófita; além disto, esta espécie apresenta diversos
mecanismos fisiológicos de adaptação às variações climáticas do semiárido (Bahia et
al., 2010).
A proporção e degradação dos tecidos não foram alteradas de acordo com a
maturidade da planta, contudo, a ocorrência e duração dos eventos fenológicos desta
espécie é totalmente dependente condições climáticas, como confirmam Sousa (2011) e
Amorim et al.,(2009).
PAR
XIL
ESC
XIL
FLO
ESC
PAR
PAR
A
B
Figura 9. A-B. Vistas transversais de folíolos e pecíolos de Poincianella
pyramidalis. A. Sistema vascular central detalhe da espessura
das células de esclerênquima e dos cristais entorno destas
(setas). B. Detalhe dos vasos de xilema e cristais em torno de
fibras de esclerênquima no pecíolo (setas). PAR- parênquima;
XIL – xilema; FLO – floema; ESC – esclerênquima. Barras: A=300
µm; B=100 µm.
Portanto, o padrão anatômico de catingueira apresenta características potenciais
à sua degradabilidade, contudo esta degradação depende exclusivamente dos
microrganismos poderem acessá-los, tendo em vista que mecanismos fisiológicos
ligados à defesa da planta impedem o aproveitamento, sendo imprescindível o estudo e
39
a aplicação de técnicas que viabilizem a utilização da planta como forrageira nas áreas
de caatinga.
Adicionalmente, a avaliação histológica da presença de amido, em diferentes
horários, pode ser um indicativo a respeito do seu potencial nutricional, sendo uma
ferramenta para utilização de catingueira como forrageira.
40
CONCLUSÕES
As características anatômicas e a área ocupada pelos tecidos foliares de
Poincianella pyramidalis apresentam o mesmo padrão ao longo do seu ciclo fenológico,
o qual proporciona sua degradabilidade, contudo esta pode ser limitada por aspectos
fisiológicos relacionados à defesa vegetal.
41
REFERÊNCIAS BIBLIOGRÁFICAS
AKIN, D. E. Histological and physical factors affecting digestibility of forages.
Agronomy Journal, v. 81, n. 1, p. 17-25, 1989
AKIN, D. E.; AMOS, H. E. Rumen Bacterial Degradation of Forage Cell Walls
Investigated by Electron Microscopy. Applied Microbiology, v.29, n.5. p. 692-701,
1975
ALVAREZ, J. M. et al., Descritores epidérmicos de eudicotiledôneas forrageiras - Guia
para identificação da dieta de herbívoros usando o programa delta. Corumbá: Embrapa
Pantanal, 2010. 59 p. (Boletim de Pesquisa / Embrapa Pantanal).
ALVEZ DE BRITO, C. J. F. Anatomia Quantitativa e Degradação in vitro de Tecidos
em Cultivares de Capim-Elefante (Pennisetum purpureum Schumach.). Rev. Bras.
zootec., v.28, n.2, p.223-229, 1999
AMORIM, I. L. et al. Fenologia de espécies lenhosas da caatinga do seridó, RN.
Revista Árvore, v.33, n.3, p.491-499, 2009
ANDRADE, A. P., et al. Produção animal no semiárido: o desafio de disponibilizar
forragem, em quantidade e com qualidade, na estação seca. Tecnol. & Ciên.
Agropecuária. v.4, n.4, p.01-14, dez. 2010.
ANDRADE, M.V.A., et al. Levantamento florístico e estrutura fitossociológica do
estrato herbáceo e subarbustivo em áreas de caatinga no cariri paraibano. Caatinga,
v.22, n.1, p.229-237, 2009.
APEZZATO DA GLÓRIA, B.; CARMELLO-GUERREIRO, S. M. Anatomia Vegetal.
Viçosa: UFV, 2006.
ARAUJO FILHO, J.A.; CARVALHO, F.C. Fenologia e valor nutritivo de espécies
lenhosas caducifólias da caatinga. Sobral: Embrapa Caprinos – Centro Nacional de
Pesquisa de Caprinos, 1998 (Comunicado Técnico n. 39).
BAHIA, M.V., et al. Occurrence of biflavones in leaves of Caesalpinia pyramidalis
specimens. Quim. Nova, v. 33, n. 6, p. 1297-1300, 2010.
BAKKE, O.A., et al. Produção e utilização da forragem de espécies lenhosas da
caatinga. In: Gariglio, M.A. et al. Uso sustentável e conservação dos recursos florestais
da caatinga. Brasília: Serviço Florestal Brasileiro, 2010.
BARBEHENN, R.V.; CONSTABEL, C.P. Tannins in plant-hervivore interactions.
Phytochemistry, v.72, p. 1551-1565, 2011.
CASTRO, E.M. Histologia Vegetal: estrutura e função de órgãos vegetativos. Lavras:
UFLA, 2009. 234p.
FAHN, A.; CUTLER, D.F. Xerophytes. Gebrüder Borntraeger. Berlin, 1992. 178p.
42
FRANÇA, A.A., et al. Anatomia e cinética de degradação do feno de Manihot glaziovii.
Acta Scientiarum. Animal Sciences.,v.32, n.2, p.131-138, 2010.
JOHANSEN, D.A. Plant Microtechnique. McGraw-Hill, New York.. 1940. 523p.
KANNABIRAN, B. Morphology and development of foliar epidermis in Stylosanthes
fruticosa (Retz.) Alston (Syn. S. mucromata Willd). Proc. Indian Acad. Sci. v.88, n.2, p.
155-160, 1979
KARNIELI, A. Natural vegetation phenology assessment by ground spectral
measurements in two semi-arid environments. Int. J. Biometeorol v. 47,179-187, 2003
LEMPP, B. Avanços metodológicos da microscopia na avaliação de alimentos. Revista
Brasileira de Zootecnia, v. 36, suplemento especial, p. 315-329, 2007.
LESICA, P; KITTELSON, P. M . Precipitation and temperature are associated with
advanced flowering phenology in a semi-arid grassland. Journal of Arid Environments.
v, 74, p. 1013-1017, 2010.
LIMA, L. M. S., et al.. Degradação ruminal dos tecidos vegetais e composição
Bromatológica de cultivares de Axonopus scoparius (Flüegge) Kuhlm. e Axonopus
fissifolius (Raddi) Kuhlm. Ciência Rural, v. 31, n. 3, p. 509-515, 2001
MARENCO R.A.; LOPES, N.F. Fisiologia Vegetal: fotossíntese, respiração, relações
hídricas e nutrição mineral. Viçosa: UFV, 2009.
NICODEMO, M. L. F.; LAURA V. A. Elementos minerais em forrageiras: formas
químicas, distribuição e biodisponibilidade. Campo Grande: Embrapa Gado de Corte,
2001. (Documento, 115).
NOY-MEIR, I. Desert Ecosystems: Environment and Producers. Annual Review of
Ecology and Systematics., v.4, 25-51, 1973
QUEIROZ, L. P. Leguminosas da Caatinga. 1. ed. Feira de Santana: Universidade
Estadual de Feira de Santana, 2009. v. 1. 443 p.
SAMPAIO, E.V.S.B. Caracterização do Bioma Caatinga: Características e
Potencialidades. In: GARIGLIO, M.A. et al.(Ed). Uso sustentável e conservação dos
recursos florestais da caatinga. Brasília: Serviço Florestal Brasileiro, 2010.
SANTOS, G.R.A., et al. Determinação da composição botânica da dieta de ovinos em
pastejo na Caatinga. R. Bras. Zootec., v.37, n.10, p.1876-1883, 2008.
SANTOS, M.V.F., et al. Potential of Caatinga forage plants in ruminant feeding. R.
Bras. Zootec., v.39, p.204-215, 2010 (supl. especial).
SILVA, M.A. Caracterização de leguminosas arbustivo-arbóreas em Pernambuco. Tese
(Doutorado em Zootecnia) – Universidade Federal Rural de Pernambuco, 2011. 129 p.
43
SOUSA, D. M. M. Fenologia, avaliação do tubo polínico e maturação de frutos e
sementes de Poincianella pyramidalis (Tul.) L.P. Queiroz. (Tese de Doutorado), Areia:
UFPB, 2011. 117p.
SOUSA, A., et al. Diurnal variations of non-structural carbohydrates in vegetative
tissues of Melinis minutiflora, Echinolaena inflexa and Lolium multiflorum (Poaceae).
Revista Brasil. Bot., V.28, n.4, p.755-763, 2005
STATISTICAL ANALYSES SYSTEM - SAS. Users´ guide. Cary: SAS. Institute Inc.,
1997. 156p.
TAIZ, L.; ZEIGER, E. Fisiologia Vegetal. 4 ed. Porto Alegre: Artmed, 2009. 848p.
TRAVAGLIA, C., et al. ABA action on the production and redistribution of fieldgrown maize carbohydrates in semiarid regions. Plant Growth Regulation. DOI
10.1007/s10725-012-9657-7 Disponível em: www. Acesso em: 2012
VAN SOEST, P. J. Nutritional ecology of the ruminant. 2. ed. Ithaca: Cornell
University Press, 1994.
WILSON, J. R. Temperature effects on anatomy and digestibility of leaf and steam of
tropical and temperate forage species. Netherlands Journal of Agr. Science, v.39. p. 3148, 1991
WILSON, J. R. Organization of forage plant tissue. In: JUNG, H. G.; BUXTON, D. R.;
HATFIELD, R. D.; RALPH, J. (Ed.). Forage cell wall structure and digestibility.
Madison: ASA/CSSA/SSSA, 1993. p. 1-32.
WILSON, J. R.; MERTENS, D. R. Cell wall accessibility and cell structure limitations
to microbial digestion of forage. Crop Science, v. 35, n. 1, p. 251-259, 1995
44
CAPÍTULO III
Composição Química e Degradabilidade de Poincianella pyramidalis
(Tul.) L. P. Queiroz em Diferentes Fases Fenológicas
45
Composição Química e Degradabilidade de Poincianella pyramidalis (Tul.) L. P.
Queiroz em Diferentes Fases Fenológicas
RESUMO
Poincianella pyramidalis é uma planta nativa da caatinga, forrageira, cuja
potencialidade nutricional deve ser avaliada para proporcionar sua utilização racional
pelos produtores do semiárido. O objetivo desta pesquisa foi avaliar a composição
bromatológica, os compostos secundários e a degradabilidade de Poincianella
pyramidalis em diferentes fenofases relacionadas à precipitação hídrica. Os períodos de
avaliação foram marcados pelo total de precipitação, onde se determinou as seguintes
fenofases: vegetativa inicial, vegetativa plena, floração, frutificação e senescência foliar.
A cada período coletou-se amostras compostas por folhas e galhos de até 0,5 cm de
diâmetro, ao longo de toda a circunferência da copa de três plantas, a uma altura média
de 1,5 m. Realizou-se a determinação da composição química (matéria seca, matéria
mineral, proteína bruta, fibra em detergente neutro, fibra em detergente ácido, celulose,
hemicelulose e lignina), do teor de taninos, e da degradabilidade in situ por 48h de
matéria seca e fibra em detergente neutro. Utilizou-se um pool das amostras para
detecção da presença de esteróides, taninos e flavonóides, estes últimos foram
confirmados através da ressonância magnética nuclear. Os dados de composição
química e degradablidade foram analisados quanto à variância entre as fenofases e suas
médias comparadas pelo teste de Tukey a 5% de probabilidade. Efetuou-se análise de
correlação, entre os valores de composição química e percentuais de degradabilidade in
situ com a quantidade em milímetros do total de precipitação em cada período avaliado.
Constatou-se que o teor de matéria seca das plantas de catingueira está em função do
total de precipitação hídrica de cada fenofase, enquanto os teores de proteína bruta,
matéria mineral e fibra em detergente neutro variam de acordo com suas características
fisiológicas em cada fenofase. A degradabilidade dos componentes da parede celular é
afetada pelo alto teor de taninos e lignina, e as presenças de taninos, flavonóides e
biflavonóides indicam a alta adaptação da espécie ao semiárido e deve ser considerada
quanto aos seus potenciais anti nutricionais.
Palavras-chave: forrageira nativa; lignina; maturidade; nutrientes; taninos
46
Chemical Composition and Degradability of Poincianella pyramidalis (Tul.) L. P.
Queiroz in Different Phenological Phases
ABSTRACT
Poincianella pyramidalis is a native forage plant from the Caatinga. The study of its
nutritious potential relating them to the environmental conditions may contribute to the
better rational usage by the producers in the semiarid. It was aimed to evaluate its
bromatological composition, the secondary compounds, and the degradability in situ in
five seasons characterized by different rainfall amount and phenological phases,
respectively: initial vegetative, full vegetative, flowering, fructification, and senescence.
Samples composed by leaves and branches, at most 0.5cm of diameter, were collected
every season along the circumference of the crown of three plants in an average height
of 1.5m. The chemical composition was determined, the tannins content, and the
degradability in situ of dry matter and fiber in neutral detergent for 48 hours. By the
phytochemical prospecting, the presence of steroids, tannins and flavonoids was
detected; these flavonoids were confirmed by NMR by ¹H and ¹³C. The variation
between the average rates of each season was compared by the Tukey’s test at 5%; it
was performed the analysis of correlation of these variations with the total amount of
rain in millimeters in each season. The differences between the dry matter contents
show correlation with the total rainfall amount, while the contents of crude protein,
mineral matter and fiber in neutral detergent ranged according to the maturity of the
plants. The degradability of the compounds of the cell wall decreased along the seasons.
The high tannin and lignin contents, and the presence of flavonoids and biflavonoids
must be considered in their anti-nutritional potentials.
Keywords: lignin, maturity, native forage; nutrients, tannins
47
INTRODUÇÃO
Muitas espécies forrageiras, em todos os estratos da caatinga, têm sido avaliadas
quanto ao seu potencial nutricional e estratégias de uso na alimentação animal. Embora
apresentem sazonalidade, a produção de fitomassa durante o período chuvoso pode ser
melhor aproveitada se conservada na forma de feno e ou silagem (Soares, 2000; Santos
et al.,2010).
A espécie Poincianella pyramidalis, conhecida popularmente como Catingueira,
é uma leguminosa arbustiva, endêmica da Caatinga com características morfofisiológicas promotoras de sua tolerância ao ambiente semiárido, dentre eles a
caducifolia - perda das folhas na época seca. É uma planta de crescimento rápido e com
alta capacidade de rebrota, podendo ser uma importante fonte de forragem na época
seca, quando os demais estratos vegetais já estiverem escassos (Queiroz, 2009).
De acordo com Araújo Filho e Carvalho (1988), esta planta é preferida pelos
ruminantes na última fase de seu ciclo fenológico. Seu potencial nutricional dá-se
principalmente pelos elevados teores de proteína, contudo, também é alto o teor de
taninos. Apesar disto, também há relatos do consumo desta planta quando ainda verde
(Queiroz, 2009).
A maturação do vegetal, ao longo do desenvolvimento de seu ciclo fenológico,
proporciona variações no teor de nutrientes, em face da mobilização destes entre os
órgãos da planta; além disto, as condições ambientais como precipitação hídrica,
temperatura e fertilidade do solo, também podem interferir nos processos metabólicos
do vegetal, alterando a composição química das plantas (Reis et al., 2006; Taiz e Zeiger,
2009). Estes aspectos apresentam grande relevância em pastagens nativas da caatinga,
pois as particularidades climáticas do clima semiárido são preponderantes no
desencadeamento da periodicidade fenológica dos vegetais (Noy Meir, 1973; Karnieli,
2003), como também, do desenvolvimento de mecanismos fisiológicos de adaptação e
defesa, os quais comprometem o consumo e o aproveitamento das forrageiras pelos
animais.
Dentre os mecanismos de defesa vegetal está a produção de compostos
secundários; entre esses, os fenólicos, como lignina e taninos, apresentam-se em grande
quantidade nas plantas, mas ainda, flavonóides podem estar significativamente
48
presentes. Além de promoverem limitações à nutrição animal, estes últimos, juntamente
com terpenóides podem ser absorvidos e transferidos para os produtos alterando suas
características organolépticas, como relatado por Feo et al. (2006). Compostos fenólicos
em geral podem ser auto oxidados e limitar a digestão no interior do rúmen auxiliados
por outros mecanismos de defesa vegetal (Taiz e Zeiger, 2009; Barbehenn e Constabel,
2011).
A lignina exerce sua função secundária nas plantas ao interferir na degradação
dos demais compostos da parede celular pelos microrganismos ruminais (Jung e Vogel,
1986; Grabber, 2005). E os taninos, polímeros fenólicos de alto peso molecular,
complexam-se com proteínas e outras macromoléculas provocando efeitos positivos ou
negativos aos ruminantes, de acordo com sua quantidade na dieta animal (Muir, 2011).
A avaliação conjunta dos fatores que interferem na qualidade das plantas
forrageiras da caatinga é complexa, pois está em função de muitas variáveis; a
padronização de seus fatores qualitativos exige a soma de esforços das diversas áreas do
conhecimento em busca de potencializar o uso desta pastagem e ainda manter os seus
recursos.
O objetivo desta pesquisa foi avaliar a composição química, compostos
secundários e a degradabilidade de Poincianella pyramidalis em diferentes fenofases
relacionadas à precipitação hídrica.
49
MATERIAL E MÉTODOS
A pesquisa foi realizada em uma área de Caatinga da Estação Experimental da
UFPB, no município de São João do Cariri-PB, a qual é caracterizada por médias
históricas anuais de umidade relativa do ar, temperatura e precipitação de 71,8%, 25,6ºC
e 517 mm respectivamente. A distribuição destes índices durante o período de avaliação
(janeiro a agosto de 2010), obtidos diariamente na Bacia Escola da estação, integrante
da Área de Engenharia de Recursos Hídricos da Universidade Federal de Campina
Grande (UFCG) é apresentada na Figura 1.
Foram selecionadas ao acaso três plantas de Catingueira para coleta de amostras
para análises de determinação da composição química e degradabilidade in situ. As
coletas foram realizadas em cinco períodos, distintos pelas fenofases: 1 - vegetativa
inicial, 2 - vegetativa plena, 3 – início da floração, 4 – início da frutificação e 5 senescência foliar, as quais estiveram em função dos seguintes quantitativos de chuva
em milímetros: 126,5; 46,7; 75,4; 156,7; 19,4, respectivamente.
Amostras compostas por folhas e galhos de até 0,5 cm de diâmetro, coletadas ao
longo de toda a circunferência da copa de cada planta, a uma altura média de 1,5 m. Os
detalhes da planta inteira e das folhas são apresentados na Figura 2.
Para análise do teor de nutrientes, após secas em estufa de ventilação forçada a
65°C por 72h, as amostras foram moídas e preparadas para determinação de matéria
seca (MS), matéria mineral (MM), proteína bruta (PB), fibra em detergente neutro
(FDN) com e sem o uso de amilase, fibra em detergente ácido (FDA), celulose,
hemicelulose e lignina de acordo com metodologias descritas por Silva e Queiroz
(2002), as quais foram efetuadas no Laboratório de Nutrição Animal do CCA/UFPB.
50
Figura 1. Totais diários de precipitação de chuva (mm), temperatura (ºC) e umidade
relativa do ar - URA (%), ocorridas na estação experimental de São João do
Cariri-PB, no período de janeiro a agosto de 2010.
Poincianella pyramidalis
Figura 2. Vista geral e detalhe das folhas de Poincianella pyramidalis.
Avaliou-se a degradabilidade ruminal in situ de catingueira em cada período,
utilizando-se um caprino adulto fistulado no rúmen; adotou-se o tempo de 48h para
incubação das amostras. Foram acondicionadas em sacos de tecido não tecido (TNT),
0,5g das amostras moídas a 2 mm, os quis após a incubação, foram retirados, lavados e
secos em estufa de ventilação forçada a 105°C, pesados, e posteriormente submetidos à
51
lavagem em detergente neutro. Determinaram-se as degradabilidades de MS e FDN
pela proporção de seu desaparecimento na amostra (Casali et al., 2009).
A avaliação da presença de compostos secundários foi realizada no Laboratório
de Tecnologia Farmacêutica CCS/UFPB, utilizando-se um pool de todos os períodos de
cada leguminosa. Foi realizado um prospecção fitoquímica para detecção da presença
(+) ou ausência (-) de alcalóides, terpenos, taninos e flavonóides, sendo a abundância
expressa pela quantidade de sinais. Realizou-se uma análise de ressonância magnética
nuclear (RMN) de 1H e 13C em aparelho Varian Mercury 200 [200 MHz (1H) e 50 MHz
(13C)] sobre o extrato bruto do pool (todas as fenofases) de Catingueira para detecção de
flavonóides; para isto 30mg foram diluídas em 0,6 mL de metanol deuterado e o
tetrametilsilano (TMS) foi utilizado como referência interna.
A análise do teor de fenóis totais foi realizada no Laboratório de Bioquímica
Vegetal do Departamento de Química Agrícola da UFRPE, de acordo com o método de
Folin-Denis com o uso de Polivinilpirrolidona (PVP) de acordo com Bezerra Neto e
Barreto (2011).
Os dados de composição química e degradabilidade foram analisados quanto à
variância entre os períodos e ao nível de 5% de significância pelo teste de Tukey.
Efetuou-se análise de correlação, entre os valores de composição química e percentuais
de degradabilidade in situ com a quantidade em milímetros do total de precipitação em
cada período avaliado, utilizando-se o SAS.
52
RESULTADOS E DISCUSSÃO
As diferenças encontradas para o teor de MS nas diferentes fenofases de
Catingueira foram atribuídas principalmente à precipitação hídrica de cada período, as
quais se correlacionaram negativamente (r= -0,5; p>0,05). O teor de MS das forrageiras
está em função da quantidade de água contida em diversos tecidos, a qual varia
principalmente com as condições de umidade de solo e do ar, da temperatura e das taxas
fotossintéticas e de respiração da planta, mas também varia com o desenvolvimento e
atividades metabólicas das plantas (Buxton e Fales, 1994; Marenco e Lopes, 2009).
As plantas de Catingueira apresentaram aumento significativo na concentração
de minerais entre as fenofases, sendo maior nas duas últimas; o que pode estar
relacionado principalmente ao acúmulo ao longo do tempo de oxalato de cálcio, em
vista de sua baixa mobilidade, e também de sílica (Van Soest, 1994; Webb, 1999;
Nicodemo e Laura, 2001; Currie e Perry, 2007).
A proporção de proteína encontrada nas plantas de Catingueira foi inferior aos
valores relatados na literatura, variando de 13 a 8,6% da fase vegetativa à senescência
foliar, fato este, relacionado à maior mobilidade de N dentro da planta, durante suas
fenofases, e de sua concentração e disponibilidade no solo (Marenco e Lopes, 2009).
Tal variação também foi observada por Araújo Filho e Carvalho (1998), cujos teores de
PB variaram de 17 a 11% da fase vegetativa à senescência.
O teor de proteína bruta encontrado nas fases de floração e frutificação foi de
10%; em geral, recomenda-se o início do período reprodutivo para o corte de forrageiras
a serem utilizadas para conservação (Guim et al., 2004), tendo em vista que este
nutriente pode ser redistribuído para os órgãos reprodutivos e ainda para os órgãos de
reserva da planta, antes da queda das folhas. Deste modo, Gonzaga Neto, et al. (2001) e
Mendonça Jr. et al.
(2008) encontraram teores de PB de 11,25% e 12,31%,
respectivamente, para o feno de catingueira confeccionado durante a fase de
frutificação, valores próximos àqueles tabelados por Valadares Filho (2006).
53
Tabela 1. Porcentagem de nutrientes, taninos e degradabilidade in situ de MS e FDN de
Poincianella pyramidalis em diferentes fenofases.
Variáveis
g/kg Ms
Vegetativa
Inicial
Vegetativa
Plena
MS
502,4b
497,1b
MM
56,8
b
a
60,9
b
412,5d
59,1
b
64,6
ab
1,94
77,2ª
8,39
c
8,58
FDN s/amilase
452,4ª
476,1ªb
451,8ªb
435,1ªb
392,6c
3,67
FDN c/amilase
466,7
a
ab
ab
bc
352,8
c
3,67
299,7
a
308,2
a
298,0ª
6,74
177,0
a
213,2
a
255,1ª
17,52
118,6
a
a
166,8
a
Taninos
259,3
a
Deg MS
572,5ª
588,4ª
a
a
Lignina
Celulose
Hemicelulose
87,3
129,2
ab
191,1
a
421,9
102,5
bc
557,9a
130,3
430,1
104,7
bc
453,8c
C.V
PB
FDA
123,3
ab
Início
Início
Senescência
Floração Frutificação
foliar
387,1
294,9
a
285,8
a
161,8
a
226,7
a
138,9
a
b
44,1
40,3
b
19,73
c
17,92
ab
63,4
a
147,8ª
17,39
550,9ª
591,3ª
586,0ª
4,51
ab
ab
b
123,2
ab
86,7
200,7
a
101,1
185,3
Deg FDN
325,5
295,8
287,0
256,3
166,6
16,97
MS - Matéria Seca; PB - Proteína Bruta; FDN - Fibra em Detergente Neutro; FDA - Fibra em
Detergente Ácido; MM - Matéria Mineral; DegMS – Degradabilidade de MS; DegFDN Degradabilidade de FDN. C.V – Coeficiente de variação. Médias seguidas da mesma letra na mesma
linha, não diferem entre si pelo teste de Tukey (p > 0,05).
A concentração de FDN, ao contrário do esperado, tende a diminuir ao longo do
ciclo fenológico (Tabela 1), verifica-se o menor teor de FDN, quando as folhas
encontram-se em senescência. Com exceção da primeira fase, os resultados de análises
com e sem o uso de amilase, demonstraram uma redução média de 4% da primeira para
a segunda análise, percentual que pode representar resíduos de carboidratos não
estruturais insolúveis, como o amido, os quais dependendo da concentração na amostra
afetam a determinação real dos componentes da parede celular (Van Soest, 1994, Hall,
2003), sobre este fato, observar relações apontadas no capítulo 2, quanto à presença de
grânulos de amido nas folhas e pecíolos.
Os mecanismos fisiológicos envolvidos nesta fase, como a produção de etileno e
ácido abscísico, tem importante efeito sobre o afrouxamento das paredes celulares nos
tecidos senescentes (Taiz e Zeiger, 2009; Piotrowska e Bajguz, 2011), o que pode
implicar na mobilização destes carboidratos para reserva vegetal, reduzindo a qualidade
da forragem. Observou-se redução dos valores de celulose e hemicelulose em função do
aumento de lignina (Tabela 1), a qual contribuiu para baixa degradabilidade da fração
de FDN ao longo das fenofases.
54
Os valores de lignina foram elevados em todas as fases avaliadas, de acordo com
Apezzato da Glória e Carmello Guerreiro (2006), o conteúdo de lignina pode
representar até 35% da parede celular, contudo, os altos valores de tanino (Tabela 1),
além de proteínas da parede celular, podem se ligar à lignina superestimando seus
valores reais (Van Soest, 1994).
Os valores de degradabilidade de MS (Tabela 1) não variaram ao longo dos
estágios fenólogicos, enquanto a degradação da FDN diminuiu em relação às fases. Não
houve correlação entre os totais de precipitação hídrica de cada fenofase e a degradação
de MS e FDN.
Em média, a degradabilidade in situ de MS foi mais alta que a digestibilidade in
vitro tabelada por Valadares Filho (2006). Em Catingueira, a digestibilidade in vitro de
MS pode variar de 58 a 50% da fase vegetativa à reprodutiva e reduzir a 30% na
senescência (Araújo Filho e Carvalho, 1998). O feno de catingueira na frutificação,
avaliado por Gonzaga et al., (2001) apresentou 50,5% de digestibilidade de MS e 41,7%
de digestibilidade de FDN.
Através de prospecção fitoquímica, foi detectada a presença, de duas classes
principais de compostos secundários: terpenos e compostos fenólicos (Tabela 2). A
quantidade de sinais (+) indica a intensidade da presença do composto na amostra.
Verificou-se a presença de esteróides, constituintes de óleos essenciais;
esteróides e saponinas podem afetar as características organolépticas do leite e seus
derivados (Belviso et al., 2011). Esses compostos podem agir como hormônios vegetais,
podendo atuar como toxinas e inibidores do forrageio pelas espécies herbívoras (Cheng
et al., 2007).
As saponinas, cuja presença não foi detectada nas plantas de Catingueira, são
importantes agentes de defesa vegetal, por complexarem-se aos componentes esteróides,
proteínas e fosfolipídeos das membranas de fungos e protozoários ruminais, por
exemplo, desestruturando-os, além de impedirem o crescimento de bactérias gram
positivas da flora ruminal (Garcia e Carril, 2009; Lima Jr, et al., 2010), acarretando
portanto, em perdas ao processo de degradação dos alimentos.
55
Tabela 2. Presença ou ausência de compostos secundários em extrato bruto de
Poincianella pyramidalis
Poincianella pyramidalis
Alcalóides
Esteróides
+
Saponinas
-
Flavonóides
Taninos
+++
+
Dentre os compostos fenólicos estão presentes flavonóides e taninos, alguns
tipos de flavonóides são precursores de taninos condensados (Van Soest, 1994). O teor
de taninos totais em catingueira, de acordo com Araújo Filho e Carvalho (1998) é
considerado alto, decrescendo de 20 a 16% do crescimento vegetativo à frutificação,
caindo para 9% na fase de senescência; Neste trabalho, embora não diferentes
significativamente, os valores do teor de taninos apresentam uma tendência de
diminuição ao longo das fenofases avaliadas. A variação no teor de taninos entre
espécies, indivíduos e suas fenofases, tem relação com a pressão de herbivoria e as
condições ambientais que influenciam o investimento das plantas na produção destes
compostos, principalmente quando as condições de crescimento, como umidade e
nutrientes do solo, são limitantes (Muir, 2011; Barbehenn e Constabel, 2011)
Os taninos influenciam a qualidade das forrageiras principalmente pela
adstringência que pode afetar a palatabilidade e o consumo das plantas verdes (Muir,
2011), e por limitações no aproveitamento da forrageira pela ligação com proteínas e
outras macromoléculas, como os componentes da parede celular (Reed, 1995; Barry e
MacNabb, 1999), fato que pode ter contribuído para baixa degradabilidade da fração de
FDN. A quantidade de taninos pode ter forte relação com a quantidade de proteína
protegendo-a da degradação no rúmen. Os relatos de estudos sobre o efeito de taninos
condensados na ingestão e digestibilidade de forrageiras nativas, apontam variações
entre 4 e 8% para a quantidade mínima negativa de taninos na dieta (Barry, 1984; Barry
e Duncan, 1985; Cruz et al. 2007; Muir, 2011).
A presença de flavonóides é intensa (Tabela 03), cuja presença é relatada por
Bahia et al., (2010) e Bahia et al., (2005); o extrato de catingueira em estudo também
mostrou-se rico em flavonóides através da análise por RMN 1H evidenciaram-se
absorções entre 6,1 e 6,3, características do Anel A de flavonóides e entre δH 7,06 e 7,50
56
características do Anel B de flavonóides (Figura 3). Além disso, nesse mesmo espectro
observou-se sinais entre δH 3,0 e 5,3 compatíveis com unidades osídicas comuns em
Fabaceae. Por se tratar de análise de extrato bruto com dificuldade de interpretação dos
sinais, decidiu-se fazer uma análise de carbono treze sendo possível observar dados
também compatíveis com flavonóides e unidades osídicas, sendo eles: deslocamento
químico em δC 183,9 atribuído a C-4, conjunto de sinais em δC 168,8 a 157,2
característicos dos carbonos C-2, C-5, C-7 e C-9 da unidade benzopirano dos
flavonóides. Observaram-se também sinais entre δC 133,6 e 112,9 característicos de
carbonos sp2 de flavonóides. Sinais norteadores e que corroboram com deslocamentos
químicos de flavonóides foram observados em δC 96,6 e 100. Ambos CH compatíveis
com deslocamentos de C-6 e C-8 e os sinais em δC 106,5,105,5 e 101,8 carbonos não
hidrogenados que corroboram de acordo com a literatura para fusão de unidades
flavonóidicas (Figura 4) (Bahia et al., 2005).
A presença de biflavonóides é rara em espécies de leguminosas (Bahia et al.,
2010) sendo importante a avaliação destes compostos e suas interelações no ecossistema
de pastagem para o entendimento de seus potenciais de utilização.
A presença dos compostos secundários, em geral, deve ser considerada por suas
características antinutricionais e potenciais medicinais; conhecer e determinar a
presença e quantidade de compostos fenólicos, como os flavonóides e taninos, é
importante ainda, pois ambos podem ser rapidamente oxidados, no momento em que a
planta é injuriada pela mastigação ou corte, formando barreiras físicas nestas superfícies
que impedem a degradação (Barbehenn e Constabel, 2011).
Assim, as concentrações de lignina e demais compostos secundários são um
importante fator na utilização de catingueira como forrageira, sendo importante o estudo
das formas de fornecimento desta forrageira e seus resultados em desempenho animal,
tendo em vista a aproveitar de maneira sustentável os recursos naturais da caatinga.
57
OH
OH
C
B
HO
O
D
E
A
OH
O
Figura 3 – Espectro de RMN 1H de Poincianella pyramidalis [ 200 MHz, CD3OD]
58
Figura 4 – Espectro de RMN 13C de Poincianella pyramidalis [50 MHz, CD3OD]
59
CONCLUSÕES
A maturidade de Poincianella pyramidalis influencia a variação dos teores de
matéria mineral, proteína bruta e fibra em detergente neutro, enquanto os valores de
matéria seca estão associados à disponibilidade hídrica em cada fenofase. A presença de
compostos fenólicos como flavonóides e biflavonóides, o alto teor de taninos e lignina
ao longo das fenofases devem ser consideradas quanto aos seus potenciais anti
nutricionais, os quais podem afetar a degradabilidade dos componentes da parede
celular.
60
REFERENCIAS BIBLIOGRÁFICAS
ANDRADE, M.V.M., et al. Levantamento florístico e estrutura Fitossociológica do
estrato herbáceo e subarbustivo em Áreas de caatinga no cariri paraibano. Revista
Caatinga, v.22, n.1, p.229-237, 2009.
APEZZATO DA GLÓRIA, B.; CARMELLO-GUERREIRO,S. M. Anatomia Vegetal.
Viçosa: UFV, 2006.
ARAUJO FILHO, J.A.; CARVALHO, F.C. Fenologia e valor nutritivo de espécies
lenhosas caducifólias da caatinga. Sobral: Embrapa Caprinos – Centro Nacional de
Pesquisa de Caprinos, 1998 (Comunicado Técnico n. 39).
BAHIA, M. V., et al. Biflavonoids and other Phenolics from Caesalpinia pyramidalis
(Fabaceae) J. Braz. Chem. Soc., v. 16, n. 6B, p. 1402-1405, 2005.
BAHIA, M. V., et al. Occurrence of biflavones in leaves of Caesalpinia pyramidalis
specimens. Quim. Nova, v. 33, n. 6, p. 1297-1300, 2010.
BARBEHENN, R.V.; CONSTABEL, C.P. Tannins in plant-hervivore interactions.
Phytochemistry v.72, p. 1551-1565, 2011.
BARRY T.N.; MC NABB, W.C. The implications of condensed tannins on the nutritive
value of temperate forages fed to ruminants. British Journal of Nutrition, v. 81, p. 263–
272, 1999.
BARRY, T. N., et al. The role of condensed tannins in the nutritional value of L.
pedunculatus for sheep. 3. Rates of sheep. 1, Voluntary intake. British Journal of
Nutrition, v. 51, n. 3, p. 485-491, 1984.
BARRY, T. N.; DUNCAN, S. J. The role of condensed tannins in the nutritional value
of L. pedunculatus for body and wool growth. British Journal of Nutrition, v. 54, n. 1, p.
211-217, 1985.
BELVISO, S., et al. Degradation and biosynthesis of terpenoids by lactic acid bacteria
isolated from cheese: first evidence. Dairy Science & Technology. v. 91, p.227–236,
2011.
BEZERRA NETO, E.; BARRETO, L.P. Análises Químicas e Bioquímicas em Plantas.
Recife: Editora Universitária da UFRPE, 2011. 267p .
BUXTON, D. R.; FALES, S.L. Plant Environment and Quality In: FAHEY, G.C et al.
(Ed). National Conference on Forage Quality Evaluation and Utilization. Lincoln:
University of Nebraska, 1994. p.155-199
61
CASALI, A.O., et al. Estimação de teores de componentes fibrosos em alimentos para
ruminantes em sacos de diferentes tecidos. R. Bras. Zootec., v.38, n.1, p.130-138, 2009
CHENG A.X., et al. Plant terpenoids: Biosynthesis and ecological functions. J. Integr.
Plant Biol. v.49, n. 2, p.179−186, 2007.
CRUZ, S.E.S.B.S.; et al. Caracterização dos taninos condensados das espécies
maniçoba (Manihot pseudoglazovii), flor-de-seda (Calotropis procera), feijão-bravo
(Capparis flexuosa, L) e jureminha (Desmanthus virgatus). Arquivo Brasileiro de
Medicina Veterinária e Zootecnia, v. 59, n. 4, p. 1038-1044, 2007.
CURRIE, H.A.; PERRY, C.C. Silica in Plants: Biological, Biochemical and Chemical
Studies. Annals of Botany. v.100, p. 1383–1389, 2007.
FEO, V de., et al. Flavonoids and terpenoids in goat milk in relation to forage intake.
Ital. J. Food Sci. v. 18, n. 1, 2006.
GARCIA, A.A.; CARRIL, E.P. Metabolismo secundario de plantas. Reduca (Biología).
Serie Fisiología Vegetal. v.2, n.3, p.119-145, 2009.
GONZAGA, S.N., et al. Composição bromatológica, consumo e digestibilidade in vivo
de dietas com diferentes níveis de feno de Catingueira (Caesalpinea bracteosa)
fornecidas para ovinos Morada Nova. Rev. Bras. Zootec., v.30, n2, p.553-562, 2001.
GONZAGA, S.N., et al. Efeito da Adição de Feno de Catingueira (Caesalpinea
bracteosa) na Ração sobre o Balanço de Energia e de Nitrogênio em Ovinos Morada
Nova. Rev. Bras. Zootec., v.33, n.5, p.1325-1331, 2004.
GRABBER, J.H. How Do Lignin Composition, Structure, and Cross-Linking Affect
Degradability? A Review of Cell Wall Model Studies. Crop Sci., v.45, p. 820–831,
2005.
GUIM, A.; et al.,. Estratégias alimentares para caprinos e ovinos no semi-árido. In: I
Simpósio Internacional de Conservação de Recursos Genéticos de Caprinos e Ovinos,
2004, Recife. Anais... Recife: UFRPE, p.73-102, 2004
HALL, M.B. Challenges with nonfiber carbohydrate methods. J. Anim. Sci. 2003.
81:3226–3232, 2003
JUNG, H.G.; VOGEL, K.P. Influence of lignin on digestibility of forage cell wall
material. J. Anim. Sci. v.62, p.1703-1712, 1986.
KARNIELI, A. Natural vegetation phenology assessment by ground spectral
measurements in two semi-arid environments. Int. J. Biometeorol v. 47,179-187, 2003
LIMA JR. D. M. et al. Fatores anti-nutricionais para ruminantes. Acta Veterinaria
Brasilica, v.3, n.4, p.132-143, 2010.
62
MARENCO R.A.; LOPES, N.F. Fisiologia Vegetal: fotossíntese, respiração, relações
hídricas e nutrição mineral. Viçosa: UFV, 2009.
MENDONÇA JR., A.F.; et al. Composição bromatológica, consumo e digestibilidade in
vivo de dietas com diferentes níveis de feno de catingueira (Caesalpinea pyramidalis
Tul), fornecidas para ovinos SRD. Revista de Biologia e Ciências da Terra, v.8, n.1,
p.190-197, 2008.
MUIR, J.P. The multi-faceted role of condensed tannins in the goat ecosystem. Small
Ruminant Research. v. 98, p. 115–120, 2011.
NICODEMO, M. L. F.; LAURA V. A. Elementos minerais em forrageiras: formas
químicas, distribuição e biodisponibilidade. Campo Grande: Embrapa Gado de Corte,
2001. (Documento, 115).
NOY-MEIR, I. Desert Ecosystems: Environment and Producers. Annual Review of
Ecology and Systematics., v.4, 25-51, 1973
PIOTROWSKA, A.; BAJGUZ, A. Conjugates of abscisic acid, brassinosteroids,
ethylene, gibberellins, and jasmonates. Phytochemistry, v.72, p.2097–2112, 2011.
QUEIROZ, L. P. Leguminosas da Caatinga. 1. ed. Feira de Santana: Universidade
Estadual de Feira de Santana, 2009. v. 1. 443 p.
REED, J.D. Nutritional toxicology of tannins and related polyphenols in forage
legumes. Journ. Anim Sci. v.73, p.1516-1528, 1995.
REIS, R.A., et al. Impacto da qualidade da forragem na produção animal. In: 43ª
Reunião Anual da Sociedade Brasileira de Zootecnia. Anais...,João Pessoa: SBZ, UFPB,
2006
SANTOS, M.V.F. et al. Potential of Caatinga forage plants in ruminant feeding. R.
Bras. Zootec., v.39, p.204-215, 2010 (supl. especial)
SILVA, D. J.; QUEIROZ. A. C. Análise de alimentos: métodos químicos e biológicos.
3 ed. Viçosa: UFV, 2002
SOARES, J. G. G. Avaliação da silagem de maniçoba – Teor de ácido cianídrico.
Petrolina: Embrapa-Semiárido, 2000. (Embrapa-Semiárido, Comunicado Técnico, n.
93).
STATISTICAL ANALYSES SYSTEM - SAS. Users´ guide. Cary: SAS. Institute Inc.,
1997. 156p.
TAIZ, L.; ZEIGER, E. Fisiologia Vegetal. 4 ed. Porto Alegre: Artmed, 2009. 848p.
VALADARES FILHO, S.C., et al. Tabelas Brasileiras de Composição de Alimentos
para Bovinos. 2 ed.Viçosa: UFV, 2006.
63
VAN SOEST, P. J. Nutritional ecology of the ruminant. 2. ed. Ithaca: Cornell
University Press, 1994.
WEBB, M.A. Cell-Mediated Crystallization of Calcium Oxalate in Plants. The Plant
Cell. v. 11, p. 751–761, 1999
WILSON, J. R.; MERTENS, D. R. Cell wall accessibility and cell structure limitations
to microbial digestion of forage. Crop Science, v. 35, n. 1, p. 251-259, 1995.
64
CONSIDERAÇÕES FINAIS E IMPLICAÇÕES
O estudo de catingueira (Poincianella pyramidalis) quanto à sua composição
bromatológica e degradabilidade de MS e FDN demonstrou as potencialidades desta
planta como forrageira, contudo, através de conhecimentos sobre sua anatomia foliar,
degradabilidade de tecidos e teor de compostos fenólicos pôde-se conhecer aspectos
importantes relativos ao aproveitamento desta forrageira pelos microrganismos
ruminais.
Adicionalmente, as avaliações realizadas sob diferentes períodos do ciclo
fenológico da planta, os quais estão diretamente relacionados aos pulsos e interpulsos de
precipitação do semiárido, permitem confirmar a alta adaptabilidade desta espécie às
condições da caatinga.
Em geral, relatos apontam a preferência de caprinos e ovinos por consumir as
folhas de catingueira após a última fenofase (senescência) quando caem e formam a
serrapilheira, contudo, apesar do elevado teor de compostos fenólicos, foi possível
constatar as primeiras fases do desenvolvimento como aquelas em que a planta
apresenta seu melhor teor nutricional.
O uso de catingueira na alimentação animal pode vir a ser uma interessante
alternativa alimentar, tendo em vista a abundância desta planta na caatinga, suas
características nutricionais e a necessidade de aproveitamento dos recursos naturais do
semiárido.
Contudo, estudar formas de fornecimento e avaliar o desempenho de animais
sob dietas compostas com catingueira na forma de feno, por exemplo, são
imprescindíveis para incentivar ou descartar sua possibilidade de utilização para fins
forrageiros.
Além disto, aspectos anatômicos e fisiológicos, como a função de tricomas
pedunculados na folha e as relações ambientais com a síntese e acúmulo de
fotoassimilados podem ser importantes indicativos para estudos posteriores, cujas
elucidações certamente contribuirão para a melhor utilização desta espécie em suas mais
variadas finalidades.