FUNÇÕES E REAÇÕES INORGÂNICAS
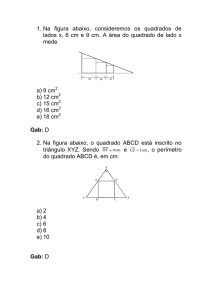
Questão 01 - (ENEM)
Os calcários são materiais compostos por carbonato de cálcio, que podem atuar como sorventes do dióxido de
enxofre (SO2), um importante poluente atmosférico. As reações envolvidas no processo são a ativação do calcário,
por meio de calcinação, e a fixação do SO2 com a formação de um sal de cálcio, como ilustrado pelas equações
químicas simplificadas.
calor
CaCO3 CaO + CO2
CaO + SO2 +
1
O2 Sal de cálcio
2
Considerando-se as reações envolvidas nesse processo de dessulfurização, a fórmula química do sal de cálcio
corresponde a
a)
CaSO3.
b)
CaSO4.
c)
CaS2O8.
d)
CaSO2.
e)
CaS2O7.
Questão 02 - (ENEM)
Em um experimento, colocou-se água até a metade da capacidade de um frasco de vidro e, em seguida,
adicionaram-se três gotas de solução alcoólica de fenolftaleína. Adicionou-se bicarbonato de sódio comercial, em
pequenas quantidades, até que a solução se tornasse rosa. Dentro do frasco, acendeu-se um palito de fósforo, o
qual foi apagado assim que a cabeça terminou de queimar. Imediatamente, o frasco foi tampado. Em seguida,
agitou-se o frasco tampado e observou-se o desaparecimento da cor rosa.
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)
a)
formação de óxidos de caráter ácido.
b)
evaporação do indicador fenolftaleína.
c)
vaporização de parte da água do frasco.
d)
vaporização dos gases de caráter alcalino.
e)
aumento do pH da solução no interior do frasco.
Questão 03 - (ENEM)
As misturas efervescentes, em pó ou em comprimidos, são comuns para a administração de vitamina C ou de
medicamentos para azia. Essa forma farmacêutica sólida foi desenvolvida para facilitar o transporte, aumentar a
estabilidade de substâncias e, quando em solução, acelerar a absorção do fármaco pelo organismo.
A matérias-primas que atuam na efervescência são, em geral, o ácido tartárico ou o ácido cítrico que reagem com
um sal de caráter básico, como o bicarbonato de sódio (NaHCO 3), quando em contato com a água. A partir do
contato da mistura efervescente com a água, ocorre uma série de reações químicas simultâneas: liberação de íons,
formação de ácido e liberação do gás carbônico – gerando a efervescência.
As equações a seguir representam as etapas da reação da mistura efervescente na água, em que foram omitidos
os estados de agregação dos reagentes, e H3A representa o ácido cítrico.
I.
NaHCO3 Na+ + HCO–3
II.
H2CO3
III.
HCO–3 + H+
IV.
H3A
H2O + CO2
H2CO3
3H+ + A–
A ionização, a dissociação iônica, a formação do ácido e a liberação do gás ocorrem, respectivamente, nas
seguintes etapas:
a)
IV, I, II e III
b)
I, IV, III e II
c)
IV, III, I e II
d)
I, IV, II e III
e)
IV, I, III e II
Questão 04 - (ENEM)
O processo de industrialização tem gerado sérios problemas de ordem ambiental, econômica e social, entre os quais
se pode citar a chuva ácida. Os ácidos usualmente presentes em maiores proporções na água da chuva são o H 2CO3,
formado pela reação do CO2 atmosférico com a água, o HNO3, o HNO2, o H2SO4 e o H2SO3. Esses quatro últimos são
formados principalmente a partir da reação da água com os óxidos de nitrogênio e de enxofre gerados pela queima de
combustíveis fósseis.A formação de chuva mais ou menos ácida depende não só da concentração do ácido formado,
como também do tipo de ácido. Essa pode ser uma informação útil na elaboração de estratégias para minimizar esse
problema ambiental. Se consideradas concentrações idênticas, quais dos ácidos citados no texto conferem maior
acidez às águas das chuvas?
a)
HNO3 e HNO2.
b)
H2SO4 e H2SO3.
c)
H2SO3 e HNO2.
d)
H2SO4 e HNO3.
e)
H2CO3 e H2SO3.
Questão 05 - (FUVEST SP)
A cúpula central da Basílica de Aparecida do Norte receberá novas chapas de cobre que serão envelhecidas
artificialmente, pois, expostas ao ar, só adquiririam a cor verde das chapas atuais após 25 anos. Um dos compostos
que conferem cor verde às chapas de cobre, no envelhecimento natural, é a malaquita, CuCO3 . Cu(OH)2 . Dentre
os constituintes do ar atmosférico, são necessários e suficientes para a formação da malaquita:
a)
nitrogênio e oxigênio.
b)
nitrogênio, dióxido de carbono e água.
c)
dióxido de carbono e oxigênio.
d)
dióxido de carbono, oxigênio e água.
e)
nitrogênio, oxigênio e água.
Questão 06 - (ITA SP)
A posição relativa dos átomos, na molécula do ácido sulfúrico, é melhor representada por:
_ _ _
O
a- O_ O_ S _ H
_
_ _
_ _
O
O
_
_
b- H O O_ O_ S _ H
O
c- H _ O _ S _ O _ H
O
O
_
_
_
d- H O O S _ H
O
_
_
_
e- H O O O_ S _ H
O
Questão 07 - (UFMG)
Ácido bórico, H3BO3, tem a seguinte fórmula estrutural.
Questão 08 - (Mackenzie SP)
Na ionização total de um ácido, obtêm-se íons HPO32- e hidroxônio. Para a fórmula do ácido e para o número total
de íons hidroxônio temos, respectivamente:
a)
H2PO3 e 2
b)
H3PO3 e 1
c)
HPO3 e 2
d)
H3PO3 e 2
e)
H3PO3 e 3
Questão 09 - (UFU MG)
Entre os oxiácidos H2SO3, H3BO3, HClO3, HMnO4, a ordem crescente de força ácida para esses compostos é:
a)
H2SO3, HClO3, H3BO3, , HMnO4
b)
HClO3 ,HMnO4, H2SO3, H3BO3,
c)
H3BO3, HClO3, H2SO3, HMnO4
d)
H3BO3, H2SO3, HClO3, HMnO4
e)
HMnO4 , HClO3, H3BO3, H2SO3,
Questão 10 - (FAAP SP)
O vinagre tem caráter ácido, pois nele encontramos predominantemente:
a)
ácido sulfúrico
b)
ácido acético
c)
ácido carbônico
d)
ácido nítrico
e)
ácido sulfúrico
Questão 11 - (PUC MG)
Para purificar a água, que apresenta impurezas biológicas, tais como fungos, algas e outros microorganismo, usase cloro. A reação do cloro com a água produz ácido clorídrico e ácido hipocloroso. Sobre os dois componentes
produzidos, é INCORRETO afirmar:
a)
As fórmulas do ácido clorídrico e hipocloroso são HCl e HClO, respectivamente.
b)
O número e oxidação do átomo de cloro vale, respectivamente, -1 e +1.
c)
A reação do cloro com água, produzindo HCl e HClO, é de auto oxi-redução.
d)
As duas substâncias contém o mesmo número de átomos de cloro em 1 mol.
e)
Um mol de ácido clorídrico tem maior massa que 1 mol de ácido hipocloroso.
Questão 12 - (Mackenzie SP)
A equação correta da ionização do ácido sulfúrico é:
a)
H2SO4 + H2O HSO42- + H3O+
b)
H2SO4 + 2H2O SO41- + 2H3O+
c)
H2SO4 + 2H2O SO42- + 2H3O+
d)
H2SO4 + 2H2O HSO42- + H3O2+
e)
H2SO4 + 2H2O SO42- + 2H3O+
Questão 13 - (Mackenzie SP)
Ao se aplicar o conceito atualizado de Arrhenius a um ácido inorgânico, forma. se uma certa espécie química
característica que:
a)
é um cátion, no qual o número total de prótons é menor que o número total de elétrons
b)
é um ânion, no qual o número total de elétrons é menor que o número total de prótons
c)
é uma molécula polar
d)
é um íon, no qual o número total de prótons é maior que o número total de elétrons
e)
é um íon, no qual o número total de prótons é igual ao número total de elétrons
Questão 14 - (ITA SP)
Qual dos ácidos abaixo é o menos volátil?
a)
HCl.
b)
HI.
c)
H2SO3.
d)
H2SO4.
e)
CH3CH2COOH.
TEXTO: 1 - Comum à questão: 15
Um grupo de biólogos e neurocientistas paulistas pode ter descoberto um dos motivos por trás do fracasso das
antigas terapias celulares contra o Parkinson e talvez compreendido porque as versões mais modernas e refinadas
desse tipo de tratamento experimental, hoje baseadas no emprego das chamadas célulastronco, continuam a dar
resultados inconsistentes. Os transplantes que têm sido testados nos estudos pré-clínicos, em animais de
laboratório, podem conter uma quantidade significativa de fibroblastos, um tipo de célula da pele extremamente
parecido com algumas células-tronco, mas que têm propriedades totalmente diferentes.
Ainda sem cura, o Parkinson atualmente é controlado com o auxílio de medicamentos, como a levodopa, que
podem ser convertidos pelo cérebro em dopamina. Em casos mais graves há ainda uma segunda alternativa:
implantar eletrodos no cérebro de pacientes que não respondem bem ao tratamento ou apresentam muitos efeitos
colaterais em decorrência do uso dos remédios. Ligado a um pequeno gerador implantado debaixo da pele, os
eletrodos tentam melhorar a comunicação entre os neurônios. A delicada cirurgia para a colocação dos eletrodos
é conhecida como estimulação profunda do cérebro (deep brain stimulation, ou simplesmente DBS). Com exceção
dessas duas abordagens, todos os demais procedimentos contra a doença ainda se encontram no estágio de
testes, sem aprovação dos órgãos médicos.
(Pesquisa FAPESP. ed. Impressa 183, Maio/2011)
Questão 15 - (PUC Camp SP)
As cinzas obtidas da queima de lenha podem ser usadas para fabricação de sabão artesanal quando é misturada
à gordura animal. O processo de saponificação somente é possível porque as cinzas possuem propriedades
a)
ácidas.
b)
básicas.
c)
desidratantes.
d)
umectantes.
e)
oxidantes.
Questão 16 - (ITA SP)
Das afirmações seguintes, assinale a ERRADA:
a)
Os hidróxidos dos metais de transição, via de regra, são coloridos e muito pouco solúveis em água.
b)
Os hidróxidos dos metais alcalino-terrosos são menos solúveis em água do que os hidróxidos dos metais
alcalinos.
c)
O método mais fácil de preparação de qualquer hidróxido consiste na reação do respectivo óxido com água.
d)
Existem hidróxidos que formam produtos solúveis quando são tratados com soluções aquosas, tanto de certos
ácidos como de certas bases.
e)
Hidróxido de alumínio, recém-precipitado de solução aquosa, geralmente se apresenta na forma de um gel
não cristalizado.
Questão 17 - (Mackenzie SP)
A equação que representa corretamente a dissociação iônica de uma base pouco solúvel, de fórmula M(OH)x, é:
a)
M(OH)x Mx+ + OH-
b)
M(OH)x xM+ + xOH-
c)
M(OH)x Mx+ + xOH-
d)
M(OH)x Mx+ + OHx-
e)
M(OH)x xM+ + OH-
Questão 18 - (Mackenzie SP)
De uma certa substância, fazemos as afirmações a seguir:
I.
reage com ácido, dando água e sal
II.
em presença de água, sofre dissociação iônica parcial
III.
em solução aquosa, torna a fenolftaleína vermelha
A substância que se enquadra nas propriedades dadas é:
a)
BaSO4
b)
CH4
c)
Mg(OH)2
d)
SO3
e)
HCl
Questão 19 - (OSEC SP)
Uma base forte deve ter ligado ao grupo OH-:
a)
um elemento muito eletropositivo
b)
um elemento muito eletronegativo
c)
um semimetal
d)
um metal que dê 3 elétrons
e)
um ametal
Questão 20 - (UFMG)
Na embalagem de um produto usado para desentupir pias e ralos, à base de soda cáustica (hidróxido de sódio –
NaOH), são encontradas, entre outras, as instruções:
"Cuidado: Em caso de contato, lavar imediatamente os olhos ou a pele com água em abundância durante quinze
minutos. Se ingerido, não provocar vômito. Dar grande quantidade e também vinagre diluído em um copo de água.
A seguir, dar uma colher de óleo comestível."
"Não reaproveitar a embalagem vazia. Lavar a colher utilizada como medida com bastante água corrente antes de
reutilizá-la. Não adicionar água à embalagem do produto."
O quadro abaixo relaciona algumas dessas instruções com as justificativas para o uso desses procedimentos, com
base nas propriedades da soda cáustica e das outras espécies envolvidas. Assinale a alternativa que contém uma
justificativa INCORRETA para a instrução relacionada.
a)
Instrução : Dar vinagre diluído em um copo de água. Justificativa : O vinagre diluído neutraliza a soda cáustica
através de reação ácido-base.
b)
Instrução : Lavar a colher utilizada como medida com bastante água corrente antes de reutilizá-la. Justificativa
: A utilização de grande quantidade de água deve-se ao fato de a soda cáustica ser insolúvel na água.
c)
Instrução : Não adicionar água à embalagem com o produto. Justificativa : A adição de água à embalagem
com produto provoca forte aquecimento
d)
Instrução : Não reaproveitar a embalagem vazia. Justificativa : A embalagem pode estar contaminada com
resíduos de soda cáustica
Questão 21 - (ITA SP)
Num exame foi pedido aos alunos que citassem propriedades do trióxido de enxofre, SO 3. Aqui seguem algumas
das afirmações feitas pelos alunos em relação a esse tópico:
I.
O SO3 nas condições ambientes é um sólido branco.
II.
SO3 é solúvel em ácido sulfúrico puro, sendo que as soluções resultantes são chamadas de “oleum”.
III.
O SO3 pode ser obtido na forma gasosa acrescentando HCl a Na3SO3.
IV.
O SO3 é o óxido que se forma fácil e diretamente na queima do enxofre ao ar.
V.
Em regiões, onde se queimam grandes quantidades de combustíveis fósseis, forma-se SO3 na atmosfera.
VI.
Chuvas ácidas em certas regiões altamente industrializadas podem ser conseqüência de SO 3 poluindo a
atmosfera.
VII. O SO3 é um exemplo de composto molecular, não iônico, que ao ser dissolvido em água forma soluções que
conduzem bem a corrente elétrica.
Destas afirmações estão INCORRETAS:
a)
V, VI e VII.
b)
III e IV.
c)
Nenhuma.
d)
As de números pares.
e)
As de números ímpares.
Questão 22 - (ITA SP)
Assinale a alternativa FALSA em relação a propriedades de óxidos:
a)
O SiO2 forma ácido muito solúvel em H2O.
b)
NO2 reage com água produzindo HNO2 e HNO3.
c)
Cr2O3 é um óxido básico.
d)
CrO3 é um óxido ácido.
e)
ZnO reage com bases fortes.
Questão 23 - (PUC Camp SP)
Um dos poluentes do ar atmosférico e responsável pela formação da “chuva ácida “é um composto do enxofre.
Sforma. se ácido quando esse composto reage com a água da chuva. Qual das equações pode representar esta
reação?
a)
K2SO3(s) + H2O(l) 2K+(aq) + SO32-
b)
Na2SO4(s) + H2O(l) 2Na+(aq) + SO42-(aq)
c)
Na2S(s) + H2O(l) 2Na+(aq) +2OH-(aq) + H2S(g)
d)
SO3(g) +H2O(l) H2SO4(aq)
e)
SOCl2 + H2O(l) SO2(aq) + HCl(aq)
Questão 24 - (PUC MG)
Observe as reações químicas abaixo:
I.
MgO + H2O Mg(OH)2
II.
CO2 + H2O H2CO3
III.
K2O + 2HCl 2KCl + H2O
IV.
SO3 + 2NaOH Na2SO4 + H2O
Assinale a alternativa incorreta:
a)
as reações II e IV envolveram óxidos ácidos ou anidridos.
b)
as reações I e III envolveram óxidos básicos.
c)
o sal produzido na reação IV chama-se sulfato de sódio.
d)
o sal produzido na reação III chama-se cloreto de potássio
e)
o caráter básico dos óxidos se acentua, à medida que o oxigênio se liga a elementos mais eletronegativos.
Questão 25 - (PUC MG)
A tabela abaixo apresenta algumas carcterísticas e aplicações de determinadas substâncias:
Nome das substâncias
I.
Óxido de cálcio
Aplicações e características
Nas construções, na neutralização da acidez dos solos.
II.
Anidrido sulfúrico
Aplicações e características
Descoreamento de matéria colorida, conservação de frutas e obtenção do H2SO4
III.
Hidróxido de amônio
Aplicações e características
Usado para fins de linpeza e no fabrico do sangue-de-diabo, difundido nos carnavais, Amoníaco
IV. Ácido fosfórico
Aplicações e características
Usado como acidulante em refrigerante, balas e gama de mascar
V.
Bicarbonato de cálcio
Aplicações e características
Fermento de pão, antiácido e tembém usado em extintores de incêndio
As fórmulas das substâncias acima são, respectivamente:
a)
I-CaO, II-SO3, III-(NH4)2OH, IV-H3PO4 e Na2CO3
b)
I-CaO, II-SO3, III-(NH4)2OH, IV-H3PO4 e NaHCO3
c)
I-Ca2O, II-SO2, III-(NH4)OH, IV-H3PO3 e NaHCO3
d)
I-Ca2O, II-SO2, III-NH3OH, IV-H3PO3 e Na2CO3
e)
I-CaO2, II-SO3, III-(NH4)2OH, IV-H3PO4 e Na2CO2
Questão 26 - (VUNESP SP)
Para remover dióxido de carbono do ar respirado pelos astronautas nas espaçonaves utiliza-se hidróxido de lítio
sólido. A fórmula, o nome e o estado físico do produto formado são, respectivamente:
a)
Li2C, carbeto de lítio, sólido.
b)
LiHCO3, hidrogenocarbonato de lítio, sólido
c)
Li(OH)CO2, hidróxicarbonato de lítio, líquido
d)
Li2CO3, carbonato de lítio, gasoso
e)
Li2HCO3, carbonato de lítio, líquido
Questão 27 - (ITA SP)
Considere a seguinte seqüência de sais de sódio:
sulfato; sulfito; tiossulfato e sulfeto
A opção que contém a seqüência de fórmulas CORRETAS destes sais é:
a)
Na2SO4;
Na2S2O3;
Na2SO3
e
Na2S.
b)
Na2SO4;
Na2S;
Na2S2O3
e
Na2SO3.
c)
Na2S2O3;
Na2S;
Na2SO4
e
Na2SO3.
d)
Na2SO4;
Na2SO3;
Na2S2O3
e
Na2S.
e)
Na2SO3;
Na2SO4;
Na2S2O3 e
Na2S.
Questão 28 - (PUC Camp SP)
Os pigmentos de tinta CdS, BaSO4 e Cr(OH)3 são denominados, na ordem dada:
a)
sulfito de cádmio, sulfito de bário e óxido de crômio.
b)
sulfato de cádmio, sulfito de bário e hidróxido de crômio
c)
sulfeto de cádmio, sulfato de bário e hidróxido de crômio.
d)
tiossulfato de cádmio, sulfato de bário e óxido crômico.
e)
sulfeto de cádmio, sulfito de bário e anidrido crômico.
Questão 29 - (UERJ)
A respeito de uma substância X, foi afirmado (observação experimental):
I.
é solida;
II.
conduz corrente elétrica após fusão;
III.
apresenta valores elevados para os pontos de fusão e ebulição;
Dentre as substâncias a seguir, aquela que pode representar X é:
a)
O2
b)
CO2
c)
HCl
d)
ZnS
e)
NaCl
Questão 30 - (UERJ)
Recentemente foi confirmada a existência de água mineral medicinal no município de Resende. Segundo foi
publicado na imprensa, a água encontrada é rica em bicarbonato, oficialmente hidrogenocarbonatos.
As fórmulas químicas correspondentes aos hidrogenocarbonatos de sódio e de cálcio são, respectivamente:
a)
Na2CO3 e CaHCO3
b)
NaHCO3 e CaHCO3
c)
NaHCO3 e Ca(HCO3)2
d)
Na2CO3 e Ca(HCO3)2
GABARITO:
1) Gab: B
2) Gab: A
3) Gab: E
4) Gab: D
5) Gab:D
6) Gab: C
7) Gab: C
8) Gab: D
9) Gab: D
10) Gab: B
11) Gab: E
12) Gab: E
13) Gab: D
14) Gab: D
15) Gab: B
16) Gab: C
17) Gab: C
18) Gab: C
19) Gab: A
20) Gab: B
21) Gab: B
22) Gab: A
23) Gab: D
24) Gab: E
25) Gab: B
26) Gab: B
27) Gab: D
28) Gab: C
29) Gab: E
30) Gab: B