www.conhecer.org.br
PARASITOSES DE IMPORTÂNCIA PARA A SAÚDE PÚBLICA
Este curso se propõe a prestar informações sobre os diversos parasitas que
acometem os seres humanos e sua importância na saúde pública. Este curso foi
elaborado pelos Professores: Bióloga - Ilse Franco, Médica veterinária - Ivonete
Parreira, Biólogo -
Estevão Keglevich. Caso possuir sugestões ou informações
complementares, contate-nos.
INTRODUÇÃO
De acordo com o dicionário Aurélio saúde é um estado do indivíduo cujas
funções orgânicas, físicas e mentais se acham normais, estado do que é sadio ou são,
é ter disposição mental ou física. Estendendo este termo para saúde pública entendese que é algo destinado ao povo, pertencente à coletividade, portanto saúde coletiva ou
da população.
Para que haja saúde da população faz-se necessário uma interação de vários
fatores: os fatores sociais, econômicos e políticos. Neste sentido deve ocorrer um
envolvimento dos órgãos de saúde com as diversas camadas sociais, apoiados por
políticas públicas voltadas para o bem estar da população.
Neste curso trataremos apenas de um assunto relacionado à saúde das pessoas
com o objetivo maior de produzir a educação ou o alerta para pequenos detalhes do
nosso dia-a-dia que pode efetivamente levar à prevenção.
Os parasitas do trato
digestivo estão presentes em qualquer fase da vida do ser humano e cuidados simples
podem contribuir para a eliminação destes.
Os parasitas do trato gastrointestinal, ainda são importantes causadores de
condição de morbidade no ser humano, pois têm ampla distribuição geográfica e
apresentam índices elevados de prevalência em algumas regiões. As condições como
falta de estrutura sanitária básica, recolhimento de lixo doméstico, acesso à água de
boa qualidade e educação sanitária são fatores determinantes na manutenção das
parasitoses humanas.
O crescimento desordenado das cidades, principalmente as grandes cidades,
leva ao aparecimento de bairros inteiros em pouco tempo, com aglomerados humanos
sem atendimento de saneamento básico (água tratada, rede de esgoto, coleta do lixo).
As políticas públicas destinadas ao setor não conseguem atender a demanda por
asfalto, água tratada e rede de esgoto em função do não planejamento urbano. Nos
últimos anos esta condição tem se alterado mediante a implantação de plano diretor
para as cidades acima de 50.000 habitantes.
Atualmente, a criação de novos bairros ou setores de moradia tem que atender
ao mínimo de saneamento, para que seja dada a permissão de loteamento e
construção de casas. Com esta exigência, possivelmente em alguns anos, não haverá
bairros
em
condições
precárias
de
saneamento,
excetuando-se
aqueles
da
clandestinidade.
Os parasitas são causadores de patologia em animais e homens, a aquisição de
vermes ou outros parasitas está diretamente relacionada à higiene pessoal ou ingestão
de alimentos ou água contaminados (TAVARES et al, 2009). Neste contexto a
educação sanitária é de extrema importância pois é fator de prevenção e controle das
doenças. As parasitoses geralmente encontram-se associadas a quadros de diarréia e
desnutrição, apresentando-se mais grave em grupos de imunossuprimidos como
grávidas e crianças.
Os animais podem ser transmissores de alguns tipos de parasitas para o
homem, por exemplo o dipylidium caninun,
o controle é efetuado através da
manutenção de cães e gatos sempre desverminados, principalmente aqueles de
convivência muito próxima ao ser humano, recomenda-se a administração de antihelmínticos a cada três meses, podendo ser em dose única com repetição após 15
dias. A transmissão de doenças via ingestão de produtos de origem animal é bastante
comum, sendo necessário maior vigilância em relação aos produtos alimentícios.
Doenças parasitárias são importantes do ponto de vista médico-social, por
produzirem déficit orgânico, afetando o desenvolvimento normal das crianças e
limitando as atividades da população em geral. As parasitoses acometem um alto
percentual da população humana, principalmente comunidades de baixa renda que
possuem condições climáticas e ambientais favoráveis para sua evolução e
propagação. Entre os grandes problemas de saúde dos países em desenvolvimento,
encontram-se as parasitoses, a exigir consideráveis recursos financeiros, organização e
pessoal habilitado para combatê-las (TAVARES et al., 2009).
MELO et al. (2004) relatam que as parasitoses podem favorecer o aparecimento
ou agravamento da desnutrição devido aos seguintes mecanismos:
1- Lesão de mucosa por giárdia, necator, estrongilóides ou coccidios;
2- Alteração do metabolismo dos sais biliares pela giárdia;
3- Competição alimentar produzida por áscaris (alta infestação);
4- Exsudação intestinal causada por giárdia, estrongilóides, necator, tricocéfalos;
5- Favorecimento de proliferação bacteriana por amebas;
6- Sangramentos causados por necator, tricocéfalos;
Não há uma exatidão dos gastos públicos com o tratamento da população
acometida por doenças parasitárias. Com certeza há um gasto que poderia ser
minimizado com o tratamento preventivo através de saneamento e educação sanitária.
Os prejuízos à saúde humana também são difíceis de serem medidos visto que nem
sempre as ocorrências são formalizadas.
A Organização Mundial de Saúde (World Health Organization) prevê que em
2025 mais de 50% da população dos países em desenvolvimento habite em áreas
urbanas verificando-se um aumento da habitação degradada, onde parasitas como
Entamoeba histolytica, Giardia lamblia, Ascaris lumbricoides e Trichuris trichiura
encontram condições propícias de proliferação e transmissão (CRUZ, 2003).
No Brasil não é diferente dos demais países em desenvolvimento, continuamos a
ser um país tropical e carente de instalações sanitárias. Trinta milhões de brasileiros
vivem em extrema pobreza, 45 milhões sofrem de lombriga e seis
milhões de
esquistossomose (DOMINGUES, 2006).
Segundo DOMINGUES (2006) esperava-se que com a evolução da medicina as
parasitoses diminuíssem visto que são doenças consideradas banais, tal fato não
ocorreu. Pesquisa do Ministério da Saúde mostrou que mais de um terço da população
brasileira está infectada com pelo menos um tipo de parasita, ressaltando que espécies
menos
ofensivas
como
microsporídeos
tornaram-se
problema
para
pessoas
imunossuprimidas.
Os parasitas mais encontrados nas populações são ameba, giárdia, tênia,
tricuris, ascaris, ancilostomas, estrongilóides e esquistossomas (DOMINGUES, 2006).
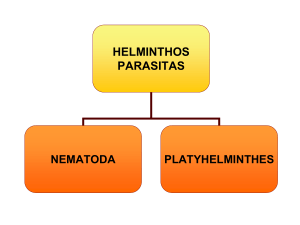
Os parasitas intestinais são classificados em dois grandes grupos: os
protozoários unicelulares (microparasitas) e os helmintos (macroparasitas).
TABELA DE CLASSIFICAÇÃO DE PARASITAS INTESTINAIS
PROTOZOÁRIOS
Entamoeba histolytica
Giárdia Lambria
Balantidium coli
Isospora belli
Criptosporidium
Microsporídia
HELMINTOS
Nematelmintos
Platelmintos cestódeos
Vermes cilíndricos não
- vermes chatos
segmentados
segmentados
Ascaris lumbricoides
Ancylostoma duodenale
Necator americanus
Enterobius vermicularis
Trichiuris trichiura
Strongyloides stercoralis
Diantamoeba fragilis
Blastocystis hominis
Ciclospora
Sarcocystis sp
Fonte: DOMINGUES (2006).
Taênia saginata
Taênia solium
Hyminolepis Nana
Hyminolepis diminuta
Diphyllobotrium latum
Dipylidium caninum
Platelmintos
Trematódeos vermes
chatos não
segmentados
Schistossoma
mansoni
De acordo com a ANVISA (2009) as doses infectantes de alguns patógenos
intestinais são:
Giardia lamblia..................................................................
10 – 102 cistos
Entamoeba histolytica.......................................................
10 – 102 cistos
Cryptosporidium parvum...................................................
01 – 103 oocistos
Os protozoários são organismos que, para sobreviverem, realizam todas as
funções mantenedoras da vida, tais como alimentação, respiração, reprodução,
excreção e locomoção. Sua infecção nos humanos é caracterizada pela ausência de
eosinófilos, exceto quando ela se deve a Isospora belli e a Dientamoeba fragilis. Outra
característica é a presença de cistos, oocistos e esporos como fonte de infecção e
diagnóstico (DOMINGUES, 2006).
Cisto de protozoário é definido como uma forma de resistência ou forma inativa.
Este microrganismo tem a capacidade de secretar uma parede resistente que o
protegerá quanto estiver em ambiente impróprio ou em fase de latência. O oocisto é a
forma infectante.
Estudos realizados já concluíram que as praias também são importantes focos
de infecção humana por microrganismos, tanto através da água quanto do solo. O
estudo do nível da contaminação do solo por parasitos em áreas endêmicas, públicas e
muito freqüentadas, faz-se necessário uma vez que o solo é uma fonte de infecção
contínua, principalmente para as crianças (CÁCERES et al, 2004).
O principal tipo de parasita encontrado no solo ou areia é o Ancylostoma
braziliensis, conhecido popularmente por bicho geográfico. As pessoas se contaminam
quando entram em contato com o solo, as larvas penetram na pele íntegra e começam
a se movimentar na porção subcutânea, causando prurido e “desenhos”, as partes do
corpo mais afetadas são pés, cotovelos e nádegas. Para o tratamento o médico deverá
ser consultado, a eliminação do parasita é feita através de medicamentos dérmicos e
de uso interno.
Os parasitas intestinais, como o próprio nome diz, realizam uma relação de
parasitismo com o
hospedeiro, nesta condição o organismo parasita sobrevive às
custas do hospedeiro, o benefício e unilateral, sendo assim o parasita não vive sem o
hospedeiro, como o parasitismo trás
prejuízos ao hospedeiro, livrar-se deste é a
condição ideal. Os hospedeiros podem ser definidos como:
Hospedeiro definitivo: organismo que aloja um parasita por longo período de tempo, é
o local onde o parasita realiza sua reprodução.
Hospedeiro intermediário: é o organismo no qual o parasita desenvolve parte de seu
ciclo, fases larvais ou infectantes.
Vetor: são invertebrados, hospedeiros de transporte ou mecânicos. Podem ser vetores
biológicos onde as larvas se reproduzem dentro do vetor ou vetores mecânicos
utilizados como transportadores das larvas
Os parasitas exercem diferentes ações sobre seus hospedeiros:
São elas:
Ação espoliativa – Ação de absorver nutrientes ou sangue do hospedeiro – exemplo:
Ancylostomatidae
Ação tóxica – a reação tóxica ocorre em função da produção de enzimas ou
metabólicos que causam lesão no hospedeiro. Exemplos: A. lumbricoides, S.mansoni.
Ação Mecânica - obstruções mecânicas em função do número de parasitas dentro da
luz intestinal. Exemplo: A. lumbricoides.
Ação traumática – traumas ou lesões são provocadas pela migração das larvas de
algumas espécies de vermes ou protozoários. Exemplo: F. hepatica, T. trichiurus,
Plasmodium, etc.
Ação de irritação – A presença do parasita no mesmo local, sugando seus nutrientes
provoca pequenas lesões ou irritação da mucosa. Exemplo: A. lumbricoides .
Ação de anóxia – provocada por vermes que consomem oxigênio ou que levem o
hospedeiro a anemia . Exemplo: Ancylostomatidae
DIAGNÓSTICO DAS PARASITOSES
De acordo com DOMINGUES (2006) o diagnóstico das parasitoses intestinais é
realizado utilizando-se várias informações: anamnese, procedência do paciente, seus
hábitos, exposição aos parasitas, eliminação de vermes, seguida pelo exame físico, no
qual podem ser destacadas a anemia e a desnutrição. Se o paciente é imunossuprimido
e tem sintomas gastrintestinais, o diagnóstico deve ser sempre lembrado. Entre os
exames laboratoriais, o hemograma pode revelar além de anemia, também a
eosinofilia, que é uma reação do sistema imunológico à presença maciça de vermes
intestinais. O exame coprológico constata a presença do parasita (ovos e larvas nas
fezes).
Conforme afirmado por FERRARI & RODRIGUEZ (2004) a clínica é inespecífica
para o diagnóstico das helmintíases intestinais, é preconizado basicamente o exame
protoparasitológico: exame parasitológico de fezes (EPF), com análise de três amostras
de
fezes;
eventualmente
podem
ser
utilizados:
tamização,
anal
swab,
intradermorreação e biópsias.
A qualidade da amostra depende se o paciente não ingeriu alguma substância
que possa interferir como ferro, antibióticos, antiácidos, bismuto, iodeto bem como o
tempo de coleta. As larvas sofrem degeneração com a demora do processamento em
laboratório, por isto aconselha-se realizar a coleta e enviar imediatamente.
Outros métodos de diagnóstico estão sendo adotados como o PCR (reação da
polimerase em cadeia), neste teste o material utilizado é o soro sanguíneo do paciente
e são localizadas partículas de DNA, é um exame de alta confiabilidade. O teste de
ELISA também é utilizado a partir de soro, é um ensaio imunoenzimático, ou seja,
detecta anticorpos e não a presença do parasita.
Exames laboratoriais são realizados a partir de uma indicação clínica, portanto a
partir de uma suspeita. Os exames laboratoriais são complementares ao diagnóstico,
onde o agente etiológico é identificado em exames específicos. A partir de uma
suspeita o método de identificação do agente é escolhido, podendo ser por técnicas de
visualização macroscópica ou microscópica, dependendo do que é procurado. Exames
que detectam somente anticorpos nem sempre são úteis (TAVIRA, 2009).
A detecção de parasitas intestinais segundo TAVIRA (2009) pode ser feita por:
Visualização macroscópica – usada para identificação de vermes adultos em
fezes ou vômitos.
Visualização microscópica - observação de fungos, ovos de parasitas, bactérias
e outros.
De acordo com TAVIRA (2009) para o diagnóstico de parasitas intestinais é
necessário a colheita de amostras fecais e para a obtenção de uma boa amostra é
necessário as seguintes observações:
- utilização de frasco de boca larga, limpo, seco, impermeável.
- evitar a contaminação com água (pode conter outros agentes de vida livre)
- evitar a contaminação por urina (mata alguns microrganismos)
- colher antes de ingestão de antibióticos (diminui o número de parasitas)
- colher uma série de três amostras: no espaço de 10 dias
- levar ao laboratório preferencialmente no mesmo dia da colheita, os vermes
degeneram rapidamente no meio ambiente.
- deve ser feito a reavaliação, no caso de protozoários três ou quatro semanas
de intervalo, para helmintos sp uma a duas semanas, no caso de Taênia spp realizar
retestagem com cinco ou seis semanas.
O envio das amostras ao laboratório deve ser imediato para que se tenha a
preservação da morfologia dos protozoários e também para evitar o desenvolvimento
dos ovos em larvas. Recomenda-se o uso de kits existentes no mercado que possuem
conservantes e nunca esquecer de identificar corretamente a amostra, inclusive com
hora de colheita e tipo de conservante utilizado (TAVIRA, 2009).
Os conservantes mais utilizados são Polyvinyl Mercuric Chloride (PVA),
compostos de cobre, compostos de zinco, formalina (5-10%), formalina com acetato de
sódio e ácido acético (SAF), formalina com iodo e mertiolato (MIF).
PREVENÇÃO E CONTROLE
Os seres vivos são portadores de uma rede de defesa, denominada sistema
imunológico. Este sistema é acionado na presença de qualquer agente considerado
estranho ao organismo. Agentes nocivos podem ser vírus, bactérias, toxinas, proteínas,
vermes dentre outros.
Existem três tipos de imunidade:
Imunidade Natural: quando o corpo responde à agressão de um antígeno, sem
necessitar de um aviso prévio.
Imunidade Adquirida Ativa: quando o organismo produz anticorpos a partir de um
agente infeccioso que o atingiu naturalmente.
Imunidade Adquirida Passiva: quando o hospedeiro recebe anticorpos, para aquele
parasito, prontos.
As defesas normais contra os patógenos intestinais incluem:
a) suco gástrico ácido.
b) A camada de muco viçoso que recobre o trato gastrintestinal.
c) Enzimas pancreáticas líticas e detergentes biliares.
d) Anticorpos IgA secretores.
e) Eosinófilos
A relação entre eosinofilia e protozoários é pouco descrita na literatura científica.
É importante assinalar que nem todos os parasitos intestinais, principalmente aqueles
que estão na luz do intestino, são capazes de induzir eosinofilia, entretanto é
pronunciada quando há invasão tecidual (REIS et al., 2007).
Além da competição por nutrientes com as bactérias comensais abundantes que
residem no trato digestivo inferior, todos os parasitas intestinais são intermitentemente
expelidos através da defecação, meio pelo qual ganham o ambiente externo, fator
determinante para a sobrevivência da espécie através da contaminação de outros seres
vivos.
Depois de eliminados no meio ambiente os parasitas realizam diferentes
caminhos e ciclos, depende de suas características de sobrevivência. O acesso a outro
ser vivo ocorre geralmente pela via hídrica ou alimentar. As medidas de prevenção
visam interromper este ciclo de sobrevivência, para o sucesso da ação é necessário
conhecer a biologia dos parasitas para saber onde intervir.
Muitos parasitas são oportunistas
e aproveitam-se do enfraquecimento das
defesas do hospedeiro para se instalar. A ingestão de antibióticos pode diminuir a
acidez estomacal e desequilibrar a flora bacteriana normal, na oportunidade se houver
algum parasita no trato gastrointestinal ele terá o ambiente a seu favor e poderá crescer
e reproduzir .
Os protozoários intestinais possuem várias características em comum:
- São adquiridos via ingestão de água ou alimentos contaminados por fezes ou
pelo contato oral-fecal direto (mais comum entre as crianças). Portanto, o seu controle
depende essencialmente do saneamento básico (água e esgoto tratados) e da higiene
pessoal;
- Produzem diarréia aquosa acompanhada por cólicas, durando poucos ou vários
dias, sem sangue ou muco, acompanhada ou não de vômitos e, na maioria dos casos,
sem febre;
- A maioria dos casos é assintomática;
- Acometem principalmente as crianças;
- São resistentes aos métodos normais de cloração da água e sobrevivem por
meses em água fria e limpa. Não resistem às altas temperaturas e ao ressecamento;
- Parasitam outros mamíferos como gatos, cães, ruminantes e podem ser
transmitidos deles para o homem;
- As infecções podem ser produzidas pela ingestão de poucos cistos (10 a 20);
- Os cistos são a forma resistente e os trofozoítos a forma infectante.
- As formas infectantes dos cistos ocorrem no intestino delgado porque são
resistentes ao suco gástrico.
Em relação aos helmintos intestinais quando estão em pequeno número no
hospedeiro não costumam provocar sintomas, a doença só aparece quando a
quantidade de vermes torna-se, via de regra, tão grande que causa obstrução,
espoliação, invasão e lesão dos ductos biliares (Áscaris). Os vermes podem causar
anemia ferropriva por perda crônica de sangue, sugado através das vilosidades
intestinais. As larvas de vários parasitas helmintos podem passar para outros habitats
orgânicos, os ciclos podem envolver uma migração entre órgãos.
POR EXEMPLO: as larvas de Trichinella encistam preferencialmente no músculo
e as Echinococcus no fígado ou pulmão.
A prevenção das parasitoses é baseada em um programa multifatorial:
disponibilidade de água potável, redes de esgotos eficientes, educação da população
em programas de saúde familiar onde são dadas orientações de higiene pessoal,
medicação anti-helmíntica preventiva e monitoração da saúde, principalmente das
crianças, com exames coprológicos.
De acordo com DOMINGUES (2006) a profilaxia das parasitoses intestinais é
feita através de várias medidas. Recomenda-se:
• lavar bem as mãos antes das refeições, após defecar, antes de preparar ou ingerir
alimentos;
• lavar bem as frutas, verduras e legumes;
• após lavar os vegetais, colocá-los mergulhados em solução de água com ácido
acético ou vinagre, por 15 minutos;
• manter as unhas cortadas;
• beber somente água filtrada ou fervida;
• evitar comer carne crua ou mal cozida;
• congelar carnes em temperaturas menores que -18º;
• salgar carnes por tempo prolongado;
• evitar alimentos expostos à insetos (moscas, baratas etc.);
• andar sempre calçado, sobretudo em áreas contaminadas;
• evitar tomar banho em lagoa, cisternas, córregos e rios com água parada, em especial
em locais endêmicos de esquistossomose;
• evitar evacuar em campo aberto;
• combater pulgas, piolhos e ratos;
• tomar cuidado com animais domésticos – tratá-los com vermífugos apropriadamente.
• evitar prática sexual oro-anal.
Tais cuidados devem ser redobrados em pacientes com imunodeficiência.
As mães e babás devem dar atenção especial às chupetas, mamadeiras e outros
utensílios utilizados pelas crianças. De acordo com pesquisa realizada por PEDROSO
& SIQUEIRA (1997) foi encontrado 11% de chupetas de crianças de 0-7 anos
contaminadas por ovos de diversos vermes, inclusive de Taênia solium. Esta
contaminação acontece devido à chupeta cair no chão ou ser lavada com água de
torneira. Indica-se a correta esterilização através da fervura ou lavar com água que foi
fervida, efetuar a troca de chupetas e bicos de mamadeira sempre que possível.
Outra maneira efetiva de prevenir a aquisição de doenças é recusar consumir
produtos de origem animal fabricados de maneira clandestina. Carnes, leite, queijos,
conservas, embutidos e muitos outros alimentos, quando elaborados sem a observação
de boas práticas de fabricação de alimentos podem conter inúmeros agentes
patogênicos, desde bactérias a ovos de parasitas diversos. Os alimentos inspecionados
pelo SIF (Serviço de Inspeção Federal) oferecem menor risco alimentar devido às
exigências do próprio sistema.
É importante o acompanhamento das populações, visto que não basta a
distribuição de vermífugos, é preciso interromper os ciclos dos parasitas através do
fornecimento de água de boa qualidade e ambiente limpo. Sem o controle dos vários
fatores a população pode ser tratada mas se reinfectar posteriormente no próprio
ambiente.
PROTOZOÁRIOS
Entamoeba histolytica (Amebíase)
A ameba é um parasita de ciclo evolutivo monoxeno, ou seja, completa seu ciclo
de vida em apenas um hospedeiro, o modo de infecção é oral. Os cistos são ingeridos
em água ou alimentos, resistem ao suco gástrico e se tornam formas infectantes no
intestino delgado. São parasitas comensais e reproduzem-se por divisão binária. A
alteração da flora intestinal favorece a entrada destes microrganismos na parede
intestinal, estes passam a se alimentar de células e hemácias. Os cistos no intestino
são eliminados no ambiente podendo sobreviver até 20 dias.
De acordo com BOA SAÚDE (2009) a amebíase pode causar doença intestinal,
como colite, disenteria e ameboma, e também extra-intestinal, como abscesso hepático,
abscesso cerebral, lesões cutâneas, patologia pleuropulmonar, entre outros. Os
sintomas da amebíase iniciam após duas semanas de infecção, com dor abdominal,
cólica associada com diarréia, disenteria e tenesmo. Sinais gerais comumente estão
ausentes: apenas 30% dos pacientes apresentam febre. A colite amebiana afeta
especialmente crianças entre um e cinco anos de idade.
Na amebíase intestinal, ocorre a disenteria amebiana com ou sem sangue. Na
extra-intestinal, a ameba invade outros órgãos, principalmente o fígado, os pulmões e a
pele, determinando processos inflamatórios e necróticos.
Os sinais e sintomas mais graves, progressão mais rápida e acometimento extraintestinal são mais freqüentes em lactentes e crianças pequenas, desnutridos, usuários
de corticóides e imunossuprimidos de maneira geral (BOA SAÚDE, 2009)
Na observação do hemograma, pode-se encontrar leucocitose leve e algum grau
de anemia. Os níveis de enzimas hepáticas podem estar aumentados, particularmente
a fosfatase alcalina. O diagnóstico baseia-se no exame de fezes, sendo colhidas três
amostras para o exame. Em casos de fezes formadas, utiliza-se a pesquisa de cistos a
fresco ou através de coloração pelo lugol ou pelos métodos de Hoffman, Pons e Janer,
ou de Faust. Em fezes diarréicas, deve-se realizar pesquisa de trofozoítas a fresco ou
pela coloração com lugol (BOA SAÚDE, 2009).
Nos casos especiais onde ocorre formação de abscesso hepático, o diagnóstico
é por imagem, utiliza-se exame de tomografia computadorizada ou ressonância
magnética, uma terceira opção é o exame de cintilografia. Pode-se, ainda, fazer o
diagnóstico através de reações sorológicas, com pesquisa de anticorpos IgG
específicos, mas estes serão positivos mesmo naqueles pacientes portadores do
parasita e assintomáticos. A prevenção é basicamente a ingestão de água clorada.
FIGURA 1 – Ameba
Fonte: http://recursos.cnice.mec.es/biosfera/alumno/1ESO/clasica/imagenes/ameba.jpg
Giárdia Lambria
É um protozoário flagelado de ciclo simples e direto, possui a forma trofozoítica
e cística. O habitat do trofozoíta é o intestino delgado, onde se multiplica e determina a
forma clínica sintomática, enquanto a forma cística é liberada nas fezes, sobrevive fora
do hospedeiro, contamina o ambiente e promove novas infecções por via oro-fecal. A
giardíase é uma das causas mais comuns de gastroenterites, diarréia e má-absorção
(REIS et al., 2007).
FIGURA 2 – Giárdia
Fonte:http://becauseitreallyispersonal.files.wordpress.com/2009/07/imgnamegiardia_lamblia_genome_sequenced-50226711-giardia.jpg
No Brasil a prevalência de giárdia varia de 4 a 30% dependendo das condições
sócio-econômicas e de saneamento da população. É considerada a principal causa de
diarréia com origem na contaminação de água (WERLE, 2009).
De acordo com WERLE (2009) a Giardia lamblia é um parasita monoxeno de
ciclo biológico direto. A via normal de infecção no homem é a ingestão de cistos, que se
transmitem principalmente por ingestão de
água sem tratamento, alimentos
contaminados ou fômites. Após a ingestão do cisto, o desencistamento é iniciado no
meio ácido do estômago e completado no duodeno e jejuno, onde ocorre a colonização.
Há um período pré-patente de 10 a 16 dias antes dos organismos poderem ser
detectados em amostras de fezes; e um período médio de incubação de oito dias antes
da manifestação dos primeiros sintomas.
A disseminação da giardíase ocorre por diversos fatores epidemiológicos:
1. Água de bebida ou de uso doméstico.
2. Alimentos vegetais ingeridos crus, tais como saladas, verduras e frutas, ou alimentos
servidos frios, como leite, refrescos, cremes, etc.
3. Contato direto por manipuladores de alimentos.
4. Contato direto de pessoa a pessoa ou como conseqüência de fezes expostas.
5. Contato indireto, através de artrópodes domésticos (moscas, baratas).
A maior parte dos casos de diarréia não-bacteriana na América do Norte é
causada pela Giardia, estimando-se em 2% da população americana a incidência de
infecção, com prevalência mais elevada em crianças. A giardose assintomática crônica
é mais comum em adultos que em crianças (HACHICH et al, 2009).
Em 1999 HACHICH et al., fizeram um levantamento em 28 rios do Estado de
São Paulo e encontraram 31,5% das amostras contaminadas por Giardia, estas águas
são utilizadas no abastecimento de cidades. Outro agravante é que a Giardia é
bastante resistente aos tratamentos convencionais, podendo sobreviver e tornar-se
problema de saúde para a população.
A profilaxia da giardíase é de difícil execução, uma vez que depende do
tratamento da matéria fecal e do lixo, mas também do combate aos insetos
carreadores. Outros cuidados devem ser dados à água e aos alimentos consumidos
crus, evitando a contaminação dos mesmos com os cistos dos protozoários. Medida
profilática importante é também a adoção da educação sanitária e da higiene pessoal.
Balantidium coli
Este é outro protozoário que pode afetar a saúde humana. É uma infecção pelo
maior protozoário ciliado, com incidência rara nos homens. Pode afetar vários insetos,
anfíbios, aves e mamíferos, especialmente porcos. Aproximadamente 25% dos seres
humanos infectados tiveram contato com suínos. Acomete principalmente os cólons,
podendo apresentar-se de três formas principais: assintomática, forma crônica, com
surtos diarréicos alternando com constipação, e forma aguda ou disentérica
(DOMINGUES, 2006).
FIGURA 3 – Balantidium coli
Fonte: http://www.oregon.gov/DHS/ph/phl/imglib/Balantidium.jpg
A prevenção se faz através da higiene adequada das mãos e dos alimentos, do
pleno cozimento de alimentos, da fervura ou filtração da água, do tratamento dos
doentes e de porcos (possíveis reservatórios do parasito).
Isospora belli
A Isospora belli é um coccídio, a transmissão tem sido considerada unicamente
pela via fecal-oral, sendo o homem seu único hospedeiro.
É uma infecção
autolimitante, ou seja, pode se resolver em alguns dias. O maior problema é quando
acomete pacientes imunossuprimidos (grávidas, crianças, aidéticos, diabéticos, idosos
etc). os sintomas são diarréia, cefaléia, febre, dor abdominal, vômito, desidratação e
perda de peso (FRENKEL, 2003).
FIGURA 4 – Isospora
Fonte:
http://www.scientificdevice.com/graphics/photos/normal%20size%20images/acrifluor%20
isospora0copy.JPG
Criptosporidium parvum
É também um protozoário coccídio. BRASIL (2004) informa que ao parasitar o
homem este microrganismo tem preferência pelas células epiteliais das vias
gastrointestinais, biliares e respiratórias. É um parasito encontrado em diversos animais
vertebrados e grandes mamíferos, o principal sintoma em animais ou pessoas
acometidos é a diarréia, independe da idade do portador.
A transmissão ocorre pela via fecal-oral de pessoas para animais ou de animais
para pessoas, após serem contaminados pelos oocistos estes levam de 14 a 25 dias
para esporular e a forma de disseminação é através de fezes contendo oocistos. Os
oocistos podem permanecer no ambiente por até seis meses desde que as condições
de umidade e temperatura sejam favoráveis (BRASIL, 2004).
FIGURA 5 – vilosidades intestinais parasitadas
Fonte: http://www.msd.com.ar/images/content/hcp/diseases/intestinoi.jpg
O Diagnóstico é feito a partir da identificação dos oocistos do parasita em exame
coprológico, biopsia de tecido intestinal, detecção do antígeno nas fezes através do
ensaio imunoenzimático (teste de ELISA) ou através de anticorpo monoclonal marcado
com fluoresceína (BRASIL, 2004).
13
Os grupos mais atingidos são os menores de dois anos, pessoas que manipulam
animais, viajantes, homossexuais e contatos íntimos de infectados.
As medidas profiláticas recomendadas em BRASIL (2004) incluem educação
sanitária, saneamento básico, higiene dos profissionais que lidam com bovinos, filtração
ou fervura da água de consumo, isolamento de pessoas portadoras, desinfecção de
ambientes contaminados pelo agente.
Microsporidium
A microsporidiose era bastante rara nos seres humanos até o surgimento da
AIDS. Nestes pacientes a condição de imunossupressão favorece o oportunismo de
protozoonoses. Destas as mais predominantes são a toxoplasmose, as coccidioses
intestinais e a pneumocistose. A identificação em 1985 de uma nova espécie parasita
do homem (Enterocytozoon bieneusi) e, a seguir, a observação de casos de
ceratoconjuntivite devido ao Encephalitozoon em pacientes com AIDS revelaram a
patogenia do microsporidium (BRASIL et al., 1997).
Segundo BRASIL et al. (1997) a prevalência da infecção por microsporídia nos
pacientes com AIDS e diarréia crônica varia de 7% a 50% no mundo, com ampla
distribuição geográfica: Alemanha, Austrália, Brasil, Canadá, Estados Unidos, França,
Inglaterra, Itália, Países Baixos, Porto Rico, Suíça, Zâmbia.
As fontes de infecção e o modo de transmissão da microsporidiose ainda não
foram definidos. Não se sabe se existe reservatório animal nem se há reservatório
intermediário vertebrado ou invertebrado.
O diagnóstico é realizado com a demonstração do parasita por microscopia
óptica ou eletrônica em exame direto, biopsia ou por imunofluorescência.
Diantamoeba fragilis
Este parasita é unicelular, foi descrito em 1918, encontrado no trato
gastrointestinal humano, podendo provocar doença ou não, depende do estado
imunológico da pessoa. Os trofozoítos quando são eliminados no meio ambiente
através das fezes são muito frágeis, característica que deu nome ao microrganismo. A
doença se manifesta por dor abdominal, diarréia e febre. É um tipo de ameba, porém
em sua evolução genética perdeu os cílios característicos da espécie.
Acredita-se que sua disseminação ocorre através de ovos de outros parasitas,
não existe ainda um ciclo definido.
Blastocystis hominis
Segundo MARCONDES (1998) o Blastocystis hominis é um protozoário
freqüentemente encontrado nas fezes de pessoas com e sem manifestações
gastrointestinais. De todos os microrganismos possíveis de serem observados nas
fezes B. hominis é o segundo mais freqüente, somente superado pelas leveduras. Há
grandes diferenças de prevalência entre uma região e outra, provavelmente em função
de fatores inerentes ao parasito que ainda não foram determinadas. Existe um
desconhecimento do ciclo deste protozoário, fator que dificulta a prevenção e controle
do mesmo. Alguns pesquisadores o considera um parasito de pouca importância, um
comensal, outros estão buscando decifrar sua biologia.
Entende-se que este parasita possui uma morfologia única, com constituição
bioquímica e genética diversas, o que possibilita potencialidades patogênicas diferentes
nas diversas regiões. Diferentes trabalhos sugeriram que tais conclusões estão corretas
(MARCONDES, 1998). Ainda paira a questão se este parasita é patogênico ou apenas
um comensal.
Cyclospora
De acordo com
CVE (2009) a ciclosporíase é uma doença diarréica, pode
apresentar um quadro moderado à severo e sintomas como náusea, anorexia, perda de
peso, inchaço, cólicas estomacais, flatulência, dor abdominal, dores musculares, fadiga,
às vezes vômitos; febre baixa, mais raramente. Infecções sem tratamento podem durar
de vários dias a um mês ou muito mais tempo, e podem seguir um curso decrescente.
Algumas infecções são assintomáticas.
O agente é um parasita protozoário coccídeo unicelular e foi reconhecido como
um patógeno emergente. A designação de Cyclospora cayetanensis foi dada em 1994
por um peruano que isolou Cyclospora em seres humanos. No entanto, ainda não está
estabelecido se todos os casos humanos são causados por esta espécie (CVE, 2009).
Diferente das coccidioses, os oocistos eliminados não são infectantes, a
esporulação só ocorre após dias ou semanas no ambiente em temperatura entre 26º a
30º C. Na forma infectante pode contaminar frutas, legumes e água, que serão veículos
para a ingestão. O oocisto ingerido libera no trato gastrointestinal o esporozoíta que
invade as células epiteliais do intestino delgado. Dentro das células eles sofrem
multiplicação assexuada e desenvolvimento sexual para originar oocistos maduros que
serão eliminados nas fezes (CVE, 2009).
É um protozoário de ocorrência mundial. Os primeiros casos foram relatados em
viajantes que retornaram do Sudeste da Ásia, Nepal, México, Peru, Ilhas Caribenhas,
Austrália, e Europa Oriental. Ainda segundo o CVE (2009) ocorreu no Brasil um surto
em General Salgado, cidade do Interior do Estado de São Paulo, notificado ao Centro
de Vigilância Epidemiológica, nos meses de setembro a novembro de 2000, e dentre os
mais de 350 casos de diarréia, conseguiu-se isolar de 20 amostras de fezes, 12 casos
positivos para a Cyclospora.
Acredita-se que o homem seja o reservatório da doença. Não há estudos que
comprovem que os animais possam se constituir em reservatórios para os seres
humanos. A transmissão é realizada por pessoas que ingerem água ou alimentos
contaminados com fezes infectadas, após o parasita realizar seu ciclo no trato
gastrointestinal é liberado no meio ambiente, em algumas semanas torna-se infectante
e contamina o ambiente, não há transmissão de ser humano para ser humano. Como a
contaminação é pela via hídrica ou alimentar podem ocorrer surtos dependendo da
quantidade de oocistos no alimento ou água ingeridos.
A documentação dos surtos demonstra que pessoas de todas as idades podem
ser infectadas, e que pode ser conferida uma imunidade às pessoas em comunidades
expostas à Cyclospora (CVE, 2009).
Segundo o CVE (2009) por ser um novo patógeno, com muitos aspectos
desconhecidos em seus mecanismos de transmissão, uma investigação bem detalhada
deve ser feita para estabelecer as fontes de transmissão. A detecção do parasita em
alimento e água exige técnicas de concentração e uso da biologia molecular, que já são
feitas nos Estados Unidos, e exige ainda maiores aperfeiçoamentos.
As medidas de controle são similares às realizadas no controle de outras
parasitoses,
inclui
notificação
de
surtos,
medidas
preventivas,
investigação
epidemiológica da doença.
FIGURA 6
- Corte histológico, vilosidade
intestinal parasitada por cyclospora (seta
vermelha) .
Fonte:
http://www.som.tulane.edu/classware/pathol
ogy/medical_pathology/McPath/GICD/image
s/SI/m/si5_01.jpg
Sarcocystis sp
É um protozoário heteroxênico, encontrando em uma grande variedade de
animais mamíferos, é um
parasita cosmopolita. Tem como hospedeiro definitivo o
homem, o cão e o gato. A sarcocistíase atinge pessoas com padrões de vida e de
higiene bastante diferenciados, visto que é adquirida através da carne de suínos ou
bovinos que não passarão por cozimento adequado.
A sarcocistose é uma doença grave para os hospedeiros intermediários (HI) em
todo mundo. Diferentes espécies estão associadas ao ciclo presa-predador. Algumas
espécies de Sarcocystis foram bem estudadas onde os esporocistos eliminados pelos
hospedeiro definitivo (HD) são infecciosos para o HI, da mesma maneira que os cistos
dos HI são fonte de infecção para os HD. Já, outras espécies de Sarcocystis estão
associadas a um complexo ciclo evolutivo, tais como: répteis, aves de rapina e
marsupiais sulamericanos. Entre os carnívoros, o cão e o gato são os HD melhor
estudados por estar envolvidos com animais de produção e ser humano (LOPES,
2004).
O sarcocystis tem um ciclo biológico bastante complexo.
Possui uma fase
assexuada e outra sexuada. O ciclo assexuado ocorre no tubo digestivo dos
hospedeiros definitivos, estes eliminam oocistos no ambiente que após passarem por
esporulação contaminam o solo e ambiente (água e pastagem).
Ocorre então a
ingestão do oocisto esporulado por hospedeiros intermediários (bovinos ou suínos), no
HI ocorre a formação de cistos teciduais (musculatura lisa e estriada), o ciclo se
completa com a ingestão da carne contendo os cistos viáveis. Quando o hospedeiro
definitivo ingere carne contaminada por Sarcocystis, os cistozoítos, antes contidos no
cisto tecidual, penetram na mucosa intestinal e ali desenvolvem seu ciclo sexuado.
A prevenção basicamente ocorre com o cuidado com a água de bebida e com a
ingestão de carnes devidamente cozidas. As lesões por este parasita são mínimas,
portanto assintomáticas. Os casos diagnosticados em
humanos são raros.
Recomenda-se não alimentar cães e gatos com carnes cruas como uma das maneiras
de quebrar o ciclo do parasita, principalmente se estes animais tiverem acesso a local
de produção de bovinos ou suínos, esta prevenção vale também para o ciclo da
toxoplasmose.
HELMINTOS
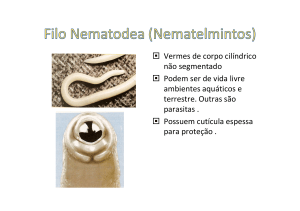
NEMATELMINTOS – Vermes cilíndricos não segmentados
Áscaris lumbricóides
A espécie Ascaris lumbricoides é o nematódeo mais conhecido por ser muito
comum na espécie humana. Mesmo na atualidade, com o avanço da medicina ainda é
considerado um importante problema de saúde pública, afetando principalmente
crianças em idade escolar. No Brasil, diversos estudos realizados em pré-escolares e
escolares mostraram elevada prevalência dessa parasitose intestinal (CAMPOS et al.,
2002).
STORER & USINGER (1989) afirmam que o ambiente exerce um importante
papel na transmissão da parasitose, já que os ovos embrionados do Ascaris
lumbricoides, quando eliminados no solo pelas fezes do hospedeiro definitivo, não
possuem capacidade de infecção. Para que os ovos se tornem infectantes é necessário
que as condições ambientais sejam favoráveis, neste aspecto o Brasil é um país
bastante favorável porque oferece clima quente e úmido quase o ano todo. Nestas
condições os ovos tornam-se viáveis em três ou quatro semanas, contaminado água e
solo.
Os fatores sociais podem ser indicados pela prevalência elevada de
A.
lumbricoides, visto que a alta incidência está associada a precárias condições
sanitárias. As condições ambientais e sociais como: área geográfica estudada, tipo de
comunidade (aberta ou fechada), nível socioeconômico, acessibilidade a bens e
serviços, estado nutricional, idade e ocorrência de predisposição à infecção parasitária
são fatores que indicam o grau de acometimento da população (CAMPOS et al, 2002).
Ainda segundo estes autores o grau de educação materna é decisivo para evitar
a contaminação. A mãe que teve algum tipo de educação sanitária terá maior
habilidade no cuidado com a criança. Afirmam que a higiene é condição fundamental no
controle desta parasitose.
A localização deste parasita ocorre principalmente no jejuno e íleo, ficam presos
à mucosa de onde obtêm nutrientes. A transmissão ao ser humano ocorre pelas vias
hídrica ou alimentar. Moscas e baratas podem veicular os ovos mecanicamente
aderidos em seus membros. O controle de vetores é importante para prevenção de
verminoses.
A presença do parasita na luz intestinal causa diversos danos ao portador, tais
parasitas têm a capacidade de espoliar proteínas, carboidratos, lipídios e vitaminas A e
C. Dependendo da infestação podem levar crianças à condição de subnutrição. Outro
dano produzido é a ação tóxica, isto ocorre em função da reação imunológica do
hospedeiro na tentativa de eliminar o agressor.
FIGURA 7 – A.Lumbricóides
Fonte: http://io.uwinnipeg.ca/~simmons/16labman05/lb5pg9_files/ascaris_posterior_end_label.jpg
O diagnóstico é unicamente laboratorial através do exame coprológico. A
identificação de ovos é realizada pelos métodos de sedimentação espontânea ou por
centrifugação.
A alta prevalência deste helminto, como já foi mencionado, é de difícil controle
visto que vários fatores contribuem para a sobrevivência deste parasita como:
temperatura anual elevada, umidade, viabilidade dos ovos por meses, grande produção
de ovos pelas fêmeas, dispersão dos ovos através de vento, chuva e moscas,
condições higiênicas precárias nos peridomicílios.
A profilaxia desta parasitose ocorre por medidas como educação sanitária,
construção de fossas sépticas onde não há rede de esgoto, tratamento da população,
cuidados com a água e os alimentos, controle de insetos (baratas, moscas, mosquitos).
Ancylostoma
Os ancylostomas são vermes que parasitam animais e humanos, pertencem à
família nematoda onde são descritos também o A.lumbricoides (ascaridíase)
Ancylostoma duodenale (amarelão), Necator americanus (amarelão), Ancylostoma
braziliensis (bicho geográfico), Oxyurus vermicularis (oxiúros).
Parasitas como Ascaris lumbricoides, Trichuris trichiura e ancilostomídeos
acometem cerca de um bilhão de pessoas, distribuindo-se globalmente por mais de 150
países e territórios, além de apresentar alta prevalência na população pediátrica.
Estimativas recentes indicam que as infecções helmínticas são a causa básica de todas
as doenças que afligem 12,3% dos meninos e 11,4% das meninas em países em
desenvolvimento (MACEDO 2005, citado por MACEDO et al., 2008).
Para MACEDO et al., (2008) a alta prevalência de parasitoses intestinais no
Brasil tem maior ocorrência nas regiões norte e nordeste, isto em função da deficiência
de saneamento básico, precária educação sanitária da população em associação com o
baixo nível de renda e qualidade dos serviços de saúde.
A parasitose por ancylostomídeos, também conhecida como amarelão ou malda-terra, geralmente desencadeia um processo patológico de curso crônico, podendo
ser fatal em casos mais graves. Existem mais de 100 espécies de Ancylastomatidae
descritas, neste universo apenas três são encontradas em seres humanos:
ancylostoma duodenale, necator americanus e ancylostoma cylanicum.
Os ancylostomídeos têm ampla distribuição geográfica. O A. duodenale, é
considerado como ancilostama do velho mundo. O N. americanus, conhecido como
ancilostoma do novo mundo, ocorre em regiões tropicais onde predominam
temperaturas altas.
Ancilostoma duodenale
Os adultos machos e fêmeas são bilindriformes, possuem a extremidade anterior
curvada no sentido dorsal, cápsula bucal profunda, com dois pares de dentes ventrais
na margem interna da boca e um par de lancetos ou dentes triangulares subventrais no
fundo da cápsula bucal. Manchas medindo 8 a 11 mm de comprimento por 400 µm de
largura; extremidade posterior com bolsa capsuladora bem desenvolvida, gubernáculo
bem evidente. Fêmeas com 10 a 18 mm de comprimento por µm de largura; abertura
genital (vulva) no terço posterior do corpo;
Ancylastoma cylanicum
Os
Adultos com morfologia geral semelhante à de A. duodenale, mas com
detalhes que facilitam distingui-lo: apresenta cápsula bucal com dois pares de dentes
ventrais. Manchas com 8 mm de comprimento por 360 µm de largura.
Necator americanus
Os adultos apresentam a forma cilíndrica, com extremidade cefálica bem
recurvada dorsalmente; cápsula bucal profunda, com duas lâminas cortantes,
semilunares, na margem interna da boca, com um dente longo, ou cone dorsal.
Manchas menores do que a fêmeas, medindo 5 a 9 mm de comprimento por 300 µm de
largura, com abertura genital próxima ao terço anterior do corpo.
A contaminação por ovos das fêmeas de ancilostomas presentes no intestino
delgado do hospedeiro, ocorre quando estes são eliminados para o meio exterior
através das fezes. No ambiente os ovos precisam de boa oxigenação, alta umidade e
temperatura elevada. Após a eclosão dos ovos as larvas apresentam movimentos de
serpente e se alimentam de matéria orgânica, passando então a se transformar em
larva de terceiro estádio, denominada larva infectante. É a única forma infectante para o
hospedeiro.
A transmissão para homens ou animais ocorre com a penetração destas larvas
na pele ou pela ingestão em água ou alimentos. Os parasitas no intestino podem
provocar sintomas como dor gástrica, diminuição do apetite, indigestão, cólicas,
náuseas, vômitos, flatulência ou diarréia sanguinolenta. A anemia é produzida no
hospedeiro pela espoliação do ferro. O diagnóstico é obtido através de exames de
fezes do hospedeiro.
Quanto
à
ancilostomose
por
A.
duodenale
e
N.
americanus
ocorre
preferencialmente em crianças com mais de seis anos, adolescentes e em indivíduos
mais velhos, independente do sexo. Neles, os parasitas podem sobreviver por até 18
anos. Nos pacientes, o A. duodenale e o N. americanus produzem em média,
diariamente, 9 mil a 22 mil ovos.
A profilaxia é basicamente a mesma para todas as parasitoses: engenharia
sanitária (saneamento básico), educação sanitária e suplementação alimentar de ferro
e proteínas e principalmente não andar descalço. A estas medidas também se associa
o uso de anti-helmíntico embora seja de uso curativo.
FIGURA 8 : Bicho geográfico – Ancylostoma braziliensis (cão)
Fonte: http://www.giorgiogveterinario.it/blog/uploaded_images/ancilostoma-in-piede-775943.jpg
FIGURA 9 : Ancylostoma duodenale
Fonte: http://www.fiocruz.br/~ccs/arquivosite/glossario/ancilostomose.jpg
FIGURA 10 – Ovos de ancylostoma sp
Fonte: http://www.rumandd.com/images/schistossoma_mansoni_casal_pequeno
Enterobius vermiculares
A gravidade das parasitoses parece estar aumentando mundialmente devido a
um aumento da resistência a antimicrobianos e a um número crescente de hospedeiros
susceptíveis, sobretudo portadores de HIV (FERRARI & RODRIGUES, 2004).
Os vermes categorizados de helmintos são macroparasitas e dependendo da
infestação podem produzir obstrução mecânica no intestino e causar diversas
patologias como: apendicite aguda, oclusão intestinal, enterite, necrose, perfuração e
peritonite, em caso de migração podem causar abscessos hepáticos, colangite,
colecistite, pancreatite, infecções ginecológicas e urinárias (FERRARI & RODRIGUEZ,
2004).
O enterobius vermiculares é popularmente conhecido como oxiúros. Também é
uma verminose de distribuição geográfica mundial, apresentando maior incidência nas
regiões de clima temperado. As crianças são as mais afetadas, apesar de ser
encontrado também em adultos.
Machos e fêmeas vivem no ceco e no apêndice. As fêmeas, repletas de ovos (5
a 16 mil ovos), são encontradas na região perianal. Em mulheres, às vezes pode-se
encontrar esse parasita na vagina, útero e bexiga.
Os enterobius vermiculares possuem as seguintes características: Verme pino
ou Alfinete. Semelhante a pequeno fio de algodão (0,5 a 1 cm). Ciclo vital: Duração: 2 a
7semanas. Ovos embrionados (viáveis:2-6sem.) região perianal contaminando roupas
de cama e íntima, mãos, água e alimentos, boca. Ao ser ingerido ocorre a liberação da
larva e transformação desta em
verme adulto (macho e fêmea), estes copulam e
buscam o seu hábitat (ceco e apêndice), fazem a fixação à mucosa pela região cefálica.
A fêmea repleta de ovos realiza a migração para a região perianal onde deposita seus
ovos embrionados (GASTALDI, 2009).
Após a cópula, os machos são eliminados junto com as fezes e morrem; as
fêmeas, repletas de ovos, se desprendem do ceco e dirigem-se para o ânus. No
intestino delgado, as larvas rabditóides eclodem e sofrem duas mudas no trato intestinal
até o ceco, aí chegando transformam-se em vermes adultos.
O paciente sente um ligeiro prurido anal, pode provocar enterite catarral por ação
mecânica e irritativa. O ceco apresenta-se inflamado e às vezes, o apêndice também é
atingido. Pode ocorrer a perda do sono, nervosismo, vaginite e salpingite.
A profilaxia inclui cuidados com as roupas de cama, esta não deve ser sacudida
pela manhã, deve ser lavada todos os dias em água fervente. O tratamento deve ser
repetido de 2 a 3 vezes com intervalo de 20 dias. Aplicação de pomada na região
perianal e corte rente das unhas.
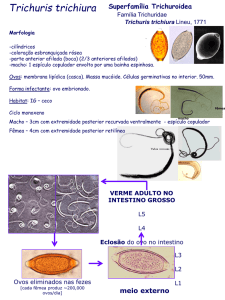
Trichuris thichiura
No gênero Trichuris existem várias espécies encontradas no ceco de diferentes
hospedeiros, tais como T. vulpis, em cães, T. discolor, em bovinos, T. suis em suínos e
T. thichiura em homens e macaco.
A fêmea mede cerca de 4 cm, ovários e útero únicos, que se abrem na vulva,
localizada na transição da parte fina para a robusta e o macho mede cerca de 3 cm,
possui um só testículo, canal deferente, canal ejaculador e espículo; extremidade
posterior fortemente recurvada ventralmente, apresentando um espículo protegido por
bainha.
O ovo do trichuris trichiura mede apenas 50 micra de comprimento por 22 de
largura, com aspecto típico de um pequeno barril, arrolhado nas duas extremidades por
uma massa mucóide transparente. Estes vermes vivem com a parte anterior na mucosa
do ceco, por vezes são encontrados no apêndice, cólon e íleo.
O ciclo é bem similar ao de outros helmintos, a fêmea põe os ovos, estes são
depositados no meio ambiente pelas fezes, em condições de temperatura e umidade
favoráveis os ovos tornam-se infectantes,
são bastante resistentes e podem ser
carreados pelo vento, se ingeridos através de água ou alimentos estes ovos eclodem
no intestino e as larvas migram para o ceco.
A gravidade da parasitose ocorre na presença de grande número de helmintos,
causam anemia e prolapso retal. O diagnóstico é feito pelo método de sedimentação
onde os ovos são visualizados.
Nos casos de verminose, geralmente o hospedeiro apresenta mais de uma
espécie de parasita, o tratamento é feito com medicamentos de amplo espectro para
que se consiga eliminar as diferentes espécies. Os vermes denominados “chatos”,
como as taênias, normalmente não são sensíveis aos vermicidas utilizados para matar
os vermes “redondos”.
FIGURA 11 – Ovo de Trichuris thichiura
Fonte:http://www.insecta.ufv.br/Entomologia/ent/disciplina/ban%
0160/Importancia%20medica/trichuris%20ovo.jpg
Strongyloides stercoralis
O Strongyloides stercoralis, observado por Normand em soldados franceses
oriundos da Cochinchina (atual Vietnã), e primeiramente descrito por Bavay, em 1876, é
o menor dos nematódeos que parasitam o homem em nosso meio e apresenta uma
peculiaridade interessante: a única forma parasitária adulta (no intestino delgado
humano) é a fêmea partogenética. Nessa espécie, o macho só existe na fase do ciclo
de vida livre (CAMPOS, 2009).
Segundo este mesmo autor esse helminto apresenta dois ciclos evolutivos: o
ciclo direto no qual as larvas rabditóides chegam ao exterior junto com as fezes; sendo
depositadas em terreno arenoso, umidade alta e à temperatura de 25 a 30º C, as larvas
transformam-se em larvas filarióides infectantes em 24 a 72 horas. O segundo tipo é o
indireto ou de vida livre, no qual as larvas rabidtóides, transformam-se em machos e
fêmeas de vida livre. Estas formas realizam a cópula e as fêmeas iniciam a oviposição.
Os ovos tornam-se embrionados, as larvas rabditóides eclodem, esse ciclo demora
cerca de dois a quatro dias.
A transmissão ocorre por penetração na pele íntegra ou ingestão. As larvas
penetram nos pés e entram na corrente sanguínea, sofrem muda, vão até o pulmão,
migram até o sistema respiratório superior, são então deglutidas. As larvas que são
ingeridas têm que penetrar na mucosa oral porque se chegarem ao estômago serão
inativadas pelo suco gástrico.
De acordo com CAMPOS (2009) O estado imunológico parece contribuir de
maneira efetiva na sobrevivência do parasita e podem ser observadas em três níveis:
cutâneo, pulmonar e intestinal. Outros sintomas gerais e comuns a estrongiloidose
crônica são: anemia, diarréia, astenia, insônia, sudorese, tonturas, inapetência,
emagrecimento, desidratação, irritabilidade, depressão nervosa e eosinofilia. Em casos
severos da doença podem ocorrer complicações como oclusão intestinal ou íleo
paralítico e mesmo possibilidade de perfuração intestinal.
A prevenção e o controle são idênticos aos já descritos para outros
nematelmintos.
Platelmintos cestódeos – vermes chatos segmentados
Estão neste grupo as Taênias spp,
Diphyllobotrium latum e Dipylidium caninum.
Complexo teníase/ cisticercose
Hyminolepis nana, Hyminolepis diminuta,
A importância do complexo teníase/cisticercose para a saúde pública deve-se ao
fato de o homem ser o hospedeiro definitivo de Taenia solium e também ser o
hospedeiro intermediário da fase larval, onde o
Cysticercus cellulosae, aloja-se no
sistema nervoso central, desenvolvendo a patologia denominada neurocisticercose,
esta situação ainda é encontrada em todo o Brasil (SILVA et al., 2007).
A neurocisticercose é uma patologia classificada dentro das zoonoses, é um
grave problema de saúde pública porque pode trazer seqüelas irreversíveis aos
portadores gerando prejuízos humanos e financeiros.
Taênia Solium/ Teníase
A teníase e a cisticercose são duas entidades mórbidas distintas, causadas pela
mesma espécie, porém com fase de vida diferente. A teníase é uma alteração
provocada pela presença da forma adulta da T. Solium ou da T. Saginata, no intestino
delgado humano. A cisticercose é uma alteração provocada pela presença da larva nos
tecidos de seus hospedeiros.
De acordo com o CVE (2009) a cisticercose suína é uma doença parasitária com
origem na ingestão de ovos de Taênia solium, cujas formas adultas têm o homem
como hospedeiro final. Normalmente, os suínos apresentam apenas a forma larval
(Cysticercus cellulosae). O quadro clínico da teníase no homem pode acarretar dor
abdominal,
anorexia
e
outras
manifestações
gastrointestinais,
sem
provocar
conseqüências mais sérias.
Os cisticercos (ovos larvados) quando localizados no cérebro humano podem
gerar manifestações graves, provocar convulsões, dores de cabeça ou distúrbios
visuais podendo levar o indivíduo à morte.
Segundo o CVE (2009) é comum a infecção permanecer assintomática durante
anos ou até mesmo nunca se manifestar. O quadro clínico é variável, depende do
número de cisticercos alojados, em casos mais graves ocorre a hipertensão
intracraniana causando meningoencefalite e distúrbios de comportamento.
A Taênia solium é o agente transmitido ao homem, geralmente através da
ingestão de carnes de suínos. O homem adquire teníase quando ingere carne suína
crua ou parcialmente cozida contendo cisticercos. Os suínos, por outro lado, adquirem
cisticercose quando ingerem ovos de T. solium, presentes no ambiente contaminado
por matéria fecal de seres humanos. Do mesmo modo que o suíno, o homem pode
adquirir cisticercose a partir da ingestão de ovos de T. solium, presentes em alimentos
contaminados com matéria fecal de origem humana, sobretudo verduras cruas, ou por
auto-infecção, através das mãos e roupas contaminadas com as próprias fezes (CVE,
2009).
Figura 12 - Taênia Saginata
Fonte:http://www.ufrgs.br/parasite/siteantigo/Imagensatlas/Animalia/Imagens/tsaginata.jpg
FIGURA 13 – Ciclo de vida
Fonte: CVE (2009)
Ainda de acordo com CVE (2009) a cisticercose humana é de ocorrência
mundial, é freqüente na América Latina, na Europa Oriental, na África e no sudeste da
Ásia. Existem muitos casos no México, Guatemala, El Salvador, Peru, Chile e Brasil. O
ciclo da infecção-transmissão ocorre em situação de carência de saneamento, onde há
uma convivência muito próxima de homens e porcos, e a alimentação com carne mal
passada é um costume, é uma doença rara em países muçulmanos, visto que estes
não têm o hábito de se alimentar com carne desta espécie animal devido à
religiosidade.
Os reservatórios são os homens e os suínos. O homem é hospedeiro definitivo
(HD) e os porcos hospedeiros intermediários (HI).
O ser humano se contamina por três formas:
1- Por auto-contaminação (por ovos contidos nas fezes)
2 - Por movimentos retroperistálticos do intestino,
3 - Através da ingestão de alimentos ou água contaminada com ovos
O período de incubação da cisticercose pode variar de 1 a 35 dias, mas
geralmente, o quadro clínico manifesta-se entre 2 a 5 anos pós-infecção (CVE, 2009).
A teníase é diagnosticada a partir de exames coprológicos, já a cisticercose é
encontrada através de outros métodos: exame de líquido cefalorraquidiano, provas
sorológicas
(ELISA,
Imunoeletroforese,
Imunofluorescência
indireta),
exames
radiológicos, tomografia computadorizada, exames anatomopatológicos (ante-mortem
ou pós-mortem).
Em CVE (2009) informam que os ovos das tênias de suíno e de bovino não são
diferentes, não há como identificá-los, ovos das duas espécies são constituídos por
uma casca protetora denominada embrióforo, que é formado por blocos piramidais de
quitina, unidos entre si por uma substância protéica.
O cisticerco é constituído de escólex com quatro ventosas, estas larvas podem
atingir até doze milímetros de comprimento, após quatro meses de infecção.
É possível diferenciar o verme conforme as características descritas no Quadro1:
QUADRO 1 - As principais diferenças entre a T. solium e a T. saginata
Escólex
Proglotes
Taenia solium
Globoso
Taenia saginata
Quadrangular
Com rostro
Sem rostro
Com dupla fileira de acúleos
Sem acúleos
Ramificações uterinas pouco Ramificações uterinas muito
numerosas, de tipo dendrítico
numerosas, de tipo dicotômico
Saem passivamente com as Saem ativamente no intervalo
fezes
das defecações
Cysticercus
Cisticercose
humana
Ovos
C. cellulosae
C. bovis
Apresenta acúleos
Possível
Não apresenta acúleos
Não comprovada
Indistinguíveis
Indistinguíveis
Fonte: CVE (2009).
As medidas de controle envolvem medidas preventivas e curativas.
- Quando ocorre teníase/cisticercose indica que as condições sanitárias de
criação dos animais estão insatisfatórias.
- É possível erradicar esta verminose através do controle no homem, visto que
este é o hospedeiro definitivo do verme.
- As drogas vermicidas são eficientes.
- Efetuar a construção de fossas sépticas para controlar os dejetos humanos.
- Utilizar água potável para cozimento e bebida.
- Cozinhar bem todos os alimentos, inclusive as carnes.
- Não consumir carnes que apresentem “cangiquinha”, que são larvas encistadas
no tecido muscular.
- Realizar triagem para identificar pessoas ou animais contaminados e efetuar o
tratamento com vermicidas.
- Realizar educação sanitária com as pessoas que lidam com os animais de
criação.
- Congelar a carne suína e bovina a temperatura abaixo de –5° C, por no mínimo
4 dias, para depois consumir.
- Dar preferência ao consumo de carnes suínas ou bovinas que tenham sido
inspecionadas pelo SIF (Serviço de Inspeção Federal).
- Informar a autoridade sanitária local da ocorrência da verminose.
- Higienização das instalações, cochos, e demais instrumentos utilizados no
manejo com os animais.
- Manter uma vigilância constante, sempre alertando para os perigos
relacionados às verminoses, não apenas com o complexo teníase/cisticercose mas
também com outros grupos de helmintos.
A Taênia saginata é específica de bovinos, tendo como hospedeiro definitivo o
homem, assim como a Taênia solium.
FIGURAS 14 e 15 : Taênia solium , ovo de T.Solium
Fontes: http://www.stanford.edu/group/parasites/ParaSites2006/Taenia_solium/Home.html e
http://www.portalsaofrancisco.com.br/imagem.php
Hymenolepis
São conhecidas duas espécies distintas: Hymenolepis nana e Hymenolepis
diminuta. A Hymenolepis nana, é um platelminto cestódeo também chamada de "tênia
anã" do homem, por ser uma espécie menor que as outras taênias. A patologia
provocada por esta verminose chama-se Himenolepíase, atinge principalmente as
crianças entre 2 e 9 anos. Como em todas as outras verminoses está relacionada com
hábitos inadequados de higiene. A criança pode carrear os ovos embaixo das unhas,
estes sobrevivem no ambiente por mais de dez dias.
A
Hymenolepis diminuta, apesar de ser um parasita comum em roedores,
também pode infectar o homem, sendo assintomática, ou podendo causar quadros
diarréicos.
Este parasita encontra-se bem distribuídos em regiões de climas quentes, sua
maior incidência no Brasil foi registrada na região sul devido à existência de ambientes
fechados pelo frio e ambientes coletivos como creches.
Morfologicamente o ovo mede 40 mm de diâmetro, possui duas membranas,
uma externa e uma interna, a qual apresenta em dois pólos, mamelões de onde irão se
originar filamentos longos. O verme adulto mede de 3 à 5 cm, possui de 100 à 200
proglotes, seu escólex é retrátil e armado com ganchos, e habita o intestino delgado do
homem. O ovo da H. diminuta só se diferencia do ovo da H. nana, por ser maior,
chegando a medir cerca de 70-80 mm de diâmetro.
O ciclo biológico deste platelminto pode ser de duas formas: monoxênico ou
heteroxênico. O monoxênico ocorre quando o hospedeiro definitivo (homem) ingere
água ou alimentos contendo ovos, estes eclodem no intestino e se fixam, tornam-se
adultos e liberam novos ovos que irão para o meio ambiente através das fezes do
hospedeiro. No ciclo heteroxênico os parasitas habitam cavidades de pulgas ou
carunchos (HI), liberam ovos que são disseminados pelos insetos, ocorre a
contaminação de alimentos ou água que são ingeridos pelo ser humano, os ovos
eclodem e tornam vermes adultos dando continuidade ao ciclo.
A prevenção, diagnóstico e controle devem ser ações paralelas para se obter
uma boa profilaxia.
Diphyllobotrium latum
Difilobotriose é causada em humanos pela infecção com vermes adultos do
gênero Diphyllobothrium adquiridos pelo consumo de peixe cru ou mal cozido, é
também conhecido como a taênia do peixe (EMMEL et al., 2006).
Conforme relatado por EMMEL et al. (2006) A difilobotriose ocorre em áreas
onde lagos e rios coexistem com o consumo humano de peixe cru, mal cozido ou
defumado. Estas áreas são encontradas na Europa, Rússia, América do Norte e Ásia.
Somente dois países na América do Sul, Chile e Argentina, reportaram casos de
difilobotriose por D. latum. O D. latum é endêmico nos lagos e deltas não poluídos do
hemisfério norte e o D. pacificum ocorre na América do Sul.
Uma grande variedade de parasitas têm sido identificada em peixes crus. O
crescimento do hábito de ingestão de peixes ou outros animais marinhos sem o devido
cozimento, colocam o homem em maior contato com parasitoses ainda pouco
difundidas. De acordo com EMMEL et al. (2006) dos cestódeos que infectam peixes e
humanos, o gênero Diphyllobothrium apresenta a maior importância; este parasita
desenvolve sua maturidade sexual no trato intestinal de mamíferos. O D. latum é
encontrado na carne de peixes frescos de água doce ou de água salgada que migram
para água doce para a reprodução (exemplos: salmão e truta).
Os hospedeiros definitivos do D.latum
são os ursos e os humanos. Este
cestódeo tem morfologia similar a outras taênias, são largos e longos, podendo variar
de dois a dez metros de comprimento. O D.pacificum é encontrado em focas ou outros
mamíferos marinhos. O ciclo inicia com a liberação de ovos imaturos nas fezes, em
contato com a água liberam os coracídios, pequenas larvas que são ingeridas por
crustáceos, onde ocorre a transformação em outra larva (procercóide). Estes
crustáceos são ingeridos por peixes e as larvas infectam seu intestino. Ao ingerir
alimentos preparados com peixes crus a partir de filé de salmão ou trutas o homem se
infecta e propicia o crescimento da larva para verme adulto.
Como medida profilática deve ser recomendada a inspeção visual do peixe, o
consumo após o congelamento à temperatura de -20º C por 7 dias ou de -35º C por 15
horas, o que inviabiliza os parasitas e, desta forma, ser possível a ingestão crua.
Também é importante a prevenção da infecção pelo cozimento adequado dos peixes,
dar destino higiênico aos excretos humanos, a inspeção do pescado e o congelamento
adequado dos peixes nos frigoríficos (EMMEL et al., 2006).
Dipylidium caninum
A procura de animais de companhia vem aumentando, inclusive para o emprego
em terapias alternativas com crianças hospitalizadas e para estímulos táteis e visuais
em pessoas especiais. O estreitamento das relações entre os animais e o homem
promove uma maior exposição humana aos agentes de zoonoses, principalmente de
indivíduos portadores de doenças imunossupressivas, representando riscos à saúde
pública (SILVA et al., 2001).
O Dipylidium caninum é um helminto cestódeo, cujos hospedeiros definitivos
naturais incluem canídeos e felídeos domésticos e selvagens. Os ovos são ingeridos
por pulgas ou piolhos do cão, e no intestino destes formam cisticercos; a infecção se dá
pela ingestão acidental das pulgas pelos animais e pelo homem. O verme adulto mede
de 20 a 40 cm.
A infecção humana é geralmente assintomática, mas em crianças pode ocorrer
dor abdominal, diarréia, inquietação e prurido anal. O diagnóstico se faz pela
visualização dos proglotes, cápsulas ovígeras e ovos nas fezes.
A profilaxia em animais de companhia é feita, principalmente, com o uso de
fármacos anti-helmínticos, com combinações entre princípios ativos para ampliar o
espectro de ação. Os protozoários, nematelmintos (vermes cilíndricos) e os platelmintos
(vermes achatados) não são sensíveis aos mesmos medicamentos,
fazendo-se
necessário orientação de um profissional médico veterinário para realizar a melhor
indicação, bem como a orientação do intervalo de doses para manter o animal sempre
isento de vermes.
Sempre que ocorrer a desverminação dos animais realizar também o controle de
pulgas, estas são transmissoras da verminose podendo reinfectar o animal após
tratamento.
Platelmintos trematódeos – vermes chatos não segmentados
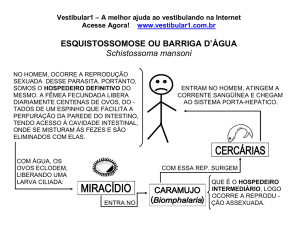
Schistossoma mansoni
A esquistossomose é uma doença causada por um pequeno verme trematódeo
chamado Schistosoma mansoni que, são albergados pelos caramujos (HI), a água é um
meio de transmissão e ao atingir a fase adulta, vive nos vasos sangüíneos do homem.
O homem é o reservatório definitivo, os vermes adultos alojam-se nos pulmões
ou fígado onde alcançam até 12 mm de comprimento por 0,44 mm de diâmetro,
podendo viver também em pequenas veias do intestino.
Os hospedeiros intermediários sãos moluscos de água doce, pertencentes ao
gênero Biomphalaria, conhecidos como planorbídeos e, popularmente conhecidos
como caramujos. Esses caramujos têm a concha em espiral, com as voltas ou giros no
mesmo plano, criam-se e vivem na água doce de córregos, riachos, alagados, brejos,
açudes, represas ou outros locais onde haja água levemente parada. Das várias
espécies de caramujos existentes em nosso meio, três são possíveis transmissoras de
S. mansoni: Biomphalaria tenagophila, B. glabrata e B. straminea.
O ciclo do S.mansoni ocorre em duas fases: O indivíduo portador elimina nas
fezes ovos do parasita, estes ovos em contato com água rompem-se e liberam as
larvas chamadas miracídios, são ciliadas e nadam até encontra o hospedeiro
intermediário, o caramujo. Em um período máximo de trinta dias as larvas albergadas
no caramujo tornam-se cercárias, fase em que são eliminadas na água.
As cercárias libertam-se, nadam ativamente, podendo permanecer vivas por
algumas horas, dependendo das condições ambientais. Ao penetrar na pele de
pessoas, iniciam nova fase de seu ciclo. No homem, as cercárias alcançam a corrente
sangüínea, passando pelos pulmões, coração até chegar ao fígado. Este processo
ocorre em dez dias. No vigésimo sétimo dia, já se encontram vermes acasalados e a
postura de ovos pode começar no trigésimo dia. A partir do quadragésimo dia, ovos
podem ser encontrados nas fezes.
Para a sobrevivência do S.mansoni existem algumas condições: que o homem
elimine ovos nas fezes, que estes ovos encontrem a água, dependem da existem do
caramujo hospedeiro e por fim do contato de outro ser humano com a água contendo
cercárias.
Estas condições são encontradas em regiões onde a população vive à
margem de rios ou alagados e não efetuam severo controle dos dejetos humanos.
Segundo CAMPOS (2009) a esquistossomose é uma doença cosmopolita.
Ocorre
na região do Oriente próximo (Israel, Arábia Saudita, Iêmen, Iran, Iraque),
grande parte da África (Egito, Líbia, Moçambique, Camarões, Nigéria, Angola, etc),
Antilhas (Porto Rico, República Dominicana) e América do Sul (Venezuela e Brasil).
No Brasil, também é conhecida pelos nomes de: xistosa, doença do caramujo,
barriga dágua, xistosomose e bilharzíose, apresenta ampla distribuição, atingindo
Estados do Norte (Pará, Rondônia), todo o Nordeste brasileiro, a região Sudeste (Rio
de Janeiro, São Paulo, Minas Gerais, Espírito Santo), a região Sul (Paraná e Santa
Catarina) e o Centro-Oeste (Goiás e Distrito Federal).
O acompanhamento epidemiológico da esquistossomose ficou restrito às áreas
de maior importância no Brasil. Ocorre, esporadicamente, a notificação de casos em
municípios novos, mostrando que a transmissão da doença continua em localidades
onde não se conhece a real situação epidemiológica, uma vez que a realização de
censos coprológicos para a verificação desta situação deixa de ser realizada em
detrimento de outros programas de saúde de maior prioridade (CAMPOS 2009).
A pessoa doente pode ou não apresentar sintomas, podendo ficar anos sem
qualquer manifestação. Quando a doença clínica se manifesta pode ocorrer de duas
formas: em fase aguda ou em fase crônica.
Fase aguda: Geralmente só é percebida em pessoas de área não endêmica e
depende do número de cercárias infectantes. Inicialmente, surge coceira e vermelhidão
no local de penetração da cercária. O infectado pode apresentar febre, sudorese,
cefaléia, dores musculares, cansaço, inapetência, emagrecimento, tosse, dor
abdominal.
Fase crônica: pode ser de três formas: intestinal, hepato-intestinal e
hepatoesplênica.
O diagnóstico é laboratorial, são procurados ovos do verme nas fezes do
paciente, os métodos podem ser por sedimentação espontânea, método de Kato, Kato-
Katz, ou por biópsia retal e métodos sorológicos, as informações clínicas do pacientes
com sintomas podem ajudar na composição do diagnóstico diferencial.
DOMINGUES (2006) recomenda que nas poliparasitoses, o Ascaris lumbricoides
deverá ser o primeiro a ser tratado, devido à possibilidade da migração do verme com o
uso de drogas não eficazes. A droga de escolha deverá ter uma boa ação ascaricida.
Outra preocupação na associação de parasitoses é o início do tratamento pela espécie
mais patogênica.
Ainda de acordo com este mesmo autor, no Brasil a associação mais comum é
a de Ascaris lumbricoides, ancilostomídeos e Trichuris trichiura. Devendo-se buscar um
medicamento eficaz, por via oral, com poucos efeitos colaterais, com doses pequenas e
de baixo custo, lembrando que todo medicamento deve ser prescrito por um médico.
FIGURA 16 – S.mansoni (macho e fêmea)
Fonte: http://www.portalsaofrancisco.com.br/imagem.php
REFERÊNCIA BIBLIOGRÁFICA
ANVISA.
Principais
Síndromes
Infecciosas.
Disponível
http://www.anvisa.gov.br/servicosaude/microbiologia/mod_1_2004.pdf.
Acesso
08/09/2009.
em:
em
BOA
SAÚDE.
Amebíase.
Disponível
http://boasaude.uol.com.br/realce/emailorprint.cfm?id=14519&type=lib.
Acesso
08/09/2009.
em:
em
BRASIL, P.; LIMA, D.B.; MOURA, H.; Microsporidiose humana na síndrome de
imunodeficiência Adquirida. Rev Ass Med Brasil, v.43, p.254-264, 1997.
BRASIL Ministério da Saúde, Doenças infecciosas e parasitárias. Guia de Bolso, 4ª
ed., 2004 (LEITURA ANEXA).
BUSS, P.M.; Promoção da saúde e qualidade de Vida, Ciência & Saúde Coletiva, v.5,
p.163-177, 2000 (LEITURA ANEXA).
CÁCERES, A .P. S. G.; GONÇALVES, F.A .; CAZORLA, I.M.; CARVALHO, S.M.S.;
Contaminação do Solo por Helmintos de Importância Médica na Praia do Sul
(Milionários), Ilhéus – Ba. NewsLab, edição 67, p.146,154, 2004
CAMPOS, M.R.; VALENCIA, L.I.O.; FORTES,D.B.P.M.; BRAGA, R.C.C.; MEDRONHO,
R.A.; Distribuição espacial da infecção por Ascaris Lumbricoides. Revista de Saúde
Pública,v.36, p.69-74, 2002.
CAMPOS, S.;
Infecto-contagiosas/Epidemias - Strongiloidíase. Disponível em:
http://www.drashirleydecampos.com.br/noticias. Acesso em 17/09/2009.
CHIEFFI, P.P. & AMATO NETO, V.; Vermes, verminoses e a Saúde pública.
Disponível em: http://cienciaecultura.bvs.br/pdf/cic/v55n1/14854.pdf. Acesso em
21/09/2009 (LEITURA ANEXA).
CRUZ, A . L. S.; Parasitoses intestinais em crianças de idade escolar Giárdia
lambria; ciclo de vida e sensibilidade a antiparasitários. Dissertação de candidatura
ao Grau de Doutor em Ciências Biomédicas, submetida ao Instituto de Ciências
Biomédicas de Abel Salazar. 2003.
CVE – Centro de Vigilância epidemiológica de São Paulo. Manual das doenças
transmitidas
por
alimentos.
Disponível
em:
http://www.cve.saude.sp.gov.br/htm/hidrica/inf_cyclospora.htm. Acesso em 14/09/2009.
DOMINGUES,
S.H.S.;
Parasitoses
intestinais.
Disponível
em:
http://www.rksoul.net/edv64/Documents/Medicina/Specialty/Infectologia/Infec.MA.Parasi
toses.Intestinais.pdf. Acesso em 04/09/2009.
EMMEL, V.E.; INAMINE, E.; SECCHI, C.; BRODT, T.C.Z.; AMARO, M.C.O.;
CANTARELLI, V.V.; SPALDING, S.; Diphyllobothrium latum: relato de caso no Brasil.
Revista da Sociedade Brasileira de Medicina Tropical, v.39, p.82-84, jan/fev, 2006.
FERRARI, M.G.; RODRIGUEZ, R.; Prevalência de helmintíases em apêndices cecais.
Revista do Colégio Brasileiro de Cirurgia, v. 31, n.2, p. 77-82, Mar./ Abr. 2004.
FRENKEL, J.K.; SILVA, M.B.O.; SALDANHA, J.C.; VERGARA, M.L.S.; CORREIA, D.;
BARATA, C.H.; SILVA, E.L.; RAMIREZ, L.E.; PRATA, A.; Presença extra-intestinal de
cistos unizóicos de Isospora belli em paciente com SIDA. Relato de caso. Revista da
Sociedade Brasileira de Medicina Tropical, v.36, p.409-412, mai/jun, 2003.
GASTALDI,
L.A.;
Parasitoses
Entéricas.
Disponível
em:
http://www.saude.sc.gov.br/hijg/gastro/Enteroparasitoses.pdf. Acesso em 17/09/2009.
HACHICH, E.M.; GALVANI, A.T.; PADULA, J.A.; MENEGON, N.; SATO, M.I.Z.;
Importância do controle dos parasitas patogênicos Giardia e Cryptosporidium em
águas captadas para consumo humano. XXVII Congresso Interamericano de
Engenharia Sanitária e Ambiental. Disponível em:
http://www.bvsde.paho.org/bvsaidis/tratagua/ii-042.pdf. Acesso em 08/09/2009
LOPES, C.W.G.;
O gênero Sarcocystis (LANKESTER, 1882) (APICOMPLEXA:
SARCOCYSTIDAE), uma questão a ser reavaliada no Brasil. XIII Congresso
Brasileiro de Parasitologia Veterinária & I Simpósio Latino-Americano de Ricketisioses,
Ouro Preto, MG, 2004. Revista Brasileira de Parasitologia Veterinária, v.13, suplemento
1, 2004.
MACEDO, M.F.M.; ANDRADE, S.M.S.; MARTINS, C.S.; FRANCO, A .R.; MACEDO, P.;
LIMA, L.B.; BELÉM, A. C.; Helmintíases em pré-escolares de uma escola pública no
município de Manaus, Amazonas, Brasil. Boletim da Saúde, Porto Alegre, v. 22, n.1,
Jan./Jun. 2008.
MARCONDES, C.B.; Blastocystis hominis: o enigma continua. Revista da Sociedade
Brasileira de Medicina Tropical, v. 31,p. 491-493, set/out, 1998.
MELO, M.C.B.; KLEM, V.G.Q.; MOTA, J.A.C.; PENNA, F.J.; Parasitoses intestinais.
Revista da Associação Médica de Minas Gerais, suplemento 1, n.14, p.3-12, 2004.
PEDROSO, R.S. & SIQUEIRA, R.V.;Pesquisa de cistos de protozoários, larvas e ovos
de helmintos em chupetas. Jornal de Pediatria, v.73, n.1, 1997.
REIS, P.R.M.; DINIZ FILHO, J.A.F.; PENNA, K.G.B.D.; COSTA, S.H. N.; MESQUISTA,
M.M.; SILVA, J.B.; CASTRO, F.S.; CHEN, L.C.; Correlação entre eosinofilia e
protoparasitose por Giardia lamblia em crianças. RBAC, v. 39, p. 237-239, 2007.
SILVA, H.C.;CASTAGNOLLI, K.C.; SILVEIRA, D.M.; COSTA, G.H.N.; GOMES, R.A .;
NASCIMENTO, A. A. ; Fauna helmíntica de cães e gatos provenientes de alguns
municípios do Estado de São Paulo. Semina: Ci. Agrárias, Londrina, v. 22, n.1, p. 6771, jan./jun. 2001.
SILVA, M.C.; CORTEZ, A .A . AQUINO-CORTEZ, A .; VALENTE, M. TONIOLLI, R.
;Cisticercose suína, teníase e neurocisticercose humana no município de Barbalha,
Ceará. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v.59, n.2, p.371375, 2007.
STORER TI & USINGER RL. Zoologia geral. São Paulo, Editora Nacional; 1989.
TAVARES, A.D.; FRAZÃO, D.M.; BRITO, H.D.M.S.; CAVALCANTI, M.O.; COLARES,
M.C.R.; PEREIRA, T.G.R.; Prevalência de parasitoses em uma escola pública
freqüentada por crianças de baixo nível sócio-econômico. Disponível em:
http://www.prac.ufpb.br/anais/Icbeu_anais/anais/saude/parasitose.pdf.
Acesso
em
04/09/2009.
TAVIRA, L. T.; Diagnóstico laboratorial das parasitoses. Disponível em
http://www.fcm.unl.pt/departamentos/microbiologia/ficheiros%20de%20Aulas%20Teoric
as/Apresentacoes/Diagn%20laboratorial%20das%20parasitoses%202004%20b&w.pdf.
Acesso em 22/09/2009.
WERLE, C.H.; Prevalência de Giárdia Lambria na cidade de Buritama estado de
São Paulo. Disponível em: http://www.ciencianews.com.br/revistavirtual. Acesso em
07/09/2009.