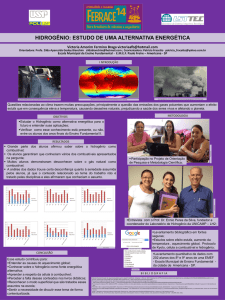
UNIVERSIDADE DE SÃO PAULO
ESCOLA DE ENGENHARIA DE LORENA
FERNANDO HENRIQUE G. DA SILVA
Obtenção e uso de hidrogênio em célula de combustível para
geração de energia limpa de fontes renováveis.
LORENA
2013
FERNANDO HENRIQUE G. DA SILVA
Obtenção e uso de hidrogênio em célula de combustível para
geração de energia limpa de fontes renováveis.
Trabalho de conclusão de curso em
graduação em Engenharia Industrial
Química apresentado na Escola de
Engenharia
de
Lorena
–
Universidade de São Paulo, sob a
supervisão do Departamento de
Engenharia Química e orientação do
Professor Mestre Antônio Carlos da
Silva.
LORENA
2013
DEDICATÓRIA
Dedico a todos que me apoiaram e tiveram paciência comigo em todos
esses anos de curso.
AGRADECIMENTOS
Primeiramente aos meus pais, Fernando Jorge e Elisabete Sartore, que
sempre foram minha fonte de segurança e tranquilidade, me apoiando nas horas
mais difíceis e acreditando em mim durante todos esse anos de curso. Não há
como medir toda minha gratidão que tenho por eles.
Minha filha que me inspira a buscar sempre o melhor de mim para que um
dia eu seja seu super-herói.
Meu orientador Antônio Carlos por me dar o suporte necessário para que
este trabalho tenha sido realizado.
Aos professores e mestres que conheci na faculdade, que passaram seus
conhecimentos, mesmo que não tenha sido completamente absorvido por mim,
mas que me colocaram nos caminhos dos estudos fazendo sempre que eu saiba
onde buscar o conhecimento.
À todos os amigos que passaram por mim desde o inicio da faculdade, que
me proporcionaram ótimos momentos de diversão e descontração, além daquelas
ajuda necessária nos estudos, antes das provas, sem eles a faculdade não seria
completa.
À Victória Figueiredo que se mostrou muito mais que uma amiga nos
últimos anos, acreditando no meu potencial e me dando conforto nas horas
difíceis.
À todos mencionados aqui, meu muito obrigado. Foram e são de extrema
importância para minha vida.
“Demore o tempo que for para ver o que você quer da vida e depois que decidir,
não recue ante nenhum pretexto, porque o mundo tentará te dissuadir”
Profeta Zaratustra nas palavras do Professor Clóvis de Barros
RESUMO
SILVA, Fernando H. G. Obtenção e uso de hidrogênio em célula de
combustível para geração de energia limpa de fontes renováveis. 2013. Tese
de Graduação. Escola de Engenharia de Lorena, Universidade de São Paulo,
2013.
O hidrogênio pode ser usado em células de combustível como fonte de energia
podendo ser usado no setor industrial, residencial e de transportes. Neste
trabalho é apresentado como o hidrogênio pode ser obtido, armazenado,
distribuído e utilizado em células de combustível. A célula de combustível também
é estudada, mostrando os tipos existentes, onde são usados nos dias de hoje,
qual o tipo de célula de combustível é mais adequado para cada situação de uso
mostrando, assim, uma tecnologia já estudada há muitos anos, mas ainda
necessitando de mais pesquisas e investimentos para que seu uso em massa
com custos reduzidos, seja aplicada amplamente em um futuro próximo.
Palavras-chave: Hidrogênio. Célula de combustível.
ABSTRACT
SILVA, Fernando H. G. Obtaining and the use of hydrogen into fuel cell to
clean power generation from renewable sources. 2013. Tese de Graduação.
Escola de Engenharia de Lorena, Universidade de São Paulo, 2013
Hydrogen can be used in fuel cells as an energy source in industrial, residential
and transport sector. In this work will be presented as hydrogen can be obtained,
stored, distributed and used in fuel cells. The fuel cell will also be studied, showing
the existing types, which are used these days, what type of fuel cell is most
appropriate for each situation of use. This technology has been studied for many
years, but still requiring more research and investment to that massive use with
little cost, is widely applied in the near future.
Keywords: Hydrogen. Fuel cell.
LISTA DE FIGURAS
Figura 1 - Fontes, processos de produção e tecnologias de conversão e utilização
do hidrogênio para fins energéticos...................................................... 19
Figura 2 - Protótipo do reformador de etanol, para célula a combustível do tipo
PEMFC 500W. ..................................................................................... 22
Figura 3 - Protótipo do reformador de etanol, para célula a combustível do tipo
PEMFC 5000W. ................................................................................... 23
Figura 4 - Unidade estacionária MCFC de 300 kW da Full Cell Energy .............. 35
Figura 5 - Unidade estacionária SOFC de 220 kW da Siemens.......................... 35
Figura 6 - Sistema de back-up da empresa Plug Power...................................... 36
Figura 7 - Modelo FCX Clarity, movido com célula de combustível, fabricado pela
montadora Honda. ............................................................................... 38
Figura 8 - Célula de combustível utilizado pela montadora Honda...................... 38
Figura 9 - Motor do modelo FCX Clarity da montadora Honda............................ 39
Figura 10 - Funcionamento de uma célula de combustível tipo PEMFC.............. 42
LISTA DE TABELAS
Tabela 1 - Poder calorífico de diferentes combustíveis. ...................................... 18
Tabela 2 - Quantidade de protótipos desenvolvidos por montadoras
automobilísticas. ................................................................................ 37
LISTA DE SIGLAS
PEMFC
Proton Exchange Membrane Fuel Cell
SOFC
Solid Oxid Fuel Cell
H2
Gás hidrogênio
O2
Gás oxigênio
H2O
Água
TiO2
Dióxido de titânio
CO
Monóxido de carbono
CO2
Dióxido de carbono
C2H5OH
Etanol
CH4
Metano
Unicamp
Universidade de Campinas
CENEH
Centro Nacional de Referência em Energia do Hidrogênio
NASA
National Aeronautics and Space Administration
ºC
Grau Celsius
K
Kelvin
ΔH
Variação de entalpia
kJ/mol
Quilojoules por quantidade de matéria
UV
Ultra-violeta
SUMÁRIO
1- INTRODUÇÃO .................................................................................................. 13
2- JUSTIFICATIVA ................................................................................................ 15
3- OBJETIVO ........................................................................................................ 16
3.1 - Objetivo geral ................................................................................................ 16
3.2 - Objetivo específico ........................................................................................ 16
4- REVISÃO BIBLIOGRÁFICA.............................................................................. 17
4.1- O Hidrogênio .................................................................................................. 17
4.2- Produção de Hidrogênio e Suas Tecnologias ................................................ 18
4.2.1- Eletrólise da Água ....................................................................................... 20
4.2.2- Processo de Reforma ................................................................................. 21
4.2.3- Reformador de Etanol ................................................................................. 22
4.2.4- Reformador de Gás Natural ou Outros Hidrocarbonetos ............................ 23
4.2.5- Fotobiológico............................................................................................... 24
4.2.6- Gaseificação de Biomassa e Pirólises ........................................................ 24
4.2.7- Outros Meios de Produção ......................................................................... 25
4.3- Distribuição de Hidrogênio ............................................................................. 25
4.4- Armazenamento de Hidrogênio ..................................................................... 27
4.4.1- Hidrogênio Líquido ...................................................................................... 29
4.4.2- Hidrogênio Comprimido .............................................................................. 30
4.4.3- Hidretos Metálicos em Baixa e Alta Temperatura ....................................... 30
4.4.4- Hidretos Alcalinos ....................................................................................... 31
4.4.5- Microesferas ............................................................................................... 32
4.4.6- Nanotubos de Carbono ............................................................................... 32
4.4.7- Metanol ....................................................................................................... 33
4.4.8- Gasolina e Outros Combustíveis Fósseis ................................................... 33
4.5- Aplicações do Hidrogênio .............................................................................. 33
4.5.1- Aplicações Estacionárias ............................................................................ 34
4.5.2- Aplicações Automobilísticas........................................................................ 36
5- METODOLOGIA ............................................................................................... 40
6- RESULTADOS E DISCUSSÃO ........................................................................ 41
6.1- A Célula de Combustível ............................................................................... 41
6.2- Tipos de Células de Combustível .................................................................. 43
6.2.1- Célula de Combustível Alcalina (AFC) ........................................................ 43
6.2.2- Célula de Combustível do Tipo Ácido Fosfórico (PAFC) ............................ 43
6.2.3- Célula de Combustível do Tipo Carbonato Fundido (MCFC) ...................... 43
6.2.4- Célula de Combustível do Tipo Óxido Sólido (SOFC) ................................ 44
6.2.5- Célula de Combustível do Tipo Membrana de Troca de Prótons (PEMFC) 44
6.2.6- Célula de Combustível do Tipo Metanol Direto (DMFC) ............................. 45
6.3- Discussão ...................................................................................................... 45
7- CONCLUSÃO ................................................................................................... 46
REFERÊNCIAS..................................................................................................... 47
13
1- INTRODUÇÃO
O hidrogênio há muito tempo é considerado um ótimo substituto para o uso
de combustíveis fósseis como a gasolina, diesel, querosene, gás natural e carvão
mineral. Seu uso em células de combustível pode ser a alternativa para gerar
energia que é usada em residência, industrias, automóveis, aviões etc. É um
combustível menos poluente, mais eficiente, prático e com algumas facilidades de
produção e distribuição (KENSKI, 2003).
A descoberta da célula de combustível se deu em 1801 por Humphrey
Davy, porém, o primeiro a realizar estudos, experiências e construções relevantes
foi William Grove (1811-1896), utilizando eletrodos de zinco e platina imersos em
sulfato de zinco e ácido nítrico respectivamente, que foi denominada "Célula de
Grove" (NETO, 2013).
A decomposição da água nos gases hidrogênio e oxigênio por meio da
eletricidade foi descrito em 1800 pelos ingleses William Nicholson e Anthony
Carlisle. Com esse processo, William Grove descobriu como combinar os gases
para gerar eletricidade e água em 1839, 40 anos antes do motor a combustão
(KENSKI, 2003).
Células de combustível já são bastante utilizadas hoje em dia e podem ser
adquiridas, infelizmente não a um preço muito acessível. Como exemplo de
utilização temos a Agência Nacional Aeroespacial Americana (NASA), para o
fornecimento de energia e água em suas missões tripuladas, a cervejaria
japonesa Asahi Brewery que construiu uma estação de geração estacionária de
energia para fornecer eletricidade em sua planta industrial, o Primeiro Banco
Nacional de Omaha, nos Estados Unidos, que fez a instalação do sistema para
evitar blecautes de energia o que significaria perda de dados e lucros, além de
diversos protótipos de veículos produzidos por montadoras como General Motors,
Ford, Toyota e Daimler-Chrysler. Em todos estes exemplos, a grande vantagem é
a não emissão de gases poluentes como o dióxido de carbono que contribui para
o aquecimento global com o efeito estufa (NETO, 2013).
A eficiência das células de combustível torna esse tipo de muito atraente
também. Enquanto um motor a combustão pode chegar, no máximo, a 25% de
conversão do combustível em energia, enquanto em carros movidos com o uso
de célula de combustível, a eficiência alcança 35% com facilidade, podendo
14
chegar até 60%. Em sistemas estacionários, esse número chega a 92%, já que o
calor gerado também pode ser usado para converter em energia (NETO, 2013).
O hidrogênio é o grande combustível para as células, podendo ser obtido
de diversas fontes. Aqui abordaremos pela hidrólise da água e pelo processo de
reforma do etanol produzido a partir da cana-de-açúcar, abundante aqui no Brasil
(KENSKI, 2003).
Uma das grandes problemáticas do hidrogênio é o seu transporte e
armazenamento. Em seu estado gasoso ocupa muito espaço, com perigo de
vazamentos e explosão, já no estado líquido é necessário muita energia, pois é
preciso alta pressão e temperatura de -253ºC. Porém, novas técnicas tem sido
pesquisadas, como na forma de hidretos e por nano fibra de grafite pode guardar
65% de sua massa em hidrogênio, em desenvolvimento desde 1997 pela
Northeastern University, nos Estados Unidos (NETO, 2013).
15
2- JUSTIFICATIVA
Com o aumento do uso de combustíveis fósseis e as questões ambientais
sendo cada vez mais importantes para o futuro do planeta, a procura de
alternativas para a geração de energia de forma limpa e sustentável se mostra
importante, tanto para a natureza como para a economia mundial. O hidrogênio
usado em célula de combustível se mostra como uma boa alternativa para os
combustíveis fósseis, para tanto estudos sobre o tema devem ser realizados para
que seja possível sua aplicação de modo viável.
16
3- OBJETIVO
3.1 - Objetivo geral
•
Apresentar as tecnologias atuais para utilização de hidrogênio para
a geração de energia limpa.
3.2 - Objetivo específico
•
Estudar os processos de obtenção de hidrogênio.
•
Estudar as diferentes tecnologias de célula de combustível.
•
Estudar as aplicações do hidrogênio em célula de combustível para
a geração de energia.
•
Apresentar as tecnologias presentes hoje e o que pode ser feito
para o futuro, com o aumento de pesquisas e investimentos para o
desenvolvimento e aperfeiçoamento visando sua utilização em
sistemas de maior sustentabilidade.
•
Avaliar as vantagens de cada método, apresentando os setores
onde podem ser utilizados.
17
4- REVISÃO BIBLIOGRÁFICA
4.1- O Hidrogênio
Assim como compostos carbônicos, o hidrogênio pode se utilizado como
combustível. O eletroquímico John Bockris enunciou pela primeira vez, em 1970,
que o hidrogênio seria o combustível do futuro e que a economia mundial seria
baseada no hidrogênio. Júlio Verne, em seu romance "A Ilha Misteriosa" de 1874
menciona também o hidrogênio como combustível do futuro (HINRICHS, 2010).
A justificativa para tais afirmações e previsões é de que o hidrogênio, ao
combinar-se com oxigênio formando água, libera uma quantidade significativa de
energia, como podemos acompanhar pela tabela 1. Aplicações onde sua leveza é
fator importante para seu uso como combustível, fez com que nas missões
Saturno com o objetivo de alcançar a Lua e nos ônibus espaciais, denominados
Space Shuttles, o hidrogênio fosse usado para a ignição e propulsão dos foguetes
(HINRICHS, 2010).
O hidrogênio pode gerar energia elétrica através de células de combustível.
Estas células de combustível são alimentadas continuamente por hidrogênio, que
entra em contato com eletrodos, onde se decompõe em próton e elétron. Estes
elétrons seguem para um circuito externo, formando uma corrente elétrica e,
assim, fornecendo energia para equipamentos. Em 1996, a empresa MercedesBenz apresentou seu protótipo de veículo movido por célula de combustível,
seguida de outras montadoras que seguem a pesquisa e desenvolvimento de
carros com essa tecnologia. Em Vancouver, no Canadá, e em Chicago, nos
Estados Unidos, ônibus utilizando células de combustível desenvolvidas pela
empresa canadense Ballard Power Systems, circulam pela cidade (BAIRD, 2011).
Ao reagir com o oxigênio formando água, todo combustível libera uma
quantidade determinada de energia, que pode ser medida pela diferença entre o
poder calorífico superior e poder calorífico inferior, denominado calor de
vaporização. Esta diferença representa a quantidade de energia necessária para
converter combustível líquido em gasoso, bem como para sua conversão água
em vapor (BAIRD, 2011).
18
Tabela 1 - Poder calorífico de diferentes combustíveis.
Combustível
Poder Calorífico Superior
Poder Calorífico Inferior
(25⁰C e 1 atm)
(25⁰C e 1 atm)
Hidrogênio
141,86 kJ/g
119,93 kJ/g
Metano
55,53 kJ/g
50,02 kJ/g
Propano
50,36 kJ/g
45,6 kJ/g
Gasolina
47,5 kJ/g
44,5 kJ/g
Gasóleo
44,8 kJ/g
42,5 kJ/g
Metanol
19,96 kJ/g
18,05 kJ/g
Fonte: SANTOS 2008
Em comparação com os demais combustíveis, o hidrogênio apresenta o
maior valor energético, pois é o mais leve e não possuir átomo pesados de
carbono. Este é o fator principal para que o hidrogênio seja muito usado nas
missões espaciais. A energia liberada na combustão do hidrogênio é cerca de 2,5
vezes maior em comparação aos demais combustíveis, fazendo com que a
massa necessária para uma mesma quantidade de energia seja apenas 1/3 da
massa de hidrocarbonetos (SANTOS, 2013).
Em células de combustível, o hidrogênio é o combustível ideal a ser
utilizado, apesar da pouca infraestrutura atual para sua produção de fontes
primárias. A escolha do processamento do combustível, estacionário ou a bordo,
e o tipo de combustível primário depende da disponibilidade no combustível, sua
aplicação e do tipo de célula de combustível a ser utilizada. Outro fator para a
preferência do uso em células de combustível é sua alta reatividade eletroquímica
no ânodo e sua oxidação produzir água, o que faz ser ambientalmente correta
(SANTOS, 2013).
4.2- Produção de Hidrogênio e Suas Tecnologias
O hidrogênio é o elemento mais leve e mais simples da tabela periódica,
sendo também o mais abundante do universo. Em 1784, Henry Cavendish
demonstrou que reagindo ácido clorídrico ou ácido sulfúrico com zinco ou ferro
produz gás hidrogênio que, com uma centelha elétrica, explode produzindo água.
19
Anos depois, Antoine Lavoisier explicou os resultados de Cavendish, fazendo a
denominação deste gás de "hidrogênio", nome de origem grega que significa
"formador de água", derrubando a ideia estabelecida há anos que água era
formada apenas por um elemento (SANTOS 2013).
O hidrogênio não é encontrado livre na natureza, estando sempre ligado a
outros elementos. Tendo isto, o hidrogênio não pode ser considerado como fonte
primária de energia, mas sim como uma fonte intermediário, já que é necessário o
emprego de energia em uma fonte primária para sua obtenção, ou seja, ele é
apenas um vetor energético (SANTOS 2013).
O melhor método para sua produção vai depender da pureza e quantidade
desejada. Fontes de energia como eletricidade, calor e luz devem ser
empregadas nas tecnologias existentes para que se inicie o processo de
produção (SANTOS 2013).
A figura 1 esquematiza quais são as fontes primárias, os processos e onde
pode se utilizar o hidrogênio obtido.
Figura 1 - Fontes, processos de produção e tecnologias de conversão e utilização
do hidrogênio para fins energéticos. Fonte: CENEH (2009)
20
4.2.1- Eletrólise da Água
Método que utiliza energia elétrica para separa os elementos que formam a
água, oxigênio e hidrogênio, alcançando 95% de rendimento segunda a reação:
2 H2O + eletricidade → 2 H2 + O2
(1)
Inventado nos final dos anos 80 e patenteado em 1999, o eletrolisador com
membrana de troca de prótons é um método de obtenção de hidrogênio não
agressivo ao meio ambiente. Alternativas para obtenção de eletricidade para se
usar neste processo são muito, como a energia eólica, solar, a energia não
utilizada produzida por usinas hidrelétricas e nucleares (BAIRD, 2011).
Protótipos de usinas na Alemanha e Arábia Saudita, que utilização
eletricidade a partir da energia solar são capazes de produzir hidrogênio com uma
eficiência de 7%. Em plantas eólicas, hidrelétricas e nucleares, pelas
impossibilidade de estocar energia elétrica produzida e não consumida
imediatamente, esta energia pode ser desviada para produzir hidrogênio a partir
da eletrólise da água (BAIRD, 2011).
Segundo BAIRD, 2011, a melhor maneira possível de eletrolisar a água
seria a absorção direta da luz solar pela água, porém não há métodos eficientes e
práticos para realizar tal decomposição, já que a água por si só não absorve luz
na região do UV ou do visível. Com o auxilio de algumas substâncias adicionadas
à água, a decomposição pode ocorrer, infelizmente as substâncias encontradas
nos tempos atuais não mostraram eficiência e não são recuperáveis ao final do
processo, tornando assim um hidrogênio de fonte não renovável. Um exemplo de
substância capaz de converter a energia solar em gás hidrogênio pela eletrólise
da água é o dióxido de titânio, TiO2, que é estável a luz solar, barato mas, puro,
absorve apenas a radiação UV. A mistura de TiO2 com carbono, a eficiência pode
passar de 8% da energia do sol pois o carbono passar a absorver a radiação na
região da luz visível. Sua grande vantagem é de produzir hidrogênio com alto grau
de pureza, no entanto, é necessário grande quantidade de energia para seu
funcionamento.
21
4.2.2- Processo de Reforma
Processo de produção de hidrogênio que utiliza combustíveis com pontos
de ebulição abaixo de 250⁰C e pesos entre o metano e nafta. Consiste na
conversão termoquímica, podendo ser catalisada ou não de hidrocarbonetos
gasosos, líquidos ou sólidos (LOPES, 2009).
A reforma de etanol pode ser definida como a conversão termoquímica, catalisada
ou não, do etanol gerando um gás de síntese rico em hidrogênio, podendo ser,
segundo LOPES, 2009, feita de 3 formas:
[...] 1) Reforma-vapor: o combustível pré-condicionado é injetado
com vapor superaquecido num leito de reação. Salienta-se que o
pré-condicionamento do combustível é determinado pelo seu
aquecimento, e no caso dos combustíveis aditivados por
odorificantes, em geral a base de compostos de enxofre, sua prépurificação. É uma reação endotérmica lenta, cujo calor
necessário provém em geral da queima de parte do próprio
combustível utilizado no processo de reforma em leito distinto,
colocados em contato térmico. Resultam geralmente em sistemas
com maior volume devido às trocas térmicas necessárias e são
aplicados para hidrocarbonetos leves e de peso molecular
intermediário.
2) Oxidação parcial: compreende uma oxidação parcial, ou
incompleta, do combustível. Uma quantidade sub-estequiométrica
de oxidante, ar ou oxigênio, é utilizada. Esta reação de oxidação é
exotérmica e conduz os insumos e o leito de processo a altas
temperaturas, responsável pela reforma e decomposição térmica
da fração não oxidada do combustível. Para algumas aplicações,
pode-se utilizar catalisadores. Processos não catalíticos para
reforma de gasolina, por exemplo, necessitam temperaturas de
aproximadamente 1.300 K (1.027 °C). Esse tipo de reação possui
vantagens, como o uso de um reformador mais compacto e leve.
3) Reforma autotérmica: é a combinação dos processos
anteriores em um único leito. A reforma-vapor absorve parte do
calor e a água gerada pela reação de oxidação parcial, resultando
em um processo levemente exotérmico, cuja característica está
apenas atrelada à compensação das perdas térmicas de um
sistema real.
O reformador é geralmente compacto, de partida mais
rápida e mais eficiente quanto ao aproveitamento do calor, além
de operar em temperaturas mais baixas, o que possibilita a
utilização de materiais e ligas metálicas mais baratas, sendo
necessário a utilização de isolamentos térmicos adequados. Este
conceito de reforma vem sendo admitido para implementação de
sistemas compactos e de menor custo, que podem viabilizar mais
rapidamente a disseminação da tecnologia do hidrogênio.
22
4.2.3- Reformador de Etanol
A produção de hidrogênio a partir do etanol segue as seguintes reações:
C2H5OH + H2O → 4 H2 + CO
(2)
CO + H2O → H2 + CO2
(3)
Neste processo, realizada por equipamentos mostrados nas figuras 2 e 3, o
etanol reage com vapor de água em alta temperatura gerando hidrogênio e
monóxido de carbono. Este monóxido pode reagir com mais vapor de água
também em alta temperatura em uma reação de simples-troca, denominada shift,
fazendo com que aumente ainda mais o rendimento do processo (LOPES, 2009).
No Brasil, sendo grande produtor de etanol a partir da cana-de-açúcar,
investimentos na pesquisa e desenvolvimento desta tecnologia podem ser bem
atrativos, fazendo com que o país tenha um diferencial de referência mundial. O
grande desafio deste processo é avaliar e determinar quais catalisadores podem
apresentar o maior taxa de conversão para produção de hidrogênio, o mais
favorável para o deslocamento de equilíbrio (LOPES, 2009).
Figura 2 - Protótipo do reformador de etanol, para célula a combustível do tipo
PEMFC 500W. Fonte: LOPES (2009).
23
Figura 3 - Protótipo do reformador de etanol, para célula a combustível do tipo
PEMFC 5000W. Fonte: LOPES (2009).
4.2.4- Reformador de Gás Natural ou Outros Hidrocarbonetos
LOPES, 2009 estudou este método que consiste em produzir hidrogênio,
monóxido de carbono e dióxido de carbono a partir de gás natural (metano) ou
outros hidrocarbonetos expondo-os em altas temperaturas. Esta tecnologia é
muito utilizada em escala industrial, seguindo a reação:
CH4(g) + H2O(g) → CO(g) + 3 H2(g)
(4)
Para maior rendimento, o monóxido de carbono reage com vapor de água,
produzindo dióxido de carbono e hidrogênio, do mesmo modo como é feito com o
etanol, segundo a reação:
24
CO(g) + H2O(g) → CO2(g) + H2(g)
(5)
O rendimento global do processo é entre 70 e 90%, sendo o método mais
econômico de se obter gás hidrogênio, porém, apresenta desvantagens. As
principais são a emissão de gás carbônico no ambiente, utilizar apenas
combustíveis fósseis que não são renováveis e que a unidade energética do
hidrogênio produzido acaba saindo mais cara em comparação a unidade
energética produzida da combustão das fontes primárias (LOPES, 2009).
4.2.5- Fotobiológico
Tecnologia que emprega micro-organismos fotossintetizantes que, em sua
atividade metabólica, são capazes de produzir hidrogênio. Com grau de
engenharia e catalisadores presentes hoje é possível atingir rendimentos de até
24%. Sua grande vantagem é produzir gás hidrogênio de modo limpo e barato, no
entanto, ainda é necessário estudos para aperfeiçoamento e melhoria no
rendimento do processo (LOPES, 2009).
4.2.6- Gaseificação de Biomassa e Pirólises
Investidores americanos descobriram, em 1996, duas enzimas resistentes
a calor, uma proveniente de profundas aberturas vulcânica do oceano Pacífico,
onde a partir da molécula glicose o gás hidrogênio é liberado, e outra de escórias
de carvão queimando sem chama. Ambas, sendo resistentes a calor, podem ser
usadas para a produção de hidrogênio, fazendo com que a reação de obtenção
ocorra em uma maior velocidade (LOPES, 2009).
A celulose, um polímero da glicose, pode ser a fonte de hidrogênio para
que estas enzimas. Tal celulose pode ser fornecida de pedaços e aparas de
madeira e papel usado (LOPES, 2009).
A biomassa (madeira, resíduos agrícolas, mato de limpeza de florestas,
resíduos de aglomerados, madeira etc.), podem sofrer processo de pirólise de
baixa temperatura resultando na produção de hidrogênio, catalisada por estas
25
enzimas resistentes a calor. Para combustíveis fósseis, esta tecnologia também
está disponível atualmente (LOPES, 2009).
4.2.7- Outros Meios de Produção
Em fevereiro de 2000, na reunião anual da Associação Americana para o
Avanço da Ciência, foi anunciada a descoberta de um tipo de alga que, em
condições altamente controladas, podem produzir gás hidrogênio, numa
proporção de 3cm3 de gás para cada litro de cultura da alga. O grupo de ciências
que apresentou a descoberta estuda modos de aumentar o rendimento, sendo
possível melhora-lo em até dez vezes (LOPES, 2009).
Pela reação, já mencionada, de metal pouco reativos como zinco e ferro
com ácidos clorídrico e sulfúrico ou, por metais mais reativos como sódio e cálcio
com água (LOPES, 2009).
Pelo processo de Haber, usado na indústria de produção de amônia,
também pode-se usar para gerar gás hidrogênio (LOPES, 2009).
4.3- Distribuição de Hidrogênio
O hidrogênio pode ser produzido no local onde é necessário, em pequenas
quantidades, ou em plantas especializadas, em grande escala. A produção em
grande quantidade é benéfica para o seu valor em escala e a localização
industrial pode ser nas proximidades de grandes oferta de água, necessário para
que seja possível sua produção. Processos a partir de biomassa e carvão só
podem ser empregados em larga escala (SANTOS, 2013).
Produção em pequena escala pode ser obtida com facilidade a partir
energia solar, energia elétrica, gás natural e outros meios. Problemas em relação
a transporte e energia são reduzidos. Devido a ausência de uma planta produtora
em larga escala e sim, de pequenas unidades produtoras, a quantidade de
equipamentos utilizados é significavelmente maior, fazendo com que os custos,
principalmente no que diz respeito a produção, seja maior comparado a produção
em grande quantidade. Para quantidade ainda menores de hidrogênio, como para
mover um carro munido com célula de combustível, combustíveis fósseis podem
26
ser processados a bordo, porem, este tipo de sistema possui custos elevados e
são complexos (SANTOS, 2013).
Produção, meios de transporte, estruturas, armazenamento, estações de
abastecimento, métodos de conversão do hidrogênio em energia são fatores que
influenciam nas infraestrutura de energia com base no hidrogênio.
Nos dias de hoje, cerca de 83% da produção de hidrogênio é feita no
próprio local de consumo, de modo descentralizado, minimizando ineficiências e
altos custos com transportes de energia. Os 17% restantes da produção são
transportados por garrafas, tanques e "pipelines" (SANTOS, 2013).
O sistema de "pipelines" usado no transporte do hidrogênio gasosos é
semelhante ao usado para o transporte de gás natural. Este sistema leva o gás
hidrogênio das plantas produtoras em larga estala até centros fortemente
industrializados onde será consumido, bem como sua circulação e distribuição no
interior das fábricas. Como exemplos, temos os Estados Unidos. Grupos
multinacionais como Air Liquide Group, Air Products Chemicals Inc. e Praxair Inc,
atuando nos estados de Louisiana, Indiana, Texas e Califórnia, possuem uma
rede de 752km com tubos de 12 polegadas (30,42cm) de diâmetro (SANTOS,
2013).
Fazendo uma comparação entre o gás hidrogênio e o gás natural,
mantendo as mesmas condições, em termos de volume, devido às diferenças
energéticas, um volume três vezes maior de gás hidrogênio deve ser bombeado
para que se consiga quantidades equivalente de energia (SANTOS, 2013).
Uma das problemáticas do uso de pipelines para o transporte de
hidrogênio é, devido a sua pequena molécula, pequenas aberturas como nas
juntas ou em soldas mal executadas, podem facilitar o vazamento do gás.
Reações químicas entre o metal dos tubos e o hidrogênio também pode ocorrer,
fazendo com que o metal se desgaste e facilite fugas do gás. Tubulações de
cimento, plástico, mistura de gás hidrogênio com outros gases e adições de
inibidores de reação são os métodos usados para reduzir este desgaste por
reação química (SANTOS, 2013).
O deslocamento do gás hidrogênio segue a lei dos gases e sua
estocagem, tanto tanque como nas pipelines, deve obedecer esta lei em relação a
temperatura, volume e pressão. Também pode ser distribuído em sua forma
gasosa por meio de tanques, com pressão variando entre 150 e 400atm, por meio
27
de caminhões, vagões e barcos. Para distâncias acima de 1600km, o hidrogênio é
transportado em sua forma líquida, evaporando-se conforme vai sendo usado
(SANTOS, 2013).
Em sua forma líquida, por meio reservatórios ou tanques resfriados e muito
bem isolados para evitar aquecimento e vazamentos, o transporte do gás
hidrogênio também pode ser feita através de trens, barcos e caminhões
(SANTOS, 2013).
4.4- Armazenamento de Hidrogênio
O aspecto primordial a ser levado em consideração no armazenamento de
hidrogênio, bem como qualquer outro combustível, é o fator da segurança.
Quando a energia necessária para o funcionamento de um veículo não é
armazenado em baterias, os tanques onde são estocados os combustíveis que
serão convertidos devem oferecer condições ideais de segurança e garantir o
bom abastecimento do sistema (BAIRD, 2011).
No caso especial do hidrogênio, estudos recentes da Agência Nacional
Norte-Americana de Padrões, compararam o uso de hidrogênio com outros
combustíveis vindos do petróleo, como gasolina e gasóleo, mostrando que o
hidrogênio possui valores igualmente ou melhores à outros combustíveis e, claro,
altamente inflamável e explosivo. Sua chama propaga-se verticalmente em vez de
se espalhar na horizontal. Isto acontece devido à sua baixa densidade (BAIRD,
2011).
Quanto ao armazenamento, deve-se levar em consideração o espaço
disponível. Nas cidades de Chicago, nos Estados Unidos e Vancouver, no
Canadá, os ônibus movidos com células de combustível, o gás hidrogênio é
estocado no teto do veiculo, na forma gasosa comprimida, alcançando 550km de
autonomia. Também na forma comprimida, é estocado em habitações que
utilizam célula de combustível. Ambos os casos apresentam grande espaço para
este tipo de estocagem (BAIRD, 2011).
Cada tipo de armazenamento requer condições especificas para casa
caso, como na forma líquida, necessitando de temperaturas abaixo de -253⁰C ou
na forma de hidretos, onde é preciso o aquecimento acima de 300⁰C para que
ocorra a liberação do hidrogênio (SANTOS, 2013).
28
O hidrogênio puro é o combustível ideal para o gerar energia em célula de
combustível, mas seu custo de obtenção ainda é elevado e seu manuseio e
transporte, mesmo que em estado líquido, exige normas rigorosas de segurança.
Sua estocagem em forma líquida requer muita energia, já que seu ponto de
ebulição é de apenas -253ºC na pressão de 1atm, além da necessidade de mais
energia para manter esta temperatura. Esse tipo de armazenamento só é usado
em situações onde sua baixa densidade compensa esse gasto de energia, como
nas missões espaciais (KENSKI, 2003).
Armazenado na forma de gás comprimido, do mesmo modo que é feito
com o gás natural,8 o gás hidrogênio apresenta a grande desvantagem da
quantidade a ser estocada para liberar a mesma energia em comparação ao gás
natural. Por consumir 75% menos oxigênio que o gás natural, consequentemente,
libera 75% menos energia.Para efeito ilustrativo, vamos comparar o uso de
hidrogênio em um automóvel movido a célula de hidrogênio, com eficiência de
50% em uma viagem de 400km, mesma distância de um automóvel movido a
gasolina com tanque entre 40 e 50 litros. Nestas condições, seriam necessários
4kg de gás hidrogênio, que ocupam:
•
45000 litros ou 45m3, equivalendo a um cubo de 3,6m de lado ou um balão
de 5m de diâmetro, se o gás estiver sob a pressão atmosférica normal;
•
225 litros, equivalente a 5 tranques de gasolina normal, sob forma
comprimida a 200atm;
•
56 litros em forma líquida mantido a -253ºC em pressão de 1atm;
•
35-75 litros na forma de hidretos metálicos, se um sistema eficiente fosse
desenvolvido (KENSKI, 2003).
A forma de hidreto metálico é a forma mais segura e prática de estocar
hidrogênio. Metais e ligas metálicas são capazes de absorver hidrogênio, como
uma esponja absorve água, e liberar com o aquecimento gradual do metal ou da
liga metálica. Este fenômeno é possível pois o hidrogênio não reage com o metal
formando moléculas, e sim, ficando no interior da rede cristalina que se expande
para incorporar os átomos de hidrogênio. O grande desafio das pesquisas atuais
é encontrar uma liga que seja leve o suficiente para ser utilizada em carros, por
exemplo. Os atuais metais e ligas usadas possuem uma densidade muito próxima
ao do hidrogênio líquido, como o híbrido de titânio e hidrogênio.
29
As característica principais da estocagem de hidrogênio na forma de
hidreto são:
•
a rapidez e reversibilidade de absorver hidrogênio;
•
após vários ciclos de uso, não se tornar frágil;
•
operar em temperatura de 0-100ºC e pressão de 0-10atm;
•
não seja tão densa;
•
ocupe pequenos volumes (ideal seria 4kg em 65 litros) (KENSKI, 2003).
4.4.1- Hidrogênio Líquido
Em seu estado líquido, o hidrogênio apresenta vantagens como uma maior
facilidade no transporte, por ser possível o fornecimento de quantidades maiores,
e uma capacidade de armazenamento superior por unidade de volume, porem,
fazer este gás em temperatura ambiente se liquefazer, na temperatura de -253⁰C,
é necessário uma grande quantidade de energia, tornando-se um processo caro e
que pode ocorrer perda de 40% da energia contida no hidrogênio, entretanto,
ainda é um modo atrativo de se estocar, pois necessita de pequenos espaços,
ideal para o uso em aviões e veículos, usando tanques menores. Novamente
fazendo uma comparação com a gasolina, um tanque de hidrogênio contendo a
mesma quantidade de energia de um tanque de gasolina, pode ser de 4 a 10
vezes menor (SANTOS, 2013).
Sua liquefação é lenta, fazendo com que, caso ocorra algum vazamento,
os riscos de inflamação e explosão sejam menores (SANTOS, 2013).
Os estudos na manipulação e uso do hidrogênio encontram-se avançados
nos dias de hoje, fazendo com que essa seja a forma mais usada para o uso nas
células de combustíveis usadas em automóveis (SANTOS, 2013).
30
4.4.2- Hidrogênio Comprimido
Usando tanques ou cilindros de diversos tamanhos e materiais,
normalmente alumínio ou carbono, este método de armazenamento utiliza
tecnologia semelhante ao de gás natural (SANTOS, 2013).
Ideal para o fornecimento em indústrias e estabelecimentos que
necessitam de pequenas quantidades de hidrogênio ou onde espaço não é um
fator limitante, sendo amplamente usado nas células de combustíveis de
automóveis, ônibus, estabelecimentos comerciais, industriais e residenciais, onde
o consumo de hidrogênio não é alto e é variável (SANTOS, 2013).
A pressão de armazenamento em tanques e cilindros varia de 200 a 250
atm para tanques de 50 litros e 500 a 600atm em locais onde é necessário o uso
em larga escala (SANTOS, 2013).
A grande vantagem do gás hidrogênio comprimido são as perdas
energéticas de apenas 5%, variando de acordo com a eficiência dos
compressores e da capacidade de fluxo (SANTOS, 2013).
4.4.3- Hidretos Metálicos em Baixa e Alta Temperatura
Metais puros ou com alta porcentagem de pureza combina-se, sob alta
pressão, com hidrogênio, seguindo a equação global:
M + H2 ↔ MH2
(6)
Quando o gás hidrogênio atinge a superfície do metal, sob alta pressão, os
átomos são separados e, devido ao seu tamanho diminuto de átomo, ocupam
espaços vazios na estrutura, entre os átomo do metal. Depois que o hidrogênio é
ligado ao metal, sua liberação ocorre com o fornecimento de calor, que pode ser
fornecido pela aquecimento da própria célula de combustível em uso (SANTOS,
2013).
Neste tipo de armazenamento, a densidade é maior em comparação ao
gás comprimido, mais seguro ao de gasolina, pois a pressão no tanque é ínfima
fazendo com que se evite vazamentos rápidos, alem do fator temperatura, que
diminui conforme o hidrogênio é liberado, fazendo com a reação seja interrompida
31
caso ocorra vazamentos. Sendo assim, este tipo de estocagem se mostra
eficiente quando usado um metal de boa absorção (SANTOS, 2013).
No entanto, este tipo de armazenagem apresenta alguns problemas. A
relação energia/peso é baixa, o tamanho dos tanques são 10 vezes maiores e 30
vezes mais pesados em comparação á um tanque de gasolina com a mesma
quantidade de energia. A variação de temperatura, o aquecer para a liberação do
hidrogênio e o resfriamento que ocorre a medida que acontece a reação, fazendo
com que haja desgaste dos metais e hidretos, diminuindo assim, sua vida útil. A
pureza do metal usada é outro fator importante, pois não deve apresentar
impurezas para que não ocorra reações paralelas, principalmente com relação a
produção de água, oxigênio e monóxido de carbono indesejáveis, que podem
reagir com o tanque e danifica-lo (SANTOS, 2013).
Por ser um sistema de baixa pressão, seu uso é indicado para aplicação
portáteis que utilizam célula de combustível (SANTOS, 2013).
4.4.4- Hidretos Alcalinos
Este método de armazenamento é uma variação do anterior, apresentando
algumas vantagens.
Componente de lítio, hidróxido de potássio e sódio são as substâncias
normalmente usadas para a conversão de hidretos. Estes reagem com água e
liberam hidrogênio, não sendo necessário o fornecimento de calor (SANTOS,
2013).
Nos dias de hoje, o processo mais utilizado e desenvolvido envolve
hidróxido de sódio, recolhido do refugo de outras indústrias como a de petróleo,
tecidos, plástico e papel (SANTOS, 2013).
Para a formação do hidreto, o oxigênio é removido do hidróxido de sódio
com o auxilio de calor seguindo a reação:
2 NaOH + calor → NaH + 2 O2
(7)
Com o hidreto solidificado, ele pode ser coberto, guardado e transportado
para onde será utilizado com facilidade. Em seguida, pode ser cortado no
32
tamanho deseja e mergulhado em água para que o hidrogênio seja liberado,
segundo a reação:
NaH(s) + H2O(l) → NaOH(l) + H2(g)
(8)
O hidróxido de sódio resultante desta última reação é recuperado e usado
novamente para gerar mais hidreto. O hidrogênio é liberado sob pressão e de
forma rápida (SANTOS, 2013).
Suas vantagens são semelhantes ao dos hidretos metálicos, sem
necessidades de temperaturas extremamente baixas ou altas pressões, em
adição, elimina a necessidade de altas temperaturas, o alto grau de pureza dos
reagentes e a facilidade de controle de reação por meio dos reagentes envolvidos
e, suas desvantagens, também são semelhantes aos hidretos metálicos como seu
alto peso, alem de elevada dureza, dificultando o corte das pedras de sódio
(SANTOS, 2013).
4.4.5- Microesferas
Sob alta pressão e alta temperatura, o hidrogênio passa pelas paredes de
pequenas esferas de vidro e fixado lá com o abaixamento da temperatura,
podendo ficar guardado em condições ambiente sem perdas de hidrogênio, que é
liberado posteriormente com o aquecimento das esferas. Esta tecnologia ainda se
encontra em desenvolvimento, com pesquisa para aumentar a taxa de liberação
de hidrogênio com a fragmentação das esferas (SANTOS, 2013).
4.4.6- Nanotubos de Carbono
Tecnologia anunciada em dezembro de 1996 por pesquisadores das
Universidade Nordeste de Boston. Consiste em pequeno tubos cristalinos que,
sob uma pressão 300% de sua massa, é capaz de armazenar hidrogênio.
Segundo a universidade, um volume igual de um tanque de combustível
convencional de uma veículo, os chamados "nanotubes" podem fornecer uma
autonomia de 8000km. Caso as pesquisas avancem, um dia pode ser possível
comprar pequenos cilindros de "nanotubes" carregados de hidrogênio no
33
supermercado e reabastecer seu veículo, ou mesmo usar estações de
reabastecimento (SANTOS, 2013).
4.4.7- Metanol
Combustível líquido rico em hidrogênio, tem sido estudado para que seja
usado em veículos alimentando células de combustível de forma direta com alta
eficiência, já que no processo de extração de hidrogênio do metanol se perde
muita energia e a eficiência é muito baixa (SANTOS, 2013).
Porem, este combustível apresenta diversos problemas. É facilmente
confundido com etanol, por terem aparência semelhante, é altamente corrosivo, o
que dificulta o transporte e extremamente venenoso, podendo causar danos
sérios ao meio ambiente e a saúde de pessoa e animais em caso de vazamentos.
Uma solução para se utilizar o metanol de forma segura pode sair muito cara
(SANTOS, 2013).
4.4.8- Gasolina e Outros Combustíveis Fósseis
A indústria do petróleo já investiu muito na pesquisa de se usar gasolina,
nafta e outros hidrocarbonetos como fonte de hidrogênio, retirando este elemento
da constituição dos combustíveis fósseis (SANTOS, 2013).
Assim como o metanol, problemas no processamento de hidrocarbonetos e
questões ambientais, tornam um meio pouco atrativo para a obtenção de
hidrogênio numa economia baseada neste gás, como o tempo de aquecimento de
um processador, que pode levar 30 minutos e a liberação de gases nocivos, como
CO e NOx (SANTOS, 2013).
4.5- Aplicações do Hidrogênio
O hidrogênio pode ser usado tanto em motores de combustão interna como
em células de combustível para a geração de energia. A tecnologia de motores de
combustão interna já é bem desenvolvida, porem, sua eficiência é baixa se
compararmos com a eficiência da célula de combustível (LOPES, 2009).
34
O uso de célula de combustível é ampla, podendo ser aplicado em
dispositivos portáteis que necessitam de baixas potências, da ordem de décimos
de watts, até grandes estação de distribuição de energia ou industriais
estacionarias, onde a potência alcança megawatts (LOPES, 2009).
4.5.1- Aplicações Estacionárias
A célula de combustível do tipo PEMFC é a mais adequada para aplicação
estacionaria, utilizando hidrogênio puro proveniente metanol, etanol ou gás
natural, podendo ser utilizado a rede de distribuição já existente em alguns locais
de gás natural (LOPES, 2009).
A confiabilidade do sistemas faz com que seja instalado em residências e
locais onde seja necessário o fornecimento continuo de energia elétrica, como
setores de telecomunicações e armazenamento de dados e informações,
entrando em operação quando o fornecimento de eletricidade tradicional é
interrompido. Estes sistemas, conhecidos como back-up, já são usados nos
Estados Unidos e aqui mesmo no Brasil, com pequenas instalações que fornecem
até 5kW de potência e são usados cilindros para o fornecer o hidrogênio
necessário (LOPES, 2009). Um exemplo deste sistema podemos ver na figura 6.
Quando a geração de calor também se faz necessário, célula de
combustível do tipo SOFC e MCFC são mais utilizadas, pois operam em
temperaturas entre 600 e 1000 ºC. Este calor gerado é usado para aumentar a
eficiência da célula de combustível, gerando ainda mais energia. Instalações que
utilizam este tipo de célula de combustível geram potência entre 200kW e 4MW
(LOPES, 2009). Os sistemas de células de combustível são mostrados na figura 4
e 5.
35
Figura 4 - Unidade estacionária MCFC de 300 kW da Full Cell Energy. Fonte:
LOPES (2009).
Figura 5 - Unidade estacionária SOFC de 220 kW da Siemens. Fonte: LOPES
(2009).
36
Figura 6 - Sistema de back-up da empresa Plug Power. Fonte: LOPES (2009).
4.5.2- Aplicações Automobilísticas
Desde 2004, diversas montadoras desenvolveram dezenas de protótipos
de carros e ônibus movidos com célula de combustível, principalmente do tipo
PEMFC por operar em baixa temperatura, como apresentado na tabela 2. A
energia gerada pela célula de combustível alimenta motores elétricos que fazem
com que os veículos entrem em movimento (LOPES, 2009). As figuras 7, 8 e 9
mostram exemplo de veículo movido com célula de combustível, a célula utilizada
e o motor, respectivamente.
O uso e desenvolvimento desta tecnologia está cada dia se tornando mais
atraente. Com a produção de células de combustíveis aumentando, o custo
diminui, podendo chegar a preços entre 50 e 100 dólares por kW produzido, bem
inferior aos custo de uma instalação estacionaria, que gira em torno de 1500
dólares por kW produzido (LOPES, 2009).
37
Tabela 2 - Quantidade de protótipos desenvolvidos por montadoras
automobilísticas.
Montadora
Quantidade de protótipos desenvolvidos
GM
13
Daimler-Chrysler
13
Honda
7
Toyota
7
Ford
6
Nissan
4
VW
4
Hyundai
3
Peugeot
3
Fiat
2
Mazda
2
Mitsubishi
2
Suzuki
2
Audi
1
Daihatsu
1
Esoro
1
Kia
1
Renault
1
Fonte: LOPES, 2009
Com a entrada de veículos movidos com célula de combustível no
mercado, postos de abastecimento de hidrogênio necessitam ser instalados de
modo que apresentem custo competitivos, assim como hoje existem os posto de
gasolina. Para que estes postos sejam instalados, acredita-se que o modo de
produção de hidrogênio seja descentralizados, tendo em vista uma facilidade
maior de obtenção de hidrogênio a partir de eletrólise e reformadores de gás
natural, metanol, etanol e diesel e estações instaladas nos próprios posto já que,
para uma produções centralizada, os custos com segurança e rede de distribuição
seriam elevados e a estocagem de grande quantidade de hidrogênio seria difícil
(LOPES, 2009).
38
Figura 7 - Modelo FCX Clarity, movido com célula de combustível, fabricado pela
montadora Honda. Fonte: HONDA (2013).
Figura 8 - Célula de combustível utilizado pela montadora Honda. Fonte: HONDA
(2013).
39
Figura 9 - Motor do modelo FCX Clarity da montadora Honda. Fonte: HONDA
(2013).
40
5- METODOLOGIA
A Metodologia adotada para este trabalho é a Pesquisa Bibliográfica,
compilando informações atualizadas sobre a produção e utilização de hidrogênio,
especificamente em células de combustível. Do ponto de vista dos objetivos foi
realizada uma pesquisa exploratória mostrando o estado da arte das tecnologias
que envolvem o hidrogênio, com abordagem qualitativa.
Para o desenvolvimento da pesquisa, foram visitados sites da internet
sobre o assunto, para direcionar a linha de pesquisa, que levaram a procurar
fontes científicas como artigos científicos, livros e teses de mestrado e doutorado,
principalmente da Universidade de Campinas, que apresenta um amplo estudo
sobre o assunto aqui apresentado e o Centro Nacional de Referência em Energia
do Hidrogênio, o CENEH, ligado ao Instituto de Física da Unicamp, sendo
responsável o Prof. Dr. Ennio Peres da Silva.
Graças a estas fontes, especificadas no item 9, que foi possível a
realização deste trabalho.
41
6- RESULTADOS E DISCUSSÃO
Observamos neste trabalho as tecnologias presentes hoje para a produção
de hidrogênio e seu uso para gerar energia através da célula de combustível.
Analises de viabilidade para implantação de plantas energéticas e cálculos
para investimentos podem ser feitos, bem como uma produção em massa,
esperando que o custo das células de combustível seja reduzido.
Para tanto, ainda se faz necessário uma apresentação sobre célula de
combustível neste trabalho.
6.1- A Célula de Combustível
A invenção da célula de combustível se deu no século passado, mas
passou a ser usada a partir dos anos 1960 pela NASA em seu projeto Gemini e
nos anos 1970 nas missões espaciais para fornecer energia e água aos
tripulantes dos veículos espaciais. Nos dias de hoje, o interesse em seu
desenvolvimento vem aumentando devido a sua razão potência/peso e sua
confiabilidade, pois não possui partes móveis. Com isso, sua aplicação para a
propulsão de veículos e aparelhos elétricos residências vem se tornando popular,
porem, seu alto custo, em média de U$ 500,00 para células de até 2W de
potência a U$ 7000,00 para células de 1kW de potência (FUELCELLSTORE,
2013), é um grande fator para que as células de combustível sejam amplamente
usadas, fator esse que pode ser amenizados com a usos de técnicas de produção
em massa (BAIRD, 2011).
A célula de combustível é um dispositivos semelhante a uma bateria ou
pilha comum, gerando corrente contínua por reações eletroquímicas, mas tem o
diferencial de poder ser alimentada continuamente, sem desgastes de eletrodos
como acontece nas baterias comuns. Essas alimentação é feita geralmente com
gás natural ou hidrogênio, reagindo com o oxigênio do ar, gerando potência
suficiente para alimentar pequenos aparelhos como celulares até grandes
indústrias em forma de várias células ligadas formando uma grande usina de
energia, com eficiência de 80%, podendo ser ampliada quando o calor gerado
pela célula for aproveitada para gerar mais energia elétrica (BAIRD, 2011).
42
A reação eletroquímica na célula de combustível pode ser comparada à
uma queima lenta do hidrogênio, seguindo a reação:
H2(g) + 1/2 O2 (g) → H20
∆H= 242 kJ/mol
(9)
Seu funcionamento consiste na entrada de gás hidrogênio pelo lado do
ânodo, onde o gás hidrogênio é decomposto em átomo de hidrogênio segundo a
equação de reação (10). Os elétrons geram eletricidade e os átomos de
hidrogênio passam pela membrana polimérica. O oxigênio entra pelo lado do
cátodo, reage com os átomos de hidrogênio segundo a equação de reação (11),
tendo como reação global a equação de reação (9) (BAIRD, 2011).
Reação anódica: H2(g) → 2 H+(aq) + 2 e-
(10)
Reação catódica: 1/2 O2(g) + 2 H+(aq) + 2 e- → H2O(l)
(11)
A Figura 11 ilustra seu funcionamento.
Figura 10 - Funcionamento de uma célula de combustível tipo PEMFC. Fonte:
http://celulasdecombustivel.planetaclix.pt/tipos.html, (2010).
As partes básicas da célula de combustível são o ânodos, por onde o
hidrogênio entra e perde seu elétron, este ânodo pode estar recoberto por
catalisador, uma membrana ou eletrólito e o cátodo, onde entra o oxigênio e, aos
encontrar com os íons de hidrogênio e os elétrons, forma a água (BAIRD, 2011).
43
6.2- Tipos de Células de Combustível
As células de combustível são classificadas de acordo com o tipo de
eletrólito e a temperatura que operam.
6.2.1- Célula de Combustível Alcalina (AFC)
Foram as primeiras a serem desenvolvidas e utilizadas em missões
espaciais tripuladas onde ocorra a disponibilidade de hidrogênio puro, sem a
presença de dióxido de carbono, mesmo que em pequenas quantidades, pois
este prejudica seu funcionamento. Sua eficiência energética pode alcançar 60% e
opera em diversas temperaturas (LOPES, 2009).
6.2.2- Célula de Combustível do Tipo Ácido Fosfórico (PAFC)
Consideradas a primeira geração de célula de combustível, são as que
estão em processo de pesquisa mais avançado. Operam numa temperatura de
200 ºC e pressão de 8 atm, utilizando hidrogênio gerado na reforma de um
combustível e ar como reagente. São utilizadas em plantas energéticas de 50 a
200 kW em sua maioria, porem, plantas com alcance de 1 a 5 MW já são
construídas. As empresas UTC Fuel Cell nos Estados Unidos, Toshiba
Corporation, Mitsubishic Electric Corporation e Fuji Electric Corporation no Japão
são as principais fabricantes deste tipo de célula de combustível (LOPES, 2009).
6.2.3- Célula de Combustível do Tipo Carbonato Fundido (MCFC)
São a segunda geração de célula de combustível. Operam entre 600 e
650ºC sendo mais eficientes que as do tipo PAFC. Tem a vantagem de não
necessitar de uma reformador de combustível externo, já que tal reforma ocorre
na própria célula, mas a corrrosividade do eletrólito de carbonato fundido
apresenta-se como sua desvantagem. Por operar em temperaturas mais altas,
usinas que utilizam este calor excedente podem chegar a 60% de eficiência na
44
geração de energia quando o gás natural é usado como combustível (LOPES,
2009).
6.2.4- Célula de Combustível do Tipo Óxido Sólido (SOFC)
Fazendo parte da segunda geração de células de combustíveis também.
Utilizando hidrocarbonetos como combustível, é a célula mais propícia para a
geração de eletricidade a partir dessa fonte, pois possui alta eficiência, admite
impurezas e também tem a capacidade de fazer a reforma dos hidrocarbonetos
combustíveis internamente, sem a necessidade de reformadores externos,
fazendo com que opere usando gás natural, gás de carvão, gasolina e álcool
como combustível já que aceita tanto hidrogênio como monóxido de carbono,
sendo esta sua grande vantagem (LOPES, 2009).
Sua desvantagem é a temperatura. Trabalhando entre 800 e 1000 ºC, com
mínimo de 650 ºC, necessita de tempo e queima de combustível para que essa
temperatura seja atingida, tornando-a inviável o seu uso em veículos, no entanto,
em usinas energéticas que trabalham continuamente, este fator não chega a ser
um problema (LOPES, 2009).
6.2.5- Célula de Combustível do Tipo Membrana de Troca de Prótons
(PEMFC)
Este tipo de célula de combustível utiliza como eletrólito uma membrana
sólida entre eletrodos porosos de carbono e seu catalisador é a platina. Opera em
diversas pressões e em temperaturas abaixo de 100 ºC, pois seu polímero
condutor de prótons necessita de água para obter a condutividade aceitável
(LOPES, 2009).
Empresas americanas como Ford e GM e japonesas como Toyota e Honda
já lançaram protótipos de carros utilizando este tipo de célula de combustível em
substituição aos tradicionais motores de combustão interna. Isto ocorre devidos
as suas características de partida rápida, operar em baixa temperatura e não
possuir membrana líquida, fazendo com que o setor automotivo seja o principal
para o uso das PEMFC. Outros setores de desenvolvimento são os de
eletroeletrônicos portáteis, como notebooks, laptops e celulares e fornecimento de
45
calor e energia para residências tendo o gás natural como fonte de hidrogênio
(LOPES, 2009).
6.2.6- Célula de Combustível do Tipo Metanol Direto (DMFC)
Operando em temperaturas entre 50 e 100 ºC, fazendo o uso direto de
metanol como fonte de hidrogênio sem necessidade de reformador externo e
utilizando membrana de polímero fino similar ao da PEMFC, faz com que este tipo
de célula de combustível seja ideal para aplicações pequenas e médias, no
entanto, sua eficiência girando em torno de 25% fez com que seu
desenvolvimento fosse abandonado na década de 90. Entretanto, nos últimos 15
anos, houve um grande desenvolvimento em pesquisas e protótipos, atingindo a
eficiência de 40%, principalmente em aplicações veiculares, e gerando potência
20 vezes maior em comparação ao início da década passada. Levando em
consideração aplicações onde a energia é mais importante que a potência,
aparelhos portáteis como celulares e laptops são o foco de seu uso (LOPES,
2009).
6.3- Discussão
Como apresentado, a célula de combustível já é utilizada há muito tempo,
tendo seu desenvolvimento e aperfeiçoamento com o passar dos anos, com áreas
de aplicação cada vez mais amplas, desde em terra em grandes e pequenas
instalações, fixas ou portáteis, até aplicações espaciais, fornecendo energia, calor
e água à tripulantes em missões de exploração fora do planeta.
Também vimos que cada tipo de célula de combustível apresenta
vantagens e desvantagens distintas, fazendo com que estudos de formas de
aplicação sejam aprofundadas. Alguns tipos já são bem utilizadas, como a tipo
PEMFC em automóveis e os tipos SOFC e MCFC em estações estacionárias,
alcançando eficiência satisfatórias, ainda mais se o calor de operação for
aproveitado para gerar mais energia. Os demais tipos demandam maior estudo e
investimento para melhor performance para que sejam utilizados em outras áreas.
46
7- CONCLUSÃO
Foram apresentadas neste trabalho as tecnologias estudadas e atualmente
utilizadas para a produção e o uso de hidrogênio para gerar energia por célula de
combustível, bem como sua armazenagem, distribuição e aplicações. Problemas
e dificuldades foram levantados, fazendo pensar como podem ser solucionados
para que, em um futuro não tão longe, o hidrogênio venha substituir fontes de
energia agressivas ao meio ambiente, tendo seu uso ampliado. Para que o
hidrogênio seja usado, deixando de ser o "combustível do futuro" e vindo a ser o
"combustível do presente", as pesquisas para solucionar os problemas
apresentados devem continuar, bem como o aperfeiçoamento ainda maior da
tecnologia já presente, com a finalidade de abaixar custos, fazendo com que o
hidrogênio e a célula de combustível acessível, tornando assim, o principal
fornecedor de energia.
47
REFERÊNCIAS
BAIRD, C.; CANN, M.; Química Ambiental, Porto Alegre, 2011
Célula
de
Combustível
-
Energia
do
futuro.
Disponível
em:
<http://celulasdecombustivel.planetaclix.pt/>. Acesso em: 25 de agosto de 2013
Centro Nacional de Referência em Energia do Hidrogênio. Disponível em:
<http://www.ifi.unicamp.br/ceneh/index.htm>. Acesso em: 15 de setembro de
1013.
FUELCELLSTORE. Disponível em:
<http://www.fuelcellstore.com/en/pc/home.asp>. Acesso em 20 de agosto de
2013.
HINRICHS, R. A.; KLEINBACH, M.; REIS, L. B.; Energia e Meio Ambiente, São
Paulo, 2010
HONDA MOTORS. Disponível em: <http://www.honda.com>. Acesso em: 3 de
outubro de 2013.
KENSKI, R. Revista Superinteressante, Março de 2003.
LOPES, D. G.; Análise técnica e econômica da inserção da tecnologia de
produção de hidrogênio a partir da reforma de etanol para geração de energia
elétrica com células a combustível, Campinas, 2009.
NETO,
E.H.G.;
Célula
de
Combustível
-
História.
Disponível
em:
<http://ambientes.ambientebrasil.com.br/energia/celula_combustivel/celula_combu
stivel_-_historia.html>. Acesso em: 8 de setembro de 2013.
SANTOS, A. M. R., Tendências tecnológicas das células a combustível para uso
do hidrogênio derivado do gás natural, Campinas: Faculdade de Engenharia
Mecânica, UNICAMP. Tese de Doutorado, 2008.
SANTOS, M. S. M.; SANTOS, A. C. M.; - O Combustível "Hidrogênio". Disponível
em: <http://www.ipv.pt/millenium/millenium31/15.pdf>. Acesso em: 21 de agosto
de 2013.
48
STEFANELLI, E. J.; Célula a Combustível hidrogênio.
Disponível
em:
Energia elétrica a partir do
http://www.stefanelli.eng.br/webpage/celula-
combustivel/celula-a-combustivel.html. Acesso em: 10 de setembro de 2013.