UNIVERSIDADE FEDERAL DO RIO DE JANEIRO
CENTRO DE CIÊNCIAS DA SAÚDE
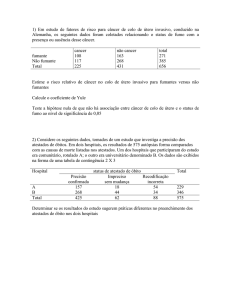
FACULDADE DE MEDICINA
DEPARTAMENTO DE RADIOLOGIA
TROMBOSE VENOSA PROFUNDA
COMO FATOR PROGNÓSTICO NA
SOBREVIDA DE PACIENTES COM
TUMOR DE COLO UTERINO AVANÇADO
Marcos José Pereira Renni
Tese de Doutorado submetida ao Corpo
Docente da Faculdade de Medicina da
Universidade Federal do Rio de Janeiro,
como parte dos requisitos necessários à
obtenção do Grau de Doutor em Medicina.
Área de Concentração: Radiologia.
Orientador:
Prof. Dr. Hilton Augusto Koch
Rio de Janeiro
2013
ii
FICHA CATALOGRÁFICA
Renni, Marcos José Pereira
Trombose venosa profunda como fator prognóstico na sobrevida de pacientes com
tumor de colo uterino avançado / Marcos José Pereira Renni. − Rio de Janeiro: UFRJ /
Faculdade de Medicina, 2013.
xi, 52 f. : il. ; 31 cm.
Orientadores: Hilton Augusto Koch.
Tese (Doutorado) − UFRJ, FM, Programa de Pós-graduação em Medicina, Radiologia, 2013.
Referências bibliográficas: f. 38-44.
1. Embolia e Trombose - diagnóstico. 2. Embolia e Trombose - mortalidade. 3. Neoplasias
do Colo do Útero - mortalidade. 4. Neoplasias do Colo do Útero - diagnóstico. 5. Neoplasias
do Colo do Útero – epidemiologia. 6. Diagnóstico por imagem. 7. Tromboembolia Venosa
– diagnóstico. 8. Tromboembolia Venosa – fisiopatologia. 9. Tromboembolia Venosa – mortalidade. 10. Tomografia Computadorizada Multidetectores. 11. Estudos Retrospectivos. 12.
Estudos Prospectivos. 13. Feminino. 14. Meia-Idade. 15. Adulto Jovem. 16. Humanos. 17.
Radiologia - Tese. I. Koch, Hilton Augusto. II. Universidade Federal do Rio de Janeiro, FM,
Programa de Pós-graduação em Medicina, Radiologia. IV. Título.
iii
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO
CENTRO DE CIÊNCIAS DA SAÚDE
FACULDADE DE MEDICINA
DEPARTAMENTO DE RADIOLOGIA
TROMBOSE VENOSA PROFUNDA
COMO FATOR PROGNÓSTICO NA
SOBREVIDA DE PACIENTES COM
TUMOR DE COLO UTERINO AVANÇADO
Autor: Marcos José Pereira Renni
Orientador: Prof. Dr. Hilton Augusto Koch
Banca Examinadora:
Profa. Dra. Bianca Gutfilen Grunbaum
Prof. Dr. Sérgio Augusto Lopes de Souza
Profa. Dra. Gláucia Maria Moraes de Oliveira
Profa. Dra. Mônica Hermida Cerqueira
Profa. Dra. Anke Bergmann
Prof. Dr. Fábio Bastos Russomano
Profa. Dra. Rosana Souza Rodrigues
Rio de Janeiro
2013
iv
DEDICATÓRIA
Dedico este trabalho ao Dr. Luiz Figueiredo
Mathias, por sua amizade, e exemplo de
força e determinação.
À minha esposa, Marília, e meus filhos,
Yasmin e Yuri, por tornarem meus dias
plenos de alegrias, realizações e vontade
de viver.
Em memória da minha mãe, Almy, que
sempre me incentivou a seguir em frente.
v
AGRADECIMENTOS
Ao Prof. Dr. Fábio Bastos Russomano, pois sem sua competência, orientação e
boa vontade, eu não concluiria este trabalho.
Ao Prof. Dr. Hilton Augusto Koch, que graças a sua generosidade, compreensão,
sagacidade e liderança tornou viável meu sonho.
À Dra. Tânia Barbalho, pois através de sua força e empatia, consegui dar prosseguimento a esta pesquisa.
Ao Dr. Luiz Figueiredo Mathias, meu conselheiro, exímio médico, meu consultor em
ginecologia, que acreditou no meu potencial desde minha chegada ao Hospital do
Câncer II (HC II).
Ao meu amigo Marcelo Mello Madeira, que está sempre presente nos meus
momentos de sufoco, e que com sua competência, dedicação e rigor tornou possível a edição desta tese.
Ao Fernando Paiva (RHC/INCA), que me ajudou na identificação dos prontuários e
dados no RHC.
Ao Magnus Gregory, residente da radiologia, por seu auxílio na construção do banco de dados.
À Direção do HC II, Dr. Reinaldo Rondineli, Dr. Luiz Claudio Bruno,
Dra. Marcela Vasconcelos, que incentivaram meu trabalho e tornaram possível sua realização.
Aos médicos do Serviço de Radiologia do HC II, Cynthia Queiroz, Raul Muniz,
Daniela Considera e Ivan Vergolino, por tirarem minhas dúvidas, pelo apoio e por
tornarem os desdobramentos desse estudo uma realidade.
A Regina Barros, secretária do Prof. Hilton, por seu bom humor, apoio e dicas.
Às secretárias Dalila Meireles e Lúcia Maria de Oliveira, pelos conselhos, a humanidade
e o profissionalismo que muito facilitaram meus caminhos dentro do Programa de
Pós-Graduação em Medicina (Radiologia) da UFRJ.
Aos docentes do Programa de Pós-Graduação em Medicina (Radiologia) da UFRJ,
por terem me recebido de braços abertos.
vi
Aos professores doutores que compuseram a Banca Examinadora, pela
disponibilidade e tempo dispensado.
Aos pacientes, que através da sua dor e sofrimento permitiram a realização deste
estudo.
A Valéria Pacheco, bibliotecária do INCA, pelo auxílio na busca de artigos e apoio.
A Silvia Dalston, bibliotecária do INCA, pelo levantamento de artigos e contribuição
preciosa na formatação das referências bibliográficas.
À minha secretária Cristiane Rufino, pelo apoio e colaboração.
Ao Paulo Leite, do arquivo médico, pelo auxílio na busca de dados em
prontuários.
A todos aqueles que, de alguma forma, contribuíram para a realização deste
estudo.
vii
“Conte seu jardim pelas flores,
nunca pelas folhas caídas.
Viva cada minuto de sua vida como
se fosse viver eternamente.
E cada hora que passar não conte
pelos ponteiros romanos de um relógio
e sim pelo pulsar do seu coração.
E através de toda a sua existência
conte sua idade pelos amigos que
conquista e nunca pelos anos que vive.”
Autor desconhecido
viii
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
ARM - Angiorressonância magnética
CEP - Comitê de Ética e Pesquisa
CID - Coagulação Intravascular Disseminada
DVT - Deep Venous Thrombosis
EUA - Estados Unidos da América
FIGO - Federação Internacional de Ginecologia e Obstetrícia
FRONTLINE - The Fundamental Research in Oncology and Thrombosis
FT - Fator Tecidual
FVC - Filtro de Veia Cava
HAS - Hipertensão Arterial Sistêmica
HPV - Papilomavírus humano
IMC - Índice de massa corporal
INCA - Instituto Nacional de Câncer José Alencar Gomes da Silva
MMIIS - Membros inferiores
MPs - Micropartículas
MS - Ministério da Saúde
PARs - Receptores de Protease-Ativada
RHC - Registro Hospitalar de Câncer
RM - Ressonância magnética
SPECT - Single Photon Emission Computed Tomography
SPSS - Statistic Package for Social Sciences
TCMD - Tomografia computadorizada com múltiplos detectores
TEP - Tromboembolismo Pulmonar
TEV - Tromboembolismo Venoso
TNF - Fator de Necrose Tumoral
TVP - Trombose Venosa Profunda
VEGF - Fator de Crescimento Endotelial Vascular
ix
RESUMO
No Brasil, o câncer do colo do útero tem uma alta incidência. Em 2012 foram
esperadas 17.540 novas pacientes com diagnóstico de câncer do colo do útero
(17/100.000 mulheres). A maioria dos casos é diagnosticada em estágios avançados, com grande morbidade, pior prognóstico, alto custo para o governo e um terrível impacto social. O objetivo deste estudo foi analisar o impacto do diagnóstico de
Trombose Venosa Profunda (TVP) no prognóstico de mulheres diagnosticadas com
câncer do colo do útero estágio IIIB (FIGO), em tratamento no Instituto Nacional
de Câncer José Alencar Gomes da Silva (INCA)/Ministério da Saúde (MS) - Brasil.
Foram identificadas 1.020 mulheres admitidas para tratamento na Instituição, de
2000 a 2004, em FIGO IIIB (CID C53.9). Os dados foram obtidos a partir do Registro Hospitalar de Câncer (RHC) do INCA/MS. As pacientes foram acompanhadas
a partir da data do diagnóstico de câncer cervical no INCA/MS, até a morte ou a
última visita médica. A data do diagnóstico de TVP foi considerada como a de seu
diagnóstico por imagem, feito por um dos seguintes testes: a ultrassonografia com
ecodoppler, tomografia computadorizada e um caso por ecocardiografia. Para a
análise de sobrevida foi utilizado o método de Kaplan-Meyer. O resultado do estudo
indica que a presença de TVP em pacientes com câncer de colo uterino IIIB (FIGO)
parece ser um fator de gravidade e pior prognóstico. Identificamos que, no seguimento, as pacientes que desenvolveram TVP apresentavam progressão da doença
por ocasião do diagnóstico de trombose.
x
ABSTRACT
In Brazil, cervical cancer has a high incidence. In 2012 were expected 17,540 new
patients with diagnosis of cervical cancer (17/100,000 women). Most of them are
diagnosed in advanced stages, with great morbidity, poor prognosis and a high cost
to the government and a terrible social impact. Our aim was to examine the impact
of Deep Venous Thrombosis (DVT) diagnosis in prognosis of women diagnosed
with cervical cancer stage IIIB (FIGO), that have been in treatment at Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA)/Ministério da Saúde (MS)
- Brazil. We identified 1,020 women admitted in INCA from 2000 to 2004, in FIGO
IIIB stage (ICD C53.9). Data was obtained from the Cancer Hospital Registry of INCA/
MS. Patients were followed from the date of cervical cancer diagnosis at INCA/MS
until death or the last medical visit. The DVT diagnosis was considered after the
confirmation by image methods: doppler ultrasound scanning, CT scan and one
case by echocardiography. For the long term survival analysis, we used the Kaplan-Meyer Method. The results obtained suggest that the presence of DVT in patients
with cervical cancer FIGO IIIB seems to be a factor of gravity and poor prognosis.
In the DVT group, patients in follow up after treatment had DVT near the diagnosis
of disease’s progression. It is possible that progression of disease was the major
reason of DVT.
xi
SUMÁRIO
Ficha Catalográfica ................................................................................................ ii
Dedicatória ............................................................................................................ iv
Agradecimentos ................................................................................................... v
Epígrafe ................................................................................................................ vii
Lista de Abreviaturas, Siglas e Símbolos ............................................................... viii
Resumo ................................................................................................................ ix
Abstract ................................................................................................................ x
1. INTRODUÇÃO E OBJETIVOS ......................................................................... 1
2. REVISÃO DA LITERATURA ............................................................................ 3
3. PACIENTES, MATERIAL E MÉTODO ............................................................ 26
4. RESULTADOS ................................................................................................. 29
5. DISCUSSÃO ...................................................................................................... 33
6. CONCLUSÃO .................................................................................................. 37
Referências Bibliográficas .................................................................................... 38
Anexos ................................................................................................................. 45
1
1. INTRODUÇÃO E OBJETIVOS
O câncer é a segunda maior causa de morte por doença no Brasil. No mun-
do, o câncer do colo do útero, o segundo mais comum entre as mulheres, é responsável por cerca de 529.000 novos casos e pelo óbito de aproximadamente 275.000
mulheres por ano. Entre as brasileiras, ele continua a ser considerado a maior causa de mortalidade por câncer, sendo que em 2012 eram esperados 17.540 novos
casos, com um risco estimado de 17 casos a cada 100.000 mulheres26.
A incidência de câncer do colo do útero torna-se evidente a partir da faixa
etária de 20 a 29 anos, quando o risco aumenta significativamente, até atingir seu
pico na faixa etária de 45 a 49 anos11. Em países desenvolvidos, a sobrevida média
estimada em cinco anos varia de 59 a 69%. Nos países em desenvolvimento, como
o Brasil, os casos são encontrados em estágios relativamente avançados e, consequentemente, a sobrevida média cai para 49% em cinco anos51.
A desigualdade no acesso aos serviços de saúde pode ser uma justificativa
para a alta incidência, o diagnóstico em estágios avançados e a elevada taxa de
mortalidade por câncer do colo do útero no país.
Essa dificuldade para a realização do exame preventivo e das etapas seguin-
tes, no caso de identificação de uma lesão precursora ou invasiva inicial, contribui
para o avanço da neoplasia do colo uterino e, posteriormente, para o atendimento
dessas pacientes com a doença em estágios mais avançados.
As pacientes que se matriculam no Hospital do Câncer II (HC II)/Instituto Na-
cional de Câncer José Alencar Gomes da Silva (INCA)/Ministério da Saúde (MS),
estão, muitas vezes, em estágios avançados, já sem possibilidade de cirurgia. Isto
indica, por si só, um pior prognóstico, com alta morbidade e mortalidade. Assim,
a proposta terapêutica passa a ser a quimioterapia, radioterapia e braquiterapia.
Estas terapias apresentam uma série de complicações, com efeitos colaterais de
extrema morbidade, implicando em altíssimo custo social e econômico. Faz-se
necessário um número maior de consultas ambulatoriais, de exames radiológicos
como tomografias e ressonâncias, e um elevado número de internações hospitalares que acarretam um maior absenteísmo de seus familiares ao trabalho, além das
mudanças no ambiente familiar relacionadas ao cenário de dor e limitações.
Introdução e Objetivos
2
Embora o câncer seja amplamente conhecido por aumentar o risco de complicações tromboembólicas, nas mulheres com câncer não é um fator de risco independente para a TVP58,64. O desenvolvimento de Trombose Venosa Profunda
(TVP), na vigência de uma neoplasia ginecológica, parece denotar um pior prognóstico. Temos poucos estudos em pacientes com tumor do colo do útero, mas
os dados publicados apontam para uma elevada incidência de TVP nesse grupo
e comprometimento da sobrevida28,29,73. Em geral, entre os pacientes oncológicos,
muitos dos fatores para tromboembolismo têm sido identificados, incluindo a Tríade
de Virchow: hipercoagulabilidade, injúria endotelial e estase venosa. Outros fatores
como o tipo tumoral, os procedimentos cirúrgicos, as quimioterapias com e sem tratamento adjuvante e a imobilização da paciente, aumentam as chances de desenvolvimento de TVP. Estudos com pacientes internadas para tratamento de tumores
sólidos evidenciam a ocorrência de TVP entre 7% e 11% da população33,73. A TVP
está associada a mortalidade, a morbidade e ao potencial atraso nos tratamentos
para o câncer, bem como ao consumo de recursos escassos na saúde41,47,79.
A compreensão dos mecanismos fisiopatológicos da associação entre câncer e trombose tem revelado um grande número de caminhos e alvos para intervenções futuras nesse grupo de pacientes, onde a trombose é um evento frequente73.
O presente estudo torna-se relevante pelo fato de apresentar um número significativo de pacientes com neoplasia do colo do útero (acompanhadas por um período
de 36 meses), num mesmo estágio, avaliando o fenômeno trombótico dentro de uma
amostra populacional homogênea. Outros estudos de TVP em pacientes oncológicos
têm sido realizados, entretanto apresentam um número amostral menor ou subdividido em várias neoplasias e diferentes estágios.
1.1. OBJETIVO GERAL
• Avaliar o impacto da TVP na sobrevida de mulheres com câncer do colo do
útero em estágio IIIB.
1.2. OBJETIVOS ESPECÍFICOS
• Determinar a incidência de TVP na população do estudo.
• Analisar a sobrevida dessas pacientes do estudo em três anos de seguimento, em função de terem apresentado TVP ou não.
• Analisar a associação entre a TVP, o momento na evolução clínica em que
esta ocorre e o óbito.
3
2. REVISÃO DA LITERATURA
2.1. CÂNCER DO COLO DO ÚTERO
O câncer do colo do útero tem evolução lenta e silenciosa na sua fase inicial,
sendo precedido por doença pré-invasiva (neoplasia intraepitelial cervical graus 2
e 3). Vários são os fatores de risco para seu desenvolvimento, dentre eles a infecção pelos tipos oncogênicos do Papilomavírus humano (HPV). Apesar de todos os
recursos disponíveis para identificar e tratar essas pacientes, muitas mulheres chegam às unidades de saúde com a doença em estágios avançados, em decorrência
de inúmeras barreiras de ordem social, política, cultural ou estrutural do sistema de
saúde, que dificultam o seu acesso aos centros de saúde, à prevenção e ao diagnóstico do câncer cervical em suas fases iniciais27,83.
Os tipos histológicos principais são o escamoso e o adenocarcinoma. A dis-
seminação do tumor se dá por invasão direta para o estroma adjacente, o epitélio
vaginal e tecidos paracervicais. Ocorre a penetração do tumor no território linfovascular com comprometimento linfonodal27. O estadiamento da doença é estabelecido de acordo com a classificação da Federação Internacional de Ginecologia e
Obstetrícia (FIGO-2009) para câncer do colo do útero (Anexo i)21.
O quadro clínico da maioria das pacientes evolui, de acordo com o estágio,
com inúmeras complicações não somente relacionadas à doença, mas também
decorrentes do tratamento a que foram submetidas.
A retite actínica, decorrente do tratamento radioterápico, leva a queixas im-
portantes como desconforto e sangramento retal, que espolia significativamente
essas mulheres. Outras complicações são o linfedema crônico, a incontinência
urinária e a insuficiência renal obstrutiva. Esta última acarreta a execução de procedimentos mais complexos − implantes de cateteres, nefrostomias − com a necessidade de acompanhamento ambulatorial com especialistas, visando manter as
pacientes vivas, a despeito do grande sofrimento e limitação em que se encontram.
Frequentemente, ocorrem fistulas vesico-vaginais ou retais, com complicações infecciosas, cirúrgicas, que acarretam internações prolongadas, em alguns casos o
óbito.
Revisão da Literatura
4
As alterações hematológicas como as citopenias, trombocitoses, discrasias
sanguíneas, tromboses venosas profundas e até mesmo trombofilias adquiridas,
permeiam o universo de complicações das pacientes durante seu acompanhamento clínico. Em alguns casos, a TVP pode surgir como o primeiro sintoma da neoplasia, ou ocorrer em qualquer momento na evolução clínica dessas pacientes6,53,75.
A quimioterapia em pacientes com tumores volumosos acarreta a lise tu-
moral. Estas células mortas podem estar associadas à ativação da coagulação
do sangue40. Na sua forma mais grave, a lise tumoral, induzida pela quimioterapia,
determina a Coagulação Intravascular Disseminada (CID) aguda que se manifesta
pelo consumo de proteínas de coagulação, de plaquetas e sangramento com risco
de vida. Na sua forma menos grave, o tratamento de certas neoplasias pode determinar a CID crônica, que se manifesta por doença trombótica em face da elevada
degradação dos produtos da fibrina e da diminuição dos níveis de fibrinogênio. A
leucopenia grave, induzida pela quimioterapia ou radioterapia, pode se associar a
quadros infecciosos e CID relacionada a sépsis40.
A TVP se destaca por ser uma complicação comum em pacientes com diag-
nóstico de câncer, sendo uma importante causa de morbidade e mortalidade nestes indivíduos. Pacientes com TVP e câncer tem um risco três vezes maior de recorrência tromboembólica e morte (por qualquer causa), quando comparados aos
pacientes com TVP sem câncer. Acredita-se que o desenvolvimento de TVP está
associado a um pior prognóstico nos pacientes com neoplasias43,73,74.
2.2. CÂNCER E TROMBOSE
2.2.1. Introdução
O câncer e seus tratamentos são reconhecidos como fatores de risco para
TVP. Embora os tumores sólidos tenham sido historicamente associados à TVP,
dados mais recentes sugerem risco similar em pacientes com neoplasias hematológicas. A incidência de Tromboembolismo Venoso (TEV) em pacientes com câncer
ainda não está bem documentada, não sendo evidente que o risco absoluto dependa do tipo de tumor, do estágio ou da extensão do câncer ou do tratamento com
agentes antineoplásicos3,34,55.
Revisão da Literatura
5
Os tipos de cânceres mais comuns, observados em pacientes com trombo-
se, são os de mama, colorretal e pulmão, refletindo a prevalência dessas neoplasias na população em geral. Quando a prevalência é levada em consideração, os
cânceres de pâncreas, ovário e cérebro são os mais fortemente associados com
complicações trombóticas9,38,41,55,56,72,75.
A trombose, uma das principais complicações de doenças malignas, é tam-
bém a causa de morte em pacientes com câncer. A associação clínica entre neoplasias e desordens hematológicas é conhecida há mais de um século, e os eventos tromboembólicos são potencialmente mais frequentes neste grupo, onde um a
cada cinco pacientes com neoplasia vai apresentar TVP durante a evolução natural
de sua doença39. Um em cada sete pacientes com câncer que morre no hospital
tem o óbito relacionado ao tromboembolismo pulmonar. Destes pacientes, 60% têm
câncer em sítio único ou doença metastática limitada. Segundo Prandoni e cols.,
eles sobreviveriam por mais tempo na ausência de doença tromboembólica55.
2.2.2. Epidemiologia
A TVP é um problema grave que acomete duas a sete vezes mais os pa-
cientes com neoplasias. Ela é a segunda principal causa de morte em pacientes
oncológicos internados, ultrapassada apenas por causas infecciosas. Diversos estudos estão sendo realizados para definir, com mais precisão, a prevalência de TVP
associada ao câncer, pois acredita-se que esta associação esteja subestimada.
Em recente metanálise, evidenciou-se que 15% dos pacientes que desenvolveram
TVP foram diagnosticados com algum tipo de câncer nos 12 meses subsequentes
ao diagnóstico de TVP. A magnitude da TVP é tamanha que estima-se que pacientes oncológicos que desenvolveram TVP apresentem 94% de probabilidade
de vir a falecer nos próximos seis meses após o episódio. Entendemos assim que
a TVP é considerada um marcador preditivo negativo de sobrevida nos pacientes
oncológicos8,16,34,50,77.
Entretanto, o risco de TVP não é igual para todos os pacientes com câncer ou
no mesmo paciente ao longo do tempo41,51,79. Determinadas situações como as características tumorais, localização, agressividade e as condições clínicas do paciente vão
propiciar ou não o aparecimento da TVP em um determinado momento22,62,63. Vários
estudos realizados em pacientes internados com câncer têm mostrado um aumento
do risco de TVP naqueles que se encontram em estágio avançado da doença.
Revisão da Literatura
6
Em uma coorte realizada nos Estados Unidos da América (EUA), verificou-
se que a TVP foi a segunda causa de morte em pacientes que estavam recebendo
quimioterapia ambulatorial50. Em outro estudo norte americano de base populacional, incluindo 389 pacientes com TVP recém-diagnosticados e câncer, observouse que aqueles com metástases a distância apresentaram uma incidência maior
de TVP37. Entre pacientes hospitalizados em três centros de tratamento, a TVP
ocorreu em 5,6% dos pacientes em estágios iniciais e em 10,3% nos pacientes com
doença avançada37.
A incidência de TVP nos pacientes com vários tipos de neoplasias perma-
nece, em grande parte, desconhecida, devido à heterogeneidade da população e à
dificuldade de realização de grandes estudos epidemiológicos. A incidência anual
de um primeiro episódio de TVP ou Tromboembolismo Pulmonar (TEP) na população de um condado norte-americano foi de 117/100.000 habitantes. O câncer por
si só está associado a um risco quatro vezes maior para TVP ou TEP, enquanto a
quimioterapia aumenta esse risco em seis vezes. Portanto, a estimativa aproximada da incidência anual de TVP, em uma população com neoplasia, pode ser de
aproximadamente 1/200 habitantes41.
Nos pacientes oncológicos, a incidência de TVP pós-operatória é duas ve-
zes maior quando comparada aos pacientes livres de neoplasias. Fatores como a
imobilização, tratamentos quimioterápicos e colocação de cateteres venosos centrais, também aumentam o risco de TVP nesse grupo59. Os pacientes com câncer
apresentam um risco elevado de tromboembolismo recorrente, particularmente nos
meses subsequentes a interrupção do tratamento anticoagulante. Este risco chega a ser duas vezes maior quando comparado aos pacientes que desenvolveram
TVP por outras causas. Eles apresentam uma incidência cumulativa de tromboembolismo recorrente cerca de 3,5 vezes maior que os pacientes sem neoplasias57.
Observamos no seguimento das pacientes, que as tromboses recorrentes, mesmo
na vigência de anticoagulação plena, ocorrem, com frequência, nos pacientes com
doença mais agressiva, denotando um pior prognóstico.
Certos tumores estão fortemente associados à TVP. Nos pacientes que
apresentam TVP, os tipos tumorais mais frequentes são aqueles prevalentes na
população em geral. Baseado em ensaios clínicos contemporâneos, a TVP acomete cerca de 20% dos homens com tumores de pulmão, cólon e próstata, e das
mulheres com tumores de mama, pulmão e ovário41.
Revisão da Literatura
7
Para determinados tipos de tumores, os dados mais confiáveis sobre a inci-
dência de TVP vêm de ensaios clínicos controlados. Para outros tipos de câncer,
informações sobre as taxas de TVP são limitadas e vêm de pequenas séries de
casos ou de estudos retrospectivos. O risco de trombose parece ser maior em
pacientes com câncer avançado, especialmente aqueles que estão recebendo terapia citotóxica. Por exemplo, cerca de 10% das mulheres com câncer ovariano
avançado, em tratamento com quimioterapia, e até 28% dos pacientes com gliomas
malignos, têm mais chances de desenvolver TVP41.
A quimioterapia está fortemente associada ao aumento do risco de TVP. Os
pacientes em terapia com citotóxicos têm um risco 6,5 vezes maior de desenvolver
TVP, e respondem por 13% dos episódios de TVP na população. Um estudo de
coorte retrospectivo descrito por Blom e cols. relata que os pacientes em quimioterapia tiveram 2,2 vezes maior risco para TVP8,16,41.
2.2.3. Fatores de risco e mecanismo para formação de trombos
A população de pacientes com câncer forma um grupo heterogêneo, composto
por indivíduos recém-diagnosticados e outros que se encontram em momentos diversos da evolução da doença. O risco de TVP é marcadamente diferente para cada
um desses subgrupos. Além disso, um paciente com câncer pode fazer a transição
entre esses subgrupos, em momentos diferentes, durante a história natural da doença. Desse modo, a avaliação do risco para desenvolver TVP é um processo dinâmico. Ele envolve fatores relacionados ao risco de desenvolvimento de trombose, tais
como: idade avançada, sexo, etnia (maior em afro-americanos e menor em asiáticos),
sítios tumorais (cérebro, pâncreas, estômago, pulmão, bexiga, tumores ginecológicos
e hematológicos), estágios avançados da doença e período inicial após o diagnóstico.
Temos ainda os fatores relacionados ao tratamento, tais como: cirurgias, hospitalização, quimioterapia, terapias antiangiogênicas, agentes estimulantes da eritropoiese,
contagem elevada de plaquetas pré-quimioterapia, D-dímero elevado e expressão do
Fator Tecidual (FT)1,8,12,13,16,35,36,37,41,45,55,65,79,80. Os novos biomarcadores têm sido recentemente identificados de forma a agregar um valor preditivo de TVP em câncer16,79.
Há vários mecanismos que se sobrepõem e interagem, e que podem
explicar o aumento da incidência de trombose em pacientes com neoplasias.
Trousseau, em 1865, observou que alguns pacientes apresentavam tromboses
inesperadas, incomuns, com padrão migratório e, posteriormente, manifesta-
Revisão da Literatura
8
vam uma malignidade visceral70,85. A Síndrome de Trousseau é reconhecida
como tendo muitas formas, incluindo o tromboembolismo venoso espontâneo
em associação com doença neoplásica oculta. Ela tem sido amplamente utilizada para englobar todos os aspectos da doença tromboembólica venosa associada ao câncer. As complicações tromboembólicas incluem um amplo espectro de problemas clínicos, desde trombose venosa profunda e superficial até
embolia pulmonar22,68.
As propriedades pró-trombóticas, específicas do tumor, contribuem com o
processo de crescimento tumoral e sua disseminação. A formação de trombina,
enzima final efetora da cascata de coagulação, e a produção de fibrina, produto
final da ativação da coagulação sanguínea, são dependentes dos mecanismos
de progressão tumoral. Além disso, propriedades tumorais pró-trombóticas podem interferir com a malignidade, através de mecanismos independentes de
coagulação. Relevante, neste cenário, é o papel emergente da atividade não
coagulante do FT, em particular a sua capacidade de modular a expressão do
Fator de Crescimento Endotelial Vascular (VEGF), pelas células neoplásicas e
células vasculares normais. Esta propriedade regula a neovascularização do
tumor e fornece uma importante relação entre pacientes com câncer e ativação
da coagulação, inflamação, trombose, crescimento tumoral e metástases. Desde a observação inicial por Trousseau, muitos estudos têm abordado a relação
entre câncer e tromboembolismo venoso. Este distúrbio é uma complicação comum em pacientes com câncer, sendo, em alguns casos, a primeira manifestação
da doença neoplásica15,22,41,75.
Os pacientes oncológicos apresentam alterações no endotélio vascular, acar-
retadas pela doença ou ainda pelos tratamentos aos quais são submetidos. Estes pacientes estão sujeitos a imobilizações prolongadas pelo curso de sua doença ao longo
do tratamento, bem como alterações hematológicas decorrentes da atividade tumoral.
Assim, os três elementos-chave da Tríade de Virchow (Quadro 1) − estase, lesão vascular e hipercoagulabilidade, publicados em 1856, servem para explicar a fisiopatologia
da trombose nesse grupo de pacientes14. Ela foi descrita inicialmente como a presença
de anormalidades no endotélio vascular, nos componentes do sangue e nas alterações
do fluxo sanguíneo. A Tríade de Virchow, acrescida das informações atuais sobre os
constituintes do sangue e suas interações no processo fisiopatológico da trombogênese,
fornece uma ferramenta útil para analisar o porquê de pacientes com câncer serem
Revisão da Literatura
9
particularmente suscetíveis ao tromboembolismo venoso espontâneo14. O repouso no leito e a compressão extrínseca dos vasos sanguíneos por massas tumorais
acarretam a estase vascular. A lesão da parede vascular decorre de várias causas,
que podem atuar localmente ou à distância, como por exemplo: a invasão direta do
vaso pelo tumor, o uso prolongado de cateter venoso central, a formação de lesão
endotelial secundária à quimioterapia e os procedimentos cirúrgicos44. O endotélio
produz substâncias como o óxido nítrico e a prostaciclina, que mantêm as plaquetas
no estado não ativado e evitam sua adesão. Quando a camada endotelial é rompida, no entanto, as plaquetas são expostas a ligações subendoteliais, para as quais
possuem receptores específicos que ativam a coagulação44. A inflamação, através da
liberação de mediadores, estimula o endotélio a produzir FT, inibidor do ativador do
plasminogênio, e a redução da trombomodulina, diminuindo, desta forma, a capacidade protetora do endotélio2.
Quadro 1 - Elementos-chave da Tríade de Virchow19
Nos pacientes oncológicos, a hipercoagulabilidade é produzida por um con-
junto complexo de mecanismos:
a - Lançamento de Micropartículas (MPs) derivadas do tumor, rico em potentes
fatores teciduais pró-coagulantes e citocinas capazes de ativar o endotélio.
b - Danos aos mecanismos de defesa das células endoteliais.
c - Reduções dos inibidores naturais, deficiência de antitrombina, proteína
C ou proteína S.
d - Aumento das interações adesivas entre as células tumorais, células do
endotélio vascular, plaquetas e monócitos/macrófagos, mediado por interações de selectina lectina14,19,20.
Revisão da Literatura
10
Presume-se que a ativação da coagulação nos pacientes oncológicos
seja simplesmente uma reação do hospedeiro ao desenvolvimento do tumor,
não desempenhando qualquer papel fundamental nos eventos moleculares que
levam ao desenvolvimento do câncer19,20.
O crescimento tumoral está associado ao desenvolvimento do estado
de hipercoagulabilidade. Observa-se nos pacientes com neoplasias, alterações nos testes marcadores da ativação da hemostasia, tais como dosagem
de fibrinogênio, D-dímero, quando comparados a um grupo controle normal.
Eles sugerem um processo contínuo de formação e remoção de componentes
do coágulo e da fibrina, que atuam na trombogênese e também na adesão tumoral. Muitos estudos têm descrito a presença de fibrina ou de plaquetas em
torno de vários tipos de tumores, o que sugere a ativação local da coagulação
e um envolvimento de mecanismos hemostáticos no crescimento de tecidos
tumorais34,55,71.
A ativação da coagulação sanguínea em pacientes com câncer é complexa
e multifatorial. Mecanismos pró-trombóticos estão relacionados ao paciente e ao
tipo tumoral, e incluem a reação de fase aguda, a produção de paraproteína, inflamação, necrose e distúrbios hemodinâmicos. Efeitos pró-coagulantes são também
exercidos pela quimioterapia antineoplásica e radioterapia. No entanto, uma parte
importante é desempenhada pela ação específica do tumor, na formação do coágulo e nos mecanismos pró-trombóticos expressos pelas células tumorais. As células
neoplásicas podem ativar a cascata de coagulação através de várias substâncias:
substâncias pró-coagulantes, fibrinolíticas, citocinas, cisteína protease, substâncias
pró-inflamatórias, pró-angiogênicas e por interação direta com o endotélio vascular,
leucócitos e plaquetas43,69,88.
O estado pró-trombótico do câncer é acionado por eventos oncogênicos
específicos. O FT é expresso em uma variedade de células tumorais, induzido
pela ativação de oncogenes ou interação de genes tumorais supressores. Estudos recentes têm fornecido fortes evidências de que a coagulação sanguínea,
talvez na maioria das vezes mediada pelo FT (presente nas MPs), está diretamente ligada à transformação induzida pelos oncogenes. A ativação do sistema
de coagulação parece estar associada ao processo de crescimento tumoral,
metástase e angiogênese. O desenvolvimento de TVP antes ou concomitante
Revisão da Literatura
11
ao diagnóstico de câncer, parece prever um comportamento agressivo do tumor,
correlacionando-se com a angiogênese tumoral e o envio precoce de metástases a distância16,43,64,69,88.
Várias hipóteses têm sido apresentadas, incluindo a expressão do FT por
células tumorais, a liberação do FT durante a morte celular (após a quimioterapia),
as propriedades intrínsecas únicas pró-coagulantes tumorais e as micropartículas.
A exploração de um papel potencial de MPs associado à trombose, indica que elas
estão presentes em um espectro de pacientes oncológicos, conhecidos por apresentarem uma elevada incidência de complicações tromboembólicas22.
As células tumorais produzem substâncias pró-coagulantes, como o FT, o
Fator de Necrose Tumoral (TNF) e o VEGF, que estão envolvidas no crescimento
tumoral e na ativação da cascata de coagulação88. O FT é o ativador primário da
coagulação em indivíduos saudáveis. Ele se expressa na superfície da maioria
das células não vasculares e forma um complexo com o Fator VII, para ativar os
Fatores X e IX por proteólise. Em células vasculares normais, a expressão do FT
é rigidamente controlada. Entretanto, parece ocorrer um aumento da expressão do
FT pelas células neoplásicas, induzido por estímulos inflamatórios, como as citocinas interleucina 1 e o FNT, bem como os lipopolissacarídeos de bactérias. Desse
modo, o início da coagulação do sangue pelo FT pode acontecer diretamente através da expressão do fator na superfície de células neoplásicas, ou indiretamente
através de sua ação em células endoteliais, monócitos, macrófagos e fibroblastos,
após o estímulo inflamatório16,22. Em células neoplásicas, o FT pró-coagulante produz uma cisteína proteinase que ativa diretamente o Fator X, independentemente
do Fator VII38,41,81,82.
As proteínas de coagulação do sangue desempenham pelo menos dois pa-
péis importantes na biologia tumoral. O papel pró-trombótico intravascular e extravascular, ambos levando ao depósito de fibrina; e um segundo, o de aprimoramento
das células tumorais na angiogênese, crescimento e metástase. Esta dupla função
ocorre para o FT, para o complexo de Fator VII e trombina, que se ligam e ativam
os Receptores de Protease-Ativada (PARs) em células tumorais, células endoteliais
e plaquetas64,81. As manifestações trombóticas decorrentes estão intimamente relacionadas à biologia tumoral, e tornam o paciente susceptível ao desenvolvimento
de TVP, devido ao estímulo ocasionado pelo crescimento tumoral e pelos mecanismos fisiopatológicos envolvidos na sua gênese.
Revisão da Literatura
12
A regulação da expressão de FT em células tumorais é controlada a nível
molecular por vários oncogenes, como parece ser para a ciclooxigenase-2 (COX-2),
um importante regulador da função plaquetária e do inibidor do ativador tissular do
plasminogênio do tipo 1 (PAI-1), um inibidor da fibrinólise. Além disso, a ligação de
PARs pelo FT, Fator VIIa, Fator Xa e ou trombina, já demonstraram ser importantes
para a angiogênese tumoral, crescimento e metástases64. Gordon e cols. (1981),
descreveram um pró-coagulante carcinogênico, uma protease cisteínica que ativa
diretamente o Fator X na ausência do Fator VII. Esta atividade é distinta do Fator
IXa, Fator VIIa e FT24.
As células tumorais são notórias para o desenvolvimento de bolhas nas
membranas, pelas quais se desenvolvem e derramam micropartículas, que nada
mais são que pequenas vesículas, liberadas das células após ativação ou apoptose. O FT circula na forma de micropartículas em quantidade aumentada em várias
doenças, entre elas o câncer. É interessante dizer que o FT parece predizer a
agressividade tumoral em humanos, e tem sido correlacionado, embora retrospectivamente, com o aumento da angiogênese tumoral, a taxa de crescimento rápido,
metástases e, finalmente, a propensão para o paciente desenvolver TVP24. Tem
sido sugerido que, em alguns pacientes com câncer, o tumor gera a cisteína protease, iniciando assim a coagulação do sangue. O consenso atual é que essa protease pode desempenhar um papel importante no estado pró-trombótico de algumas
neoplasias, mas ainda faltam dados para esta comprovação. O FT, um mitógeno
que age aumentando o crescimento e o potencial metastático das células tumorais,
pode influenciar a proliferação de células do tumor através de duas vias distintas.
Primeiramente, o FT inicia a coagulação do sangue conduzindo a formação de
trombina que ativa os PARs levando a uma série de efeitos pró-angiogênicos. Em
segundo, as caudas citoplasmáticas do FT têm sido relacionadas ao remodelamento vascular, angiogênese e metástases22,34,82.
Em resumo, as reações de coagulação sanguínea estão intimamente rela-
cionadas com a biologia do câncer, tornando o paciente oncológico suscetível à
trombose e estimulando os genes de crescimento tumoral, a diapedese celular, a
adesão ao endotélio, a angiogênese e a uma série de outros processos, tanto para
o crescimento do tumor primário quanto para as metástases64.
Existem ainda outros possíveis biomarcadores para o risco de trombose,
tais como: contagem elevada de plaquetas pré-quimioterapia, contagem elevada
Revisão da Literatura
13
de leucócitos pré-quimioterapia, D-dímero, FT das células tumorais, FT circulante,
P-selectina solúvel e Proteína C reativa4,34,79.
A leucocitose foi recentemente identificada como fator de risco independente
(>11.000/mm3), associada com o aumento do risco de TVP nos pacientes oncológicos em início de tratamento com quimioterapia. Além disso, a taxa de TVP em pacientes que tiveram leucocitose persistente, após o primeiro ciclo de quimioterapia,
foi significativamente superior àqueles com leucopenia. A leucocitose pode ser um
marcador de maior agressividade do câncer, não utilizado pelos tradicionais indicadores de prognóstico como estágio da doença. A contagem elevada de plaquetas
na pré-quimioterapia também foi identificada como um fator de risco para trombose
associada ao câncer16. A dosagem da Hemoglobina (<10 g/dl-1) também é considerada como um marcador biológico para o risco trombótico4,34,79.
A trombocitose foi definida como uma contagem de plaquetas igual ou supe-
rior a 350.000/mm3, e foi observada em 21,9% dos 4.405 pacientes analisados em
um estudo prospectivo no início do tratamento quimioterápico ambulatorial. Estes
pacientes apresentaram uma taxa três vezes maior de TVP. O risco elevado de
desenvolver TVP, com a contagem de plaquetas elevadas, persiste enquanto o
paciente estiver em quimioterapia16 (Quadro 2).
As interacções entre a P-selectina e as mucinas carcinomatosas circulantes
têm sido propostas como uma possível explicação para a Síndrome de Trousseau.
Entretanto, sua utilização como escore de risco ainda é limitada pela falta de disponibilidade do seu uso em amplo espectro na prática clínica34,39.
Quadro 2 - Biomarcadores para o risco de TVP
Adaptado de Khorana39
* Ainda em investigação ou não disponível livremente.
Revisão da Literatura
14
Diferentes taxas de incidência de TVP em pacientes com neoplasias são
observadas em diversos estudos, e podem ser explicadas pelas diferenças significativas no tempo de seguimento médio. Em recente análise do estudo CATS Viena,
foi avaliado o efeito da TVP no valor preditivo do escore de risco, para identificar a
progressão do câncer e morte, que foi relatada em 7%, 18% e 28% nos respectivos
grupos de escore baixo, médio e alto, do modelo de avaliação de risco desenvolvido e validado pelo grupo16,39.
Khorana desenvolveu um modelo utilizando a combinação da avaliação clí-
nica e variáveis laboratoriais para estratificar o risco trombótico39 (Tabela 1).
Tabela 1 - Modelo preditivo para o risco de TVP39
Alguns estudos apontam uma correlação entre o tratamento anticoagu-
lante e seus efeitos antineoplásicos, onde o uso de anticoagulantes tem uma
ação terapêutica adjuvante em diversos cânceres, implicando em alterações
Revisão da Literatura
15
nos prognósticos25,30,31,60,73. Outros estudos controlados e randomizados têm sido
realizados neste campo, entretanto, The Fundamental Research in Oncology and
Thrombosis (FRONTLINE) indica que existem poucas informações disponíveis sobre a magnitude do risco trombótico, e sobre as rotinas de profilaxia e tratamento de
TVP em pacientes oncológicos31. Recentemente, alguns estudos epidemiológicos
supriram estimativas quantitativas do risco e prognóstico do câncer associado à
TVP, e a diminuição da sobrevida nesse grupo de pacientes38,43.
2.2.4. Câncer ginecológico e trombose
Embora o câncer seja amplamente conhecido por aumentar o risco
de complicações tromboembólicas, o gênero feminino, em pacientes com
neoplasia, não é um fator de risco independente para a TVP59,67. Em estudos
com pacientes internadas para tratamento de tumores sólidos, evidencia-se a
ocorrência de TVP entre 7% e 11% da população48,50,54,73. O desenvolvimento
de TVP, na vigência de uma neoplasia ginecológica, parece denotar um pior
prognóstico. Nas pacientes com tumor do colo do útero, temos poucos estudos, mas os dados publicados apontam para uma elevada incidência de TVP
neste grupo, e no comprometimento da sobrevida28,29,73. Em geral, entre as
pacientes oncológicas, muitos dos fatores para tromboembolismo têm sido
identificados, incluindo a Tríade de Virchow. As condições clínicas das pacientes com neoplasias ginecológicas, submetidas a intervenções cirúrgicas,
tratamentos quimioterápicos e radioterápicos, aumentam substancialmente a
chance de desenvolverem TVP.
No estudo de Cushman e cols., 25% dos pacientes com tromboembolismo
tiveram câncer e mortalidade precoce18. Jacobson e cols. encontraram uma incidência de trombose em cerca de 16,7% das pacientes com neoplasia do colo do
útero tratadas com quimioterapia e radioterapia, desde o momento do diagnóstico
até três meses após o término do tratamento28.
A TVP, além de ser um indicador de pior prognóstico em mulheres com
câncer ginecológico, é também a manifestação do processo fisiopatológico que
contribui para a agressividade do tumor48. Segundo Morgan e cols., essa teoria
abre uma nova porta para a terapia baseada na modulação do processo trombótico. Em seu estudo, a média de sobrevida nessas pacientes, a partir do diagnóstico de TVP, foi de 7,8 meses, e somente 20% delas estavam vivas ao fim de
Revisão da Literatura
16
cinco anos. A sobrevida foi significativamente pior nas pacientes com câncer do
colo do útero e naquelas tratadas com radioterapia nos três meses seguintes ao
diagnóstico de TVP48.
2.3. MÉTODOS DE IMAGEM PARA DIAGNÓSTICO DE TROMBOEMBOLISMO
EM PACIENTES ONCOLÓGICOS
Os trombos podem desenvolver-se em estreita relação anatômica com o
órgão afetado, mas também podem ser encontrados em áreas do corpo totalmente
diferentes e imprevisíveis. O tromboembolismo representa uma complicação de
câncer avançado ou de seu tratamento. No entanto, a trombose pode também representar o primeiro sintoma de um tumor clinicamente oculto, apresentando-se
como uma síndrome paraneoplásica. Finalmente, o evento trombótico pode ser
assintomático, representando um achado acidental durante exames em pacientes
oncológicos. Neste caso, o interesse principal do radiologista é direcionado para o
processo tumoral, e complicações graves podem se desenvolver a partir do tromboembolismo esquecido. Se um paciente com suspeita de TEP tem concomitante
TVP, clinicamente aparente, o ultrassom da perna é geralmente útil no diagnóstico
devido a estreita relação entre TVP e TEP. É importante sempre contar com métodos diagnósticos que nos forneçam informações precisas e confirmação diagnóstica, preferencialmente com baixo custo, pouco invasivo e com o menor dano
possível ao paciente2.
Médicos radiologistas devem estar cientes da estrita correlação entre
câncer e trombose, particularmente por causa das consequências relevantes
para os pacientes em relação ao tratamento e prognóstico, tanto no diagnóstico
de tromboembolismo como do tumor. O ultrassom, a tomografia computadorizada com múltiplos detectores (TCMD) e outros métodos de imagem desempenham um papel central nas detecções e avaliações de TEP e da doença venosa
maligna trombótica. A aquisição rápida da imagem pelos multidetectores permite avaliar todos os vasos em seu pico, obtendo imagens de processamento
das alterações vasculares. O doppler, com suas limitações, é de baixo custo
e importante meio diagnóstico. Assim, cabe ao profissional da área escolher o
método diagnóstico mais apropriado a sua realidade, bem como estar atento as
condições clínicas do paciente, visando o diagnóstico mais preciso de TVP e
TEP2.
Revisão da Literatura
17
2.3.1. Ultrassonografia
Existem vários tipos de ultrassonografia venosa. Eles incluem ultrassono-
grafia de compressão (B-mode imaging), ultrassonografia com duplex (modo B de
imagem e análise por doppler) e doppler colorido isolado. Embora estes tipos de
ultrassonografia venosa sejam usados como sinônimos, suas sensibilidade e especificidade para a detecção de TVP aguda, nas veias dos membros inferiores,
diferem e utilizam técnicas diferentes87.
A ultrassonografia de compressão é tipicamente realizada sobre as veias
profundas proximais, especificamente as veias femorais comuns, femoral e poplítea, enquanto uma combinação de ultrassom duplex e doppler colorido é mais frequentemente utilizada para investigar as veias ilíacas87.
Há, no entanto, os fatores que influenciam a análise dos segmentos venosos
a serem avaliados em um exame individual. Estes incluem a presença de obesidade mórbida, extremidade inferior com edema ou sensibilidade aumentada, e a
presença de dispositivos de imobilização e bandagens.
A acurácia da ultrassonografia foi estabelecida como sendo de boa sensibi-
lidade e especificidade (97% e 94% respectivamente). A alta especificidade para o
diagnóstico da TVP permite que se inicie o tratamento sem mais testes confirmatórios, e sua sensibilidade elevada no diagnóstico de TVP proximal permite definir
ou não o tratamento. Em situações de incapacidade de se obter o exame ultrassonográfico, deve-se usar outros métodos de imagem para excluir o diagnóstico de
TVP, tais como: tomografia computadorizada (TC), ressonância magnética (RM) ou
ainda a venografia78,87.
Atualmente, a ultrassonografia é capaz de visualizar veias da panturrilha na
maioria dos pacientes. Um profissional bem treinado pode investigar estas veias
em 80% a 98% dos casos, usando uma combinação de modo-B, análise doppler e
doppler colorido. Rose e cols., bem como outros autores, mostraram que, em estudos tecnicamente adequados, a sensibilidade e a especificidade do doppler colorido nas veias da panturrilha isoladas foram superiores a 90%46. O doppler colorido,
quando realizado por operadores qualificados, consiste no método mais prático e
de baixo custo para avaliar TVP proximal e distal das veias dos membros inferiores.
Entretanto, o diagnóstico objetivo de TVP nem sempre é fácil46. Os resultados de
uma metanálise de estudos de ultrassonografia, para pacientes com suspeita clíni-
Revisão da Literatura
18
ca de TVP, evidenciaram que: a interpretação do radiologista, a prevalência de TVP
e a proporção de TVP proximal foram fatores significativos de sensibilidade. Em
coortes com uma maior prevalência de TVP, e grupos com maior proporção de TVP
proximal, esse tipo de exame tende a apresentar maior sensibilidade23.
A ultrassonografia venosa tornou-se a modalidade diagnóstica, invasiva ou não
invasiva, mais utilizada para o diagnóstico e exclusão de TVP aguda (Figuras 1 A e B). O
ultrassom duplex é considerado o método não invasivo primário de diagnóstico para TVP88.
Figuras 1 A e B - Exemplos de imagens do doppler de paciente com trombose em
membros inferiores (MMIIS)
2.3.2. Tomografia computadorizada (TC) de múltiplos canais
A TC apresenta um papel relevante na avaliação de vários sítios trombóticos,
e é a modalidade de imagem de escolha em pacientes com suspeita de embolia
pulmonar52,84.
Os tomógrafos de primeira geração podem falhar na detecção de um terço das
embolias pulmonares, uma vez que eles têm apenas a resolução de 5 mm. A tomografia
convencional ou axial, por ser uma técnica que não permite obter imagens de toda a árvore arterial pulmonar durante o realce máximo vascular, não é um método muito apropriado para avaliação de pacientes com suspeita de tromboembolismo pulmonar32.
Os primeiros trabalhos que relatam os resultados obtidos pela técnica de multide-
tecção, demonstram uma acurácia diagnóstica de 91%, com valores de sensibilidade e
especificidades de 100% e 89% respectivamente10,61. As vantagens da angiotomografia
estão na sua rápida aquisição da imagem, conveniência, falha no diagnóstico em menos
de 10% dos casos e por poder ser utilizada para estabelecer alternativas diagnósticas32.
Revisão da Literatura
19
Os recentes scanners multislice fornecem uma resolução de 1 mm e são mais
sensíveis para embolia subsegmentar. Entretanto, a principal desvantagem da angiotomografia computadorizada é a dose elevada de radiação. Novos tomógrafos com multidetectores permitem estudar todo o tórax, com cortes submilimétricos de 0,6-0,9 mm
de espessura em poucos segundos, obtendo-se imagens isométricas dos diferentes
planos que permitem a avaliação das artérias subsegmentares. O tempo de apneia
varia de 8-12 segundos, podendo ser reduzido ao mínimo em pacientes dispneicos2.
A verificação dos vasos no pico de realce é preferível, uma vez que uma
aquisição demasiadamente precoce ou tardia pode levar a falso-positivo ou falso-negativo. A causa de falso-negativos nas artérias centrais e segmentares está, na
maioria das vezes, ligada a erros de técnica ou de falta de colaboração do paciente
durante a realização do exame; enquanto que os falso-positivos são bem menos
frequentes e estão mais relacionados a variações anatômicas ou de patologias associadas2. Entretanto, a alta velocidade dos scanners modernos pode, paradoxalmente, representar uma limitação. A concentração do contraste iodado injetado, a
velocidade de aplicação da injeção e a sincronização para aquisição das imagens,
são fatores importantes para a aquisição de uma opacificação adequada da árvore
brônquica e da visualização do trombo2. O principal dado obtido é o reconhecimento de um defeito de enchimento dentro do lúmen vascular. Em exames sem contraste, os trombos geralmente são isoatenuantes e podem passar despercebidos.
Com contraste, a aquisição permite detectar o trombo como um defeito hipoatenuante, enchendo completamente ou parcialmente o lúmen do vaso, ou, em último
caso, como um defeito parcial envolvendo o lúmen (Figuras 2 A e B).
Figuras 2 A e B - Exemplos de cortes tomográficos obtidos após injeção de contraste em paciente com TVP (com implante de Filtro de Veia Cava − FVC)
Revisão da Literatura
20
Os trombos recentes podem flutuar dentro do lúmen, enquanto que
trombos antigos ou crônicos são aderentes às paredes dos vasos e podem
apresentar depósitos de cálcio. Desde que a parede do vaso seja suprida
por arteríolas da artéria adjacente (vasa vasorum), um aprimoramento parietal
da veia trombosada pode ser frequentemente visto. Isto aumenta as diferenças entre a parede do vaso e o não aumento do lúmen. Sinais indiretos de
trombose incluem dilatação do segmento trombosado, ectasia vascular acima
da obstrução, desenvolvimento de vias colaterais, infarto do órgão drenado e
alterações na perfusão do parênquima, devido a aumento compensatório no
fornecimento arterial (tal como a diferença de atenuação transitória hepática/
Thad)52.
Embolias pulmonares são detectadas, incidentalmente, em até 5% dos pa-
cientes com neoplasia maligna, submetidos à TC versus 1,5% da população geral2.
A TCMD é considerada atualmente como o método de escolha em radiologia para
diagnóstico de TEP. As artérias pulmonares devem ser digitalizadas utilizando um
protocolo padronizado. No paciente com câncer, uma vez que muitos casos de TEP
são combinados com TVP, o protocolo de TC pode ser estendido da artéria pulmonar aos membros inferiores (na fase de retorno venoso). Entretanto, devemos levar
em consideração a quantidade de contraste e exposição à radiação a qual submeteremos o paciente, pesando custo e benefício para utilização do método10.
2.3.3. Ressonância magnética (RM)
A RM é uma ferramenta relativamente nova no diagnóstico da TVP. A an-
giografia por RM pode substituir a angiotomografia, uma vez que ela não envolve
radiação ionizante, e os meios de contraste são mais seguros quando comparados
ao contraste iodado. A técnica se baseia em um sinal aumentado dentro do trombo, a partir do encurtamento em T1, da metemoglobina presente no trombo na fase
aguda da TVP. Em pacientes com episódio agudo e suspeição clínica de TVP, a RM
mostrou ter uma alta sensibilidade (94-96%) e especificidade (90-92%) versus venografia contrastada86.
A detecção venosa de imagens através de RM tem sido utilizada em alguns cen-
tros, e os seus valores de precisão diagnóstica para TEP mostraram que a sensibilidade
da angiorressonância magnética (ARM) foi de 85-100%, e especificidade de 95-96%.
A RM, quando comparada a TC, tem vantagens que valem a indicação para continuar
Revisão da Literatura
21
com a sua utilização e com o desenvolvimento de protocolos voltados para o diagnóstico de TVP e TEP. A RM permite a aquisição de imagens das artérias pulmonares e
de qualquer leito venoso de interesse clínico, realizadas em um único exame. Havendo
necessidade de exames evolutivos, eles podem ser realizados com segurança86.
Com o desenvolvimento de novos materiais de contraste, a RM terá maior preci-
são e aumento da sensibilidade. Mas a RM tem desvantagens quando comparada com
a TC: não é eficaz no compartimento não vascular dos pulmões, seu custo é maior, a
monitorização do paciente é mais incômoda e há necessidade de se criar técnicas e rotinas que incorporem todas as suas vantagens potenciais. Muitos recursos do método
ainda não foram desenvolvidos e testados. Assim, na maioria dos centros radiológicos,
a TC helicoidal ainda é uma opção realista para o manejo clínico de pacientes com
suspeita de TEP, enquanto que a aplicação clínica da RM é limitada a centros com
experiência em RM. No entanto, a RM tem um número de características fundamentais que a tornam potencialmente ideal para a avaliação de pacientes com suspeita de
trombose venosa aguda, e na investigação clínica adicional com angiorressonância76.
2.3.4. Cintilografia de ventilação e perfusão
A cintilografia pulmonar de ventilação e perfusão é um método não invasivo
de alta probabilidade diagnóstica, e também de grande probabilidade de exclusão
das doenças tromboembólicas de consequências clínicas relevantes2.
Na cintilografia de perfusão, o radiofármaco utilizado é o MAA-Tc 99m (ma-
croagregados de albumina marcados com Tc 99m), na dose de 5mCi. O tamanho
das partículas varia de 10 a 90 microns, e cada dose de 5mCi contém em média
500.000 partículas. Após a injeção, estas partículas ocluem temporariamente as
arteríolas pulmonares, sendo, posteriormente, fagocitadas pelo sistema retículoendotelial2.
Na técnica de ventilação, o radiofármaco utilizado pode ser um gás (Xe-133,
Xe, 127, Kr-81m) ou o aerossol (DTPA-Tc 99m), sendo este o mais usado no Brasil.
Uma dose de 30mCi de DTPA-Tc 99m, em 3 ml de soro fisiológico, administrada
através de um nebulizador, fornece aos pulmões uma dose de 500 a 750uCi. Esta
dose permite tomar uma imagem de 100.000 contagens em 2 minutos em uma
gama câmera padrão com colimador de baixa energia. A ventilação informa sobre
a distribuição relativa do ar nos pulmões e evidencia os setores que apresentam
Revisão da Literatura
22
alterações nos níveis de ventilação. Uma vez finalizado o exame, se obtém imagens com a câmara gama em posições anterior, posterior e obliqua, ou eventualmente em cortes tomográficos Single Photon Emission Computed Tomography
(SPECT)2.
2.3.5. Flebografia radiológica com contraste
A imagem radiográfica da TVP, usando meios de contraste intravenoso, ain-
da é o padrão ouro, sobretudo quando se trata das veias das panturrilhas e região
pélvica. Dois diferentes métodos, a venografia de Rabinov-Paulin (o “clássico”)
e a venografia de perna inteira, permitem visualizar alterações estruturais no
sistema venoso profundo e superficial, a presença de trombos ou outras oclusões, as veias recanalizadas (grau de recanalização), a presença de obstrução
venosa proximal e as veias colaterais. Diante de uma insuperável visualização
da árvore venosa profunda dos membros inferiores, desde a parte mais distal
até a ilíaca comum e externa, o método permite que a TVP seja diagnosticada
com exatidão, quando defeitos intraluminais de enchimento são detectados em
mais de uma projeção. Atualmente, são fatores limitantes de sua utilização:
a radiação, os meios de contraste, a injeção dolorosa nas veias pediosas, as
flebites e o risco de complicações per e pós-procedimento. A venografia não
pode ser realizada em cerca de 20% dos pacientes, e a indução de TVP por
venografia tem sido descrita, apesar dos meios de contrastes modernos serem
menos trombogênicos2,7,49.
Em um estudo de revisão, autores concluíram que na maioria dos pa-
cientes com suspeita de TVP havia a possibilidade de se realizar a investigação com testes não invasivos. A venografia foi recomendada nos pacientes
cujos resultados dos testes não invasivos não diagnosticaram TVP, ou quando
ocorreu discordância com a avaliação clínica (por exemplo, ultrassonografia
de compressão negativa e alta suspeita clínica)23. A flebografia, quando bem
executada, permite a visualização total do sistema venoso dos membros, confirmando a presença de trombos e fornecendo informações sobre o local e a
extensão deles17.
Para o diagnóstico de TEP, temos a angiografia pulmonar contrastada
como teste padrão tradicional de referência para o diagnóstico de embolia pulmonar, mas raramente é utilizado (é invasivo e requer um elevado nível de
Revisão da Literatura
23
perícia). Já a cintilografia de ventilação e perfusão (V / Q) sugere o diagnóstico
de TEP de acordo com as características de V / Q, e exclui o diagnóstico se a
verificação é normal. Entretanto, alguns pacientes têm diagnósticos indeterminados, o que exige uma avaliação mais aprofundada com método de imagem
pela angiotomografia pulmonar ou angiografia por RM. Algumas enfermidades
pulmonares podem ocasionar defeitos na ventilação/perfusão, que dificultam
o diagnóstico. Assim, melhorias no método de ventilação/perfusão com a
adição de imagens com cortes SPECT possibilitariam a análise das imagens
em formato tridimensional, aumentando a sensibilidade e especificidade da
cintilografia2,42.
2.3.6. Abordagens combinadas no diagnóstico de TVP
Recentemente, a abordagem algorítmica, usando uma combinação de
avaliação clínica, medidas de D-dímero e ultrassonografia, foi adotada na prática clínica, com os objetivos de padronizar a abordagem diagnóstica para a TVP
e reduzir os números de exames de ultrassonografia realizados com laudos
negativos em pacientes com forte suspeita de TVP32,78.
A utilidade dos algoritmos para o diagnóstico de TVP, no entanto, depen-
de da disponibilidade de testes de diagnóstico, a experiência dos técnicos que
executam os exames de ultrassonografia, a população de pacientes, o custo da
utilização de inúmeros métodos e da interpretação dos resultados. O que pode
ser viável para uma instituição pode não ser aplicável à outra, e cada grupo
deverá determinar a sua própria abordagem com alguma validação objetiva.
Por exemplo, uma estratégia que utiliza a venografia para diagnóstico da TVP
é inútil para instituições onde a venografia não está mais disponível. Embora
os algoritmos ofereçam múltiplas estratégias para melhorar o processo de diagnóstico da TVP, ainda faltam evidências sobre a validade e segurança destes
algoritmos66. Modelos clínicos para padronizar a avaliação de pacientes que se
apresentam com suspeita de TVP têm sido utilizados na investigação da doença, mas não na prática clínica de rotina.
Revisão da Literatura
24
Podemos afirmar que o doppler venoso proximal e distal é o padrão
atual para a avaliação clínica de rotina para pesquisa de TVP nas extremidades
inferiores. Outros testes invasivos e não invasivos também são ocasionalmente indicados na avaliação de uma possível TVP, principalmente em cenários
clínicos onde a ultrassonografia venosa seja tecnicamente inadequada ou não
possa fornecer informações adequadas. Os algoritmos para o diagnóstico de
TVP e TEP, combinando estratégias e empregando testes adjuntos, como a
estratificação de risco clínico e aferição do dímero-D para limitar o número de
exames de doppler negativos, têm um grande potencial, mas requerem que a
segurança do algoritmo seja comprovada com validação local no serviço ou na
instituição. O doppler venoso pode, em alguns casos, ser útil como um adjuvante para o diagnóstico de TEP, mas, na maioria dos casos, outras técnicas mais
modernas permitem um diagnóstico mais eficiente e objetivo.
2.4. CONSIDERAÇÕES SOBRE TROMBOSE E OS MÉTODOS DE DIAGNÓSTICO
POR IMAGEM
Distinguir a trombose benigna da neoplásica é fundamental, devido as dife-
renças no prognóstico. Os trombos ‘benignos’ são homogêneos e não impregnam
após a injeção de contraste, aparecendo como marcadamente hipoatenuantes. Os
trombos ‘malignos’ são devidos ao crescimento progressivo endoluminal de um
tumor, geralmente vistos em contiguidade direta com sua massa e aderência às paredes dos vasos. O segmento venoso envolvido é frequentemente dilatado e veias
colaterais são comuns52.
Diferentemente do doppler colorido e da flebografia convencional, que são
estudos dinâmicos, a TCMD ainda permanece como uma ferramenta estática, mesmo se os protocolos de aquisição multifásicos são empregados e comparados com
o doppler colorido. A TCMD tem a vantagem de uma cobertura ampla, com possibilidade de incluir o tórax, abdômen e as extremidades inferiores em uma única
aquisição. O uso de radiações e sua contraindicação, devida aos níveis séricos
elevados de creatinina, devem sempre ser mantidos em mente. O doppler colorido,
embora tenha a vantagem de não exigir o uso de meios de contraste e poder ser
realizado a beira do leito, é um exame mais demorado e operador dependente. No
Revisão da Literatura
25
entanto, o papel do doppler colorido é limitado, principalmente às extremidades do
corpo, dado que muitas veias abdominopélvicas e do tórax são pouco ou inacessíveis a ultrassonografia. Sobre a flebografia convencional, esta perdeu parte de
seu papel diagnóstico e é empregada principalmente para orientar procedimentos
intervencionistas87.
A venografia já é aceita como padrão de precisão para diagnosticar TVP,
mas ainda tem indicações limitadas em alguns casos. Devido à sua natureza invasiva, dificuldade técnica e custo, a venografia não é adequada para a rotina de
avaliação clínica da TVP2.
Conclui-se que, a doença tromboembólica venosa pode ter diversas loca-
lizações e apresentações clínicas em pacientes com câncer, ameaçando-os com
eventos tromboembólicos maiores e, consequentemente, retardo no tratamento e
impacto no prognóstico. Os profissionais devem ter sempre em mente a íntima
relação entre trombose e câncer, estando sempre atentos a possibilidade de existir
um trombo oculto.
26
3. PACIENTES, MATERIAL E MÉTODO
3.1. ASPECTOS ÉTICOS
O presente estudo foi submetido ao Comitê de Ética e Pesquisa (CEP) do
INCA, tendo sido aprovado e registrado em novembro de 2007: registro número
089/2007.
Trata-se de um estudo de coorte ambidirecional, com inclusão de pa-
cientes com diagnóstico histopatológico de tumor do colo do útero, que apresentam estádio IIIB da FIGO21, com idade igual ou superior a 20 anos, matriculadas e tratadas no INCA no período de 01/01/2000 à 31/12/2004, com
quimioterapia, radioterapia e braquiterapia. Analisamos a evolução clínica do
grupo de pacientes através da descrição da sobrevida em função do diagnóstico de TVP.
Foram excluídas do estudo, as pacientes que não permaneceram no Institu-
to e foram encaminhadas para tratamento em outros serviços da rede do Sistema
Único de Saúde (SUS).
3.2. PACIENTES
Foram identificadas 1.277 pacientes com diagnóstico de câncer do colo
do útero no estádio IIIB. Destas, 1.037 permaneceram no Instituto para tratamento, das quais duas foram excluídas após revisão anátomo-histológica, por
não se tratar de tumor do colo do útero, e 15 foram excluídas do estudo por
terem sido encaminhadas para outros serviços da rede do SUS, para complementação de tratamento ou seguimento. Restaram 1.020 pacientes para serem
avaliadas neste estudo (Figura 3). As pacientes identificadas no período descrito acima foram acompanhadas até dezembro de 2007, e o tempo de observação foi de 36 meses de seguimento.
Pacientes, Material e Método
27
Figura 3 - Fluxograma demonstrativo da identificação e inclusão de pacientes
3.3. MÉTODO
Os dados foram obtidos através do Registro Hospitalar de Câncer (RHC) do
HC II/INCA/MS, que armazena informações sobre todos os pacientes tratados e em
acompanhamento no INCA. O RHC contém sobre o tratamento e outras informações
sobre o tipo histológico, a data de matrícula na instituição, a idade e data de óbito (se
ocorrido). Os prontuários eletrônicos das pacientes incluídas foram consultados para
obtenção de informações sobre o seguimento de tratamento dos grupos com e sem
TVP. Foram coletados: a data da última consulta, o método diagnóstico da TVP, data da
TVP e o tempo de sobrevida após o episódio de TVP. Não foram analisados outros fatores passíveis de acarretar TVP, como as trombofilias, a Hipertensão Arterial Sistêmica
(HAS), a dislipidemia e o tabagismo, devido à impossibilidade de obter tais informações
nos bancos de dados consultados.
Foi realizada busca ativa das pacientes que não compareceram mais ao
INCA, para saber o status em que se encontravam por ocasião do estudo. Esta
busca ativa é uma conduta de rotina do RHC, que tem como função acompanhar o
Pacientes, Material e Método
28
estado vital do paciente. Caso ocorra ausência de um paciente às consultas de seguimento, ela é identificada e investigada se ocorreu falha na notificação do óbito.
Busca-se informações através do contato telefônico ou de telegrama aos familiares
sobre as condições clínicas, óbito ou não óbito dos pacientes, a fim de manter o
banco de dados atualizado.
3.4. DIAGNÓSTICO DA TVP
Eventos tromboembólicos foram definidos como: embolia pulmonar, TVP e
tromboses arteriais. Estes foram confirmados por revisão dos prontuários e exames
radiológicos positivos para trombose.
A data de realização do exame foi considerada como a data do diagnóstico
de trombose. O exame complementar considerado padrão em nosso estudo foi a
ultrassonografia venosa com doppler87. Outros métodos de imagem utilizados foram
a TC ou angiotomografia, realizados nos pacientes com suspeição de tromboembolismo pulmonar.
3.5. ANÁLISE DE SOBREVIDA
As pacientes foram acompanhadas desde o momento da matrícula no INCA
até a data do óbito ou da última consulta, durante o seguimento de levantamento
dos dados (até 31/12/2007). As análises estatísticas incluíram o teste qui-quadrado
de Pearson, e para a análise de sobrevida foram utilizados o método de Kaplan-Meyer e o teste log-rank, para comparar as curvas de sobrevivência acumuladas
entre as categorias. A análise multivariada foi realizada utilizando o modelo de riscos proporcionais de Cox (IC 95%) para avaliar o efeito das demais variáveis na
sobrevida.
29
4. RESULTADOS
O gráfico da Figura 4 mostra a curva de sobrevida de pacientes com e sem TVP,
e em ambos os grupos ela permanece idêntica até o vigésimo mês de seguimento. A
partir deste momento, observa-se que o grupo com TVP apresentou uma maior mortalidade quando comparado ao grupo sem o evento trombótico. É possível verificar que
a mediana de sobrevida foi de 20,4 meses (1,7 anos) e a média de sobrevida foi de
26,1 meses (2,2 anos) no grupo com TVP (Anexo ii). O teste de log-rank resultou em
p=0,0217, demonstrando uma nítida diferença entre os grupos com e sem TVP.
Figura 4 - Curva de sobrevida das pacientes do estudo, obtida pelo método de
Kaplan Meyer
Ao longo do período de acompanhamento foram observados 678 óbitos.
A cada ano a taxa de mortalidade foi de 13 óbitos por 100 pessoas-ano. Entretanto, esta taxa não foi homogênea ao longo do tempo, havendo uma associação
do tempo decorrido desde o diagnóstico com recidiva de doença. A média e a
mediana do fator idade entre os grupos com e sem TVP não foram estatisticamente significativas, caracterizando a distribuição homogênea dos subgrupos. Em
relação aos tipos histológicos ocorreu significância no subgrupo de pacientes com
o tipo histológico epidermóide. Entretanto, devido ao n pequeno distribuído pelos
demais tipos histológicos, não se podem fazer outras considerações. Quanto ao
Resultados
30
evento TVP, este foi notadamente um fator de mau prognóstico, e levou ao óbito de 83,8% das pacientes acometidas. Dados demográficos mais detalhados,
com a média de idade e o tipo histológico, podem ser observados na Tabela 2.
Tabela 2 - Dados epidemiológicos de pacientes com e sem TVP (n = 1020)*
A cada morte ocorrida na população do estudo (678 óbitos no período de
análise), buscou-se identificar sua causa através da consulta ao prontuário ou
atestado de óbito, e analisar sua correlação com a TVP ou atividade da neoplasia.
Foi identificada a presença de recidiva da doença, ou ainda uma progressão da
mesma, nas pacientes que ainda não se encontravam em remissão da neoplasia
na maioria dos casos. Em ambos os grupos, a insuficiência renal secundária à
invasão tumoral (insuficiência renal pós-renal) foi a causa de óbito em cerca de 6%
das pacientes.
Na Tabela 3, demonstramos a associação entre os tipos histológicos,
tromboembolismo e óbito, e podemos observar que ocorreu uma maior inci-
Resultados
31
dência de tromboembolismo nas pacientes com carcinoma epidermóide do colo
do útero, a despeito deste tipo histológico ser o mais prevalente. Outros tipos
histológicos incluídos foram: carcinossarcoma (3), carcinoma seroso papilar (1),
melanoma (3), carcinoma indiferenciado (5) e carcinoma de pequenas células (2).
Tabela 3 - Distribuição dos casos por tipos histológicos, tromboembolismo e óbito
* A associação de variáveis foi analisada pelo teste do qui-quadrado. As decisões estatísticas foram tomadas
ao nível de significância de 0,05, e para a análise estatística foi utilizado o software Statistic Package for
Social Sciences (SPSS).
** Percentual por subgrupo.
O Modelo de Cox foi utilizado na análise dos dados provenientes do tempo
de vida até a ocorrência do evento de interesse, em função de possíveis confundidores da relação entre a TVP e o óbito.
Dos fatores testados na análise univariada, aquela que teve impacto esta-
tisticamente significante na sobrevida foi a ocorrência de TVP (p=0,0224). As características identificadas na análise univariada foram então submetidas à análise
multivariada, sendo evidenciado que a variável TVP (p=0,023) representou um fator
de pior prognóstico relacionado à sobrevida (Tabela 4).
Resultados
32
Tabela 4 - Análises uni e multivariada para os fatores idade, tipo histológico e TVP
Foi observado que não houve associação entre o tipo histológico e a idade,
somente em relação ao tipo histológico adenoescamoso e TVP. Entretanto, não
houve correlação entre o tipo histológico adenoescamoso e óbito, não parecendo
ser uma fonte de confundimento.
33
5. DISCUSSÃO
Pacientes com câncer são mais acometidos de TVP que os pacientes sem
neoplasia43,55,60. Os pacientes oncológicos apresentam um risco trombótico independente de outros fatores, o que acarreta em maior morbidade e mortalidade.
As alterações hemostáticas são frequentes e acarretam um estado de hipercoagulabilidade. Elementos da cascata de coagulação, inlcuindo o FT, trombina e
fibrinogênio podem aumentar o crescimento do tumor, metástases e angiogênese.
Tem sido observado que até 95% dos pacientes com câncer apresentam testes de
coagulação anormais29. Estas alterações propiciam o tromboembolismo e o risco
de falha na terapia antitrombótica41,55. O impacto que a trombose pode ter no curso
da doença é indiscutível, pela redução da sobrevida nos pacientes oncológicos e
que desenvolveram um primeiro episódio trombótico25,60,74,86.
Embora Tateo e cols.80 tenham encontrado um maior risco trombótico nas
pacientes com índice de massa corporal (IMC) elevado e idade avançada, seu
estudo trata de um outro tipo tumoral, com comportamento diferente do tumor do
colo do útero. Baseado no estudo de Jacobson e cols.29, que não encontraram
uma associação significativa entre os fatores tabagismo e obesidade com o risco
de TVP, optamos no desenho deste estudo por não levar em consideração estes dois
fatores, e avaliar somente a idade e o tipo histológico na população incluída.
O câncer do colo do útero, assim como outros tumores, pode produzir com-
postos pró-trombóticos que são independentes da carga tumoral. Entretanto, essa
neoplasia apresenta fatores trombóticos associados que podem agir independentemente e predispor ao desenvolvimento de TVP29. A Tríade de Virchow pode ser
desencadeada pelas condições anatômicas em que as pacientes se encontram,
como no caso do linfedema crônico, após serem submetidas ao tratamento radioterápico e à quimioterapia. Outros fatores decorrentes do estágio da doença e evolução clínica da paciente contribuem para o aparecimento de eventos trombóticos.
Sabe-se que o estadiamento da doença, no momento do diagnóstico, é um fator
determinante na sobrevida das pacientes. Há uma associação entre os estágios
mais avançados e a ocorrência de TVP, bem como uma diferença significativa na
sobrevida entre os grupos com e sem TVP29.
Discussão
34
O câncer do colo do útero foi escolhido por se tratar de uma neoplasia de
alta prevalência em países em desenvolvimento, como no caso do Brasil, e dentre
as neoplasias ginecológicas, o tromboembolismo ser muito frequente. Por se tratar
de uma doença curável quando detectada precocemente, uma política de saúde
adequada e de fácil acesso permitiria que esse tipo de câncer fosse detectado e
tratado sem causar tamanho ônus aos sistemas de saúde e às pacientes, como já
acontece atualmente nos países com um sistema de saúde eficaz.
A escolha do estágio IIIB (FIGO), para a seleção da amostra no estudo,
decorreu do fato de que um grande número de pacientes em estágios avançados
chega ao INCA em busca de tratamento. Assim, ao realizar um estudo de prognóstico em pacientes com neoplasia do colo do útero em estágio IIIB, foi levada
em consideração uma situação que faz parte do cotidiano no Instituto. Como
o tromboembolismo é uma das causas de óbito nessa população, buscou-se
conhecer como evoluem as pacientes tratadas no HC II.
As pacientes incluídas no presente estudo foram aquelas matriculadas no
HC II, no período entre janeiro de 2000 a dezembro de 2004, que preencheram os
critérios de inclusão. O acompanhamento dessas pacientes foi realizado por um
período mínimo de 36 meses, tempo o qual se presume como um período longo o
suficiente para que todas apresentassem o desfecho do estudo48,74. Na pesquisa
direta aos prontuários eletrônicos, foi observado que o exame complementar considerado padrão no diagnóstico de TVP, nas pacientes do estudo, foi a ultrassonografia venosa com doppler, que é considerada um teste diagnóstico de grande acurácia87. Muito embora alguns casos fossem diagnosticados pela angiotomografia e
ecocardiografia, o exame de rotina no HC II para a confirmação do diagnóstico de
TVP é a ultrassonografia. A facilidade de marcação e execução do método, bem
como os profissionais altamente treinados para esse diagnóstico, aumentam
significativamente a sensibilidade e especificidade do exame, minimizando assim a
necessidade de confirmação diagnóstica por outros métodos de imagem.
Entretanto, por se tratar de uma coorte retrospectiva e prospectiva, adequa-
da para estudos de prognóstico, algumas limitações são inerentes ao seu desenho
metodológico. Sabe-se que nos estudos observacionais ocorre um número maior
de viéses ou erros sistemáticos quando comparados aos experimentais, uma vez
que não se controla diretamente a exposição ao fator de interesse, no caso a TVP e
óbito. Outra limitação encontrada foi não haver informações disponíveis na maioria
Discussão
35
dos prontuários sobre outros fatores que pudessem estar relacionados ao evento
de TVP, tais como: hipertensão, tabagismo, obesidade e trombofilia. Testes laboratoriais específicos para diagnóstico de TVP não foram realizados na grande maioria
dos casos, restringindo-se o diagnóstico aos exames clínico e de imagem. Ocorre
ainda que, pacientes podem ter apresentado o evento trombótico e não ter sido registrado no prontuário eletrônico. De qualquer forma, supõe-se que essa perda não
interferiu nos resultados encontrados. Cushman e cols.18 afirmam que as taxas de
incidência geralmente são subestimadas neste desenho de estudo, sem comprometer o resultado final.
O teste de log-rank resultou em p=0,0217, demonstrando uma nítida dife-
rença entre os grupos com e sem TVP. A incidência de TVP foi de 7,3% na população de estudo. Uma vez analisados os subgrupos de pacientes com e sem
TVP, parece que a presença de TVP teve um efeito negativo substancial na sobrevida. Jacobson e cols. encontraram em seu estudo com pacientes acometidas por tumor do colo do útero uma incidência significativa de tromboembolismo,
e uma diminuição na sobrevida daquelas pacientes que apresentaram o evento
de TVP ao longo de sua evolução clínica. Eles encontraram uma incidência de
TVP em 11,7% da população estudada, entretanto, sua amostra era composta
de pacientes em estágios e momentos diferentes da evolução da doença29. A
extensão do tumor que se espalha pelo paramétrio e sua proximidade com as
veias pélvicas levam à compressão vascular e estase, e propiciam o surgimento
de eventos trombóticos mais frequentes, pois sabe-se que o aumento do estágio
clínico, em razão direta, agrava o risco de eventos tromboembólicos.
O fator idade não pareceu influenciar na ocorrência de TVP, de acordo
com a análise multivariada que utilizou o modelo de Cox. Em ambos os grupos
a distribuição etária foi similar e sem significância estatística entre eles.
Em relação aos vários tipos histológicos, sabe-se que a morfologia do
tumor é também um fator importante, pois esses apresentam comportamento variado em um mesmo estadiamento. Apesar do tipo adenocarcinoma apresentar
um pior prognóstico comparado ao tipo histológico epidermóide29, não foi encontrada significância estatística entre os subtipos na população de estudo. Provavelmente pelo fato do número de pacientes acometidas pelo tipo epidermóide ser
altamente representativo na amostra, quando comparado aos outros tipos.
Os resultados assemelham-se aos do estudo FRONTLINE, que apontam
para o desenvolvimento de TVP associado a um pior prognóstico. Os autores
Discussão
36
desse estudo identificaram na população que desenvolveu TVP associada à
malignidade um risco três vezes maior de tromboembolismo recorrente e morte,
quando comparado aos pacientes sem neoplasia31.
Nas pacientes que foram acompanhadas no presente estudo, foi identi-
ficado no grupo com TVP que a trombose ocorreu principalmente no momento
em que elas se encontravam em seguimento depois do tratamento do câncer,
em torno de 20 meses após o início do tratamento, e que a TVP foi um sinal prévio ao diagnóstico de recidiva ou progressão da doença. Em algumas mulheres,
foi a primeira manifestação da doença. Outras causas de óbito na população do
estudo foram: sépsis e complicações decorrentes da insuficiência renal crônica.
Jacobson e cols. sugerem que a morte nessas pacientes está relacionada ao
câncer com comportamento mais agressivo, ao invés do evento de TVP. Isso sugere
que a TVP é um evento prognóstico adverso podendo estar relacionado com a biologia tumoral mais agressiva29. Chew e cols. ressaltam que o aparecimento da TVP é
um preditor significativo de morte em pacientes com doença localizada e metastática12. Morgan e cols. concluíram em seu estudo que o tromboembolismo venoso não
foi apenas um indicador de mau prognóstico nas pacientes com câncer ginecológico,
mas também a manifestação de um processo fisiopatológico que contribuiu para a
agressividade do câncer em sua amostra48. Na evolução da doença, o tromboembolismo surge como um fator de risco significativo e de impacto na sobrevida5.
A sobrevida das pacientes com diagnóstico de câncer do colo do útero no
estágio IIIB, que desenvolvem TVP, é significativamente pior quando comparada ao
grupo sem episódios de TVP5,12,29,48.
É possível afirmar que o tromboembolismo, nas pacientes com neoplasia do
colo do útero (acompanhadas durante o estudo), foi um fator de pior prognóstico,
acarretando maior mortalidade. O momento em que ocorreram os eventos trombóticos encontrou-se intimamente ligado à recidiva ou ainda com a progressão da
doença nas pacientes com tumores mais agressivos, acarretando uma piora da performance status e morte.
Durante o decorrer deste estudo, um grupo de trabalho multidisciplinar foi cria-
do para atender às pacientes com TVP, sendo estabelecido um fluxograma de atendimento, e rotinas de profilaxia e tratamento das pacientes internadas e em acompanhamento ambulatorial. Buscou-se identificar casos de tromboses recorrentes, bem
como de recidivas tumorais e progressão da doença, que têm sido achados comuns
durante o seguimento das pacientes com TVP em tratamento com anticoagulantes.
37
6. CONCLUSÃO
• A sobrevida de mulheres com câncer do colo do útero em estágio IIIB
foi menor no grupo que apresentou TVP, considerada um fator de pior
prognóstico.
• A incidência de TVP foi de 7,3% na população do estudo.
• A análise da curva de sobrevida mostra uma maior incidência de TVP
a partir do vigésimo mês após a matrícula no INCA. Observou-se que
83,79% das pacientes com TVP evoluíram para óbito em três anos de
seguimento.
• A TVP foi associada ao diagnóstico de recidiva ou progressão da doença,
sendo considerada um marcador de menor sobrevida (óbito). Na maioria
dos casos, a TVP ocorreu após o término da quimioterapia, radioterapia
e braquiterapia, quando os pacientes já se encontravam em acompanhamento clínico.
38
REFERÊNCIAS BIBLIOGRÁFICAS
1. Alcalay A, Wun T, Khatri V, Chew HK, Harvey D, Zhou H, et al. Venous
thromboembolism in patients with colorectal cancer: incidence and effect on
survival. J Clin Oncol. 2006;24:1112-8.
2. Altman R, Herrera RN. Trombosis: fisiologia, mecanismos de enfermedad y
tratamiento. Buenos Aires: Edimed; 2008. v. 3.
3. Anderson Jr FA, Wheeler HB. Venous thromboembolism: risk factors and
prophylaxis. Clin Chest Med. 1995;16:235-51.
4. Ay C, Simanek R, Vormittag R, Dunkler D, Alguel G, Koder S, et al. High plasma
levels of soluble P-selectin are predictive of venous thromboembolism in cancer
patients: results from the Vienna Cancer and Thrombosis Study (CATS). Blood.
2008;112:2703-8.
5. Barbera L, Thomas G. Venous thromboembolism in cervical cancer. Lancet
Oncol. 2008;9:54-60.
6. Baron JA, Gridley G, Weiderpass E, Nyrén O, Linet M. Venous thromboembolism
and cancer. Lancet. 1998;351:1077-80.
7. Beyer J, Schellong S. Deep vein thrombosis: current diagnostic strategy. Eur J
Int Med. 2005;16:238-46.
8. Blom JW, Doggen CJ, Osanto S, Rosendaal FR. Malignancies, prothrombotic
mutations, and the risk of venous thrombosis. JAMA. 2005;293:715-22.
9. Blom JW, Vanderschoot JP, Oostindiër MJ, Osanto S, van der Meer
FJ, Rosendaal FR. Incidence of venous thrombosis in a large cohort of
66.329 cancer patients: results of a record linkage study. J Thromb Haemost.
2006;4:529-35.
10.Blum AG, Delfau F, Grignon B, Beurrier D, Chabot F, Claudon M, et al. Spiralcomputed tomography versus pulmonary angiography in the diagnosis of acute
massive pulmonary embolism. Am J Cardiol. 1994;74:96-8.
11.Chan PG, Sung HY, Sawaya GF. Changes in cervical cancer incidence after
three decades of screening US women less than 30 years old. Obstet Gynecol.
2003;102:765-73.
12.Chew HK, Davies AM, Wun T, Harvey D, Zhou H, White RH. The incidence of
venous thromboembolism among patients with primary lung cancer. J Thromb
Haemost. 2008;6:601-8.
Referências Bibliográficas
39
13.Chew HK, Wun T, Harvey DJ, Zhou H, White RH. Incidence of venous
thromboembolism and the impact on survival in breast cancer patients. J Clin
Oncol. 2007;25:70-6.
14.Chung I, Lip GYH. Virchow’s triad revisited: blood constituents. Pathophysiol.
Haemost Thromb. 2003/2004;33:449-54.
15.Cogo A, Bernardi E, Prandoni P, Girolami B, Noventa F, Simioni P,
et al. Acquired risk factors for deep-vein thrombosis in symptomatic outpatients.
Arch Intern Med. 1994;154:164-8.
16.Connolly GC, Khorana AA. Emerging risk stratification approaches to cancerassociated thrombosis: risk factors, biomarkers and a risk score. Thromb Res.
2010;125 Suppl 2:S1-7.
17.Cook D, McMullin J, Hodder R, Heule M, Pinilla J, Dodek P, et al; Canadian
ICU Directors Group. Prevention and diagnosis of venous thromboembolism in
critically ill patients: a Canadian survey. Crit Care. 2001;5:336-42.
18.Cushman M, Tsai A, Heckbert SR, White R. Incidence rates, case fatality, and
recurrence rates of deep vein thrombosis and pulmonary embolus: the longitudinal
investigation of thromboembolism etiology (LITE) [abstract]. Thromb Haemost.
2001;86 Suppl 1:OC2349.
19.Dvorak HF, Rickles FR. Malignancy and hemostasis. In: Colman RW, Hirsh J, Marder
VJ, Clowes AW, George JN, editors. Hemostasis and thrombosis: basic principles and
clinical practice. 5th ed. Philadelphia: Lippincott-Raven; 2006; 851-73.
20.Falanga A, Rickles FR. The pathogenesis of thrombosis in cancer. N Oncol
Thromb. 2005;1:9-16.
21.FIGO Committee on Gynecologic Oncology. Revised FIGO staging
for carcinoma of the vulva, cervix, and endometrium. Int J Gynecol
Obstet. 2009 [citado em 25 jan 2010];105:103-4. Disponível em:
http://www.bgcs.org.uk/
22.Furie B, Furie BC.
Dis. 2006;36:177-81.
Cancer-associated
thrombosis.
Blood
Cells
Mol
23.Goodacre S, Sampson F, Stevenson M, Wailoo A, Sutton A, Thomas S, et al.
Measurement of the clinical and cost-effectiveness of non-invasive diagnostic
testing strategies for deep vein thrombosis. Health Technol Assess. 2006;10:1168, iii-iv.
24.Gordon SG, Cross BA. A factor X-activating
malignant tissue. J Clin Invest. 1981;67:1665-71.
cysteine
protease
Referências Bibliográficas
40
25.Hejna M, Raderer M, Zielinski CC. Inhibition of metastases by anticoagulants.
J Natl Cancer Inst. 1999 [citado em 25 jan 2010];91:22-36. Disponível em:
http://jnci.oxfordjournals.org/cgi/content/full/91/1/22
26.Instituto Nacional de Câncer, Coordenação de Prevenção e Vigilância. Estimativa
2012: incidência de câncer no Brasil. Rio de Janeiro: INCA; 2011.
27.Instituto Nacional de Câncer, Coordenação de Prevenção e Vigilância. Falando
sobre câncer do colo do útero. Rio de Janeiro: INCA; 2000.
28.Jacobson GM, Kamath RS, Smith BJ, Goodheart MJ. Thromboembolic events in
patients treated with definitive chemotherapy and radiation therapy for invasive
cervical cancer. Gynecol Oncol. 2005;96:470-4.
29.Jacobson GM, Lammli J, Zamba G, Hua L, Goodheart MJ. Thromboembolic
events in patients with cervical carcinoma: incidence and effect on survival.
Gynecol Oncol. 2009;113:240-4.
30.Kakkar A, Hedges R, Williamson R, Kakkar V. Perioperative heparin-therapy
inhibits late death from metastatic cancer. Int J Oncol. 1995;6:885-8.
31.Kakkar AK, Levine M, Pinedo HM, Wolff R, Wong J. Venous
thrombosis in cancer patients: insights from the frontline survey.
Oncologist. 2003 [citado em 25 jan 2010];8:381-8. Disponível em:
http://theoncologist.alphamedpress.org/cgi/content/full/8/4/381
32.Kälebo P, Wallin J. Computed tomography
embolism. Acta Radiol. 1989;30:105-7.
in
massive
pulmonary
33.Khorana AA, Ahrendt SA, Ryan CK, Francis CW, Hruban RH, Hu YC, et
al. Tissue factor expression, angiogenesis and thrombosis in pancreatic cancer.
Clin Cancer Res. 2007;13:2870-5.
34.Khorana AA, Connolly GC. Assessing risk of venous thromboembolism in the
patient with cancer. J Clin Oncol. 2009;27:4839-47.
35.Khorana AA, Francis CW, Culakova E, Kuderer NM, Lyman GH. Thromboembolism
is a leading cause of death in cancer patients receiving outpatient chemotherapy.
J Thromb Haemost. 2007;5:632-4.
36.Khorana AA, Francis CW, Culakova E, Lyman GH. Risk factors for chemotherapyassociated venous thromboembolism in a prospective observational study.
Cancer. 2005;104:2822-9.
37.Khorana AA, Rao MV. Approaches to risk-stratifying cancer patients for venous
thromboembolism. Thromb Res. 2007;120 Suppl 2:S41-50.
38.Khorana AA. Cancer and thrombosis: implications of published guidelines for
clinical practice. Ann Oncol. 2009;20:1619-30.
Referências Bibliográficas
41
39.Khorana AA. Risk assessment for cancer-associated thrombosis: What is the
best approach? Thromb Res. 2012;129 Suppl 1:S10-5.
40.Lee AY, Levine MN. The thrombophilic state induced by therapeutic agents in the
cancer patient. Semin Thromb Hemost. 1999;25:137-45.
41.Lee AYY. Epidemiology and management of venous thromboembolism in patients
with cancer. Thromb Res. 2003;110:167-72.
42.Lee CH, Hankey GJ, Ho WK, Eikelboom JW. Venous thromboembolism: diagnosis
and management of pulmonary embolism. Med J Aust. 2005;182:569-74.
43.Levitan N, Dowlati A, Remick SC, Tahsildar HI, Sivinski LD, Beyth R, Rimm
AA. Rates of inicial and recurrent thromboembolic disease among patients with
malignancy versus those without malignancy: risk analysis using Medicare claims
data. Medicine. 1999;78(5):285-91.
44.López JA, Mearon C, Lee AY. Deep venous thrombosis. Hematology Am Soc
Hematol Educ Program. 2004:439-56.
45.Mandalà M, Reni M, Cascinu S, Barni S, Floriani I, Cereda S, et
al. Venous thromboembolism predicts poor prognosis in irresectable pancreatic
cancer patients. Ann Oncol. 2007;18:1660-5.
46.Mattos MA, Londrey GL, Leutz DW, Hodgson KJ, Ramsey DE, Barkmeier
LD, et al. Color-flow duplex scanning for the surveillance and diagnosis of acute
deep venous thrombosis. J Vasc Surg. 1992;15:366-75; discussion 375-6.
47.Moheimani F, Jackson DE. Venous thromboembolism: classification, risk
factors, diagnosis and management. ISNR Hematol. 2011Oct [citado em 18 mar
2012];2011. doi:105402/2011/124610. PubMed PMID: 124610. Disponível em:
http://www.ncbi.nlm.nih.gov/pmc/articles/pmc3196154/pdf/hematology2011-124610.pdf
48.Morgan MA, Yengar TD, Napiorkowski BE, Rubin SC, Mikuta JJ. The clinical
course of deep vein thrombosis in patients with gynecologic cancer. Gynecol
Oncol. 2002;84:67-71.
49.Nicolosi GL. Trattato di ecocardiografia clinica. Padova: PICCIN; 1999. 4 v.
50.Otten HM, Mathijssen J, ten Cate H, Soesan M, Inghels M, Richel
DJ, et al. Symptomatic venous thromboembolism in cancer patients
treated with chemotherapy: an underestimated phenomenon. Arch Intern Med.
2004;164:190-4.
51.Parkin M, Pisani P, Ferlay J. Global cancer statistics. Cancer J
Clinic. 1999
[citado em 25 jan 2010];49:33-64. Disponível em:
http://caonline.amcancersoc.org/cgi/reprint/49/1/33.pdf
Referências Bibliográficas
42
52.Perrier A, Roy PM, Sanchez O, Le Gal G, Meyer G, Gourdier AL, et al.
Multidetector-row computed tomography in suspected pulmonary embolism. N
Engl J Med. 2005;352:1760-8.
53.Piccioli A, Prandoni P. Venous thromboembolism as first manifestation of cancer.
Acta Haematol. 2001;106:13-7.
54.Prandoni P, Bilora F, Marchiori A, Bernardi E, Petrobelli F, Lensing AW,
et al. An association between atherosclerosis and venous thrombosis. N
Engl J Med. 2003 [citado em 25 jan 2010];348:1435-41. Disponível em:
http://content.nejm.org/cgi/content/full/348/15/1435
55.Prandoni P, Falanga A, Piccioli A. Cancer and venous thromboembolism. Lancet
Oncol. 2005;6:401-10.
56.Prandoni P, Lensing AW, Büller HR, Cogo A, Prins MH, Cattelan AM, et al. Deepvein thrombosis and the incidence of subsequent symptomatic cancer. N Engl J
Med. 1992;327:1128-33.
57.Prandoni P, Lensing AW, Piccioli A, Bernardi E, Simioni P,
Girolami B, et al. Recurrent venous thromboembolism and bleeding complications
during anticoagulant treatment in patients with cancer and venous thrombosis.
Blood. 2002;100:3484-8.
58.Prandoni P. Cancer and thromboembolic disease: how important is the risk of
thrombosis? Cancer Treat Rev. 2002;28:133-6.
59.Prandoni P. Venous thromboembolism risk and management in women with
cancer and thrombophilia. Gend Med. 2005;2 Suppl 1:S28-34.
60.Rahr HB, Sorensen JV. Venous thromboembolism and cancer. Blood Coagul
Fibrinolysis. 1992;3:451-60.
61.Remy-Jardin M, Remy J, Wattinne L, Giraud F. Central pulmonary thromboembolism:
diagnosis with spiral volumetric CT with the single-breath-hold technique:
comparison with pulmonary angiography. Radiology. 1992;185:381-7.
62.Rickles FR, Falanga A. Molecular basis for the relationship
between thrombosis and cancer. Thromb Res. 2001;102:V215-24.
63.Rickles FR, Patierno S, Fernandez PM. Tissue factor, thrombin, and cancer.
Chest. 2003;124 Suppl 3:58S-68.
64.Rickles FR. Cancer and thrombosis in women molecular mechanisms. Thromb
Res. 2009;123 Suppl 2:S16-20.
65.Rodriguez AO, Wun T, Chew H, Zhou H, Harvey D, White RH. Venous
thromboembolism in ovarian cancer. Gynecol Oncol. 2007;105:784-90.
Referências Bibliográficas
43
66.Rollo HA, Fortes VB, Fortes Jr AT, Yoshida WB, Lastória S, Maffei FHA. Abordagem
diagnóstica dos pacientes com suspeita de trombose venosa profunda dos
membros inferiores. J Vasc Br. 2005;4:79-92.
67.Romero A, Alonso C, Ruicón M, Medrano J, Santos JM, Calderón E, et al. Risk
of venous thromboembolic disease in women: a qualitative systematic review.
Eur J Obstet Gynecol Reprod Biol. 2005;121:8-17.
68.Sack Jr GH, Levin J, Bell WR. Trousseau’s syndrome and other manifestations
of chronic disseminated coagulopathy in patients with neoplasms: clinical,
pathophysiologic, and therapeutic features. Medicine. 1977;56:1-37.
69.Sallah S, Wan JY, Nguyen NP. Venous thrombosis in patients with solid
tumors: determination of frequency and characteristics. Thromb Haemost.
2002;87:575-9.
70.Shen VS, Pollak EW. Fatal pulmonary embolism in cancer patients: is heparin
prophylaxis justified? South Med J. 1980;73:841-3.
71.Shoji M, Hancock WW, Abe K, Micko C, Casper KA, Baine RM, et al. Activation of
coagulation and angiogenesis in cancer: immunohistochemical localization in situ
of clotting proteins and VEGF in human cancer. Am J Pathol. 1998;152:399411.
72.Sood SL. Cancer-associated thrombosis. Curr Opin Hematol. 2009;16:378-85.
73.Sørensen HT, Johnsen SP, Norgard B, Zacharski LR, Baron JA. Cancer
and venous thromboembolism a multidisciplinary approach. Clin Lab.
2003;49:615-23.
74.Sørensen HT, Mellemkjaer L, Olsen JH, Baron JA. Prognosis
of cancers associated with venous thromboembolism. N Engl J
Med. 2000 [citado em 25 jan 2010];343:1846-50. Disponível em:
http://content.nejm.org/cgi/content/full/343/25/1846
75.Sørensen HT, Mellemkjaer L, Steffensen FH, Olsen JH, Nielsen GL. The risk
of a diagnosis of cancer after primary deep venous thrombosis or pulmonary
embolism. N Engl J Med. 1998;338:1169-73.
76.Sostman HD. MRA for diagnosis of venous thromboembolism. Q J Nucl Med.
2001;45:311-23.
77.Stein PD, Beemath A, Meyers FA, Skaf E, Sanchez J, Olson RE. Incidence
of venous thromboembolism in patients hospitalized with cancer. Am J Med.
2006;119:60-8.
Referências Bibliográficas
44
78.Streiff MB. Diagnosis and initial treatment of venous thromboembolism in patients
with cancer. J Clin Oncol.2009;27:4889-94.
79.Sud R, Khorana AA. Cancer-associated trombosis: risk factors, candidate
biomarkers and a risk model. Thromb Res. 2009;123 Suppl 4:S18-21.
80.Tateo S, Mereu L, Salamano S, Klersy C, Barone M, Spyropoulos AC, et al.
Ovarian cancer and venous thromboembolic risk. Gynecol Oncol. 2005;99:119-25.
81.Taubman MB. Tissue factor in cancer angiogenesis and coagulopathy. In:
Khorana AA, Francis CW, editors. Cancer-associated thrombosis: new findings in
translational science, prevention, and treatment. New York: InformaHealthcare;
2007. p. 35-49.
82.Tesselaar ME, Romijn FP, Van Der Linden IK, Prins FA, Bertina RM, Osanto
S. Microparticle-associated tissue factor activity: a link between cancer and
thrombosis? J Thromb Haemost. 2007;5:520-7.
83.Thuler LCS, Bergmann A, Casado L. Perfil das pacientes com câncer do colo
do útero no Brasil, 2000-2009: estudo de base secundária. Rev Bras Cancerol.
2012;58:351-7.
84.Van Belle A, Büller HR, Huisman MV, Huisman PM, Kaasjager K,
Kamphuisen PW, et al; Christopher Study Investigators. Effectiveness of managing
suspected pulmonary embolism using an algorithm combining clinical probability,
D-dimer testing, and computed tomography. JAMA. 2006;295:172-9.
85.Varki A. Trousseau’s syndrome: multiple definitions and multiple mechanisms.
Blood. 2007;110:1723-9.
86.Westerbeek RE, Van Rooden CJ, Tan M, Van Gils AP, Kok S, De Bats
MJ, et al. Magnetic resonance direct thrombus imaging of the evolution of acute
deep vein thrombosis of the leg. J Thromb Haemost. 2008;6:1087-92.
87.Zierler BK. Ultrasonography and diagnosis of venous thromboembolism.
Circulation. 2004 [citado em 25 jan 2010];109:9-14. Disponível em:
http://circ.ahajournals.org/cgi/content/full/109/12_suppl_1/I-9.
88.Zwicker JI, Furie BC, Furie B. Cancer-associated thrombosis. Crit Rev Oncol
Hematol. 2007;62:126-36.
45
ANEXOS
Anexos
46
ANEXO i. ESTADIAMENTOS DA FIGO PARA O CÂNCER DO COLO UTERINO
(FIGO 2009)*
Estádio I - Tumor restrito ao colo, sem extensão ao corpo uterino.
IA - Tumor invasivo somente diagnosticado por microscopia com invasão < 5 mm e extensão
< 7 mm.
IA1 - Invasão estromal < 3 mm e extensão < 7 mm.
IA2 - Invasão estromal entre 3 e 5 mm e extensão < 7 mm.
IB - Tumor clinicamente visível limitado ao colo ou tumores pré-clínicos > estádio IA.
IB1 - Tumor clinicamente visível < 4 cm em seu maior diâmetro.
IB2 - Tumor clinicamente visível > 4 cm em seu maior diâmetro.
Estádio II - Tumor invadindo o útero, mas não a parede pélvica ou terço inferior da vagina.
IIA - Não há invasão parametrial.
IIA1 - Tumor clinicamente visível < 4 cm em seu maior diâmetro.
IIA2 - Tumor clinicamente visível > 4 cm em seu maior diâmetro.
IIB - Tumor com invasão parametrial.
Estádio III - Tumor com extensão à parede pélvica e/ou comprometendo o terço inferior
da vagina e/ou causando hidronefrose ou rim não funcionante.
IIIA - Tumor invade terço inferior da vagina sem extensão à rede pélvica.
IIIB - Extensão à parede pélvica e/ou hidronefrose ou rim não funcionante.
Estádio IV - Tumor extende-se além da pelve ou invade a mucosa vesical ou do reto.
IVA - Extensão a órgãos adjacentes.
IVB - Extensão a órgãos a distância.
* Fonte: FIGO Committee on Gynecologic Oncology. Revised FIGO staging for carcinoma of the vulva,
cervix, and endometrium. Int J Gynecol Obstet. 2009 [citado em 25 jan 2010];105:103-4. Disponível em:
http://www.bgcs.org.uk/
Anexos
47
ANEXO ii. RESUMO DA ANÁLISE ESTATÍSTICA PELO PROGRAMA "SPSS"
Number of Cases: 74
Censored: 12
Survival Time
Mean:
26,1
(16,22%) Events: 62
Standard Error
95% Confidence Interval
2,4
(21,4; 30,8)
1,4
(17,7; 23,2)
(Limited to 75,7)
Median:
20,4
'0c
Survival Analysis for MONTHS
Total
Number
Number
Percent
Events
Censored
Censored
TROMBREC
No
945
613
332
35,13
TROMBREC
Yes
74
62
12
16,22
1019
675
344
33,76
Overall
Test Statistics for Equality of Survival Distributions for TROMBREC
Log Rank
Statistic
df
Significance
5,45
1
,0196
Anexos
ANEXO iii. ARTIGO PUBLICADO NO INTERNATIONAL JOURNAL OF
GYNECOLOGICAL CANCER
48
Anexos
49
Anexos
50
Anexos
51
Anexos
52