Malária
Profa. Dra. Irene Soares
Disciplina Parasitologia Clínica, FCF/USP
1°semestre/2005
Taxonomia
•
•
•
•
•
•
•
Filo: Apicomplexa
Classe: Sporozoea
Ordem: Eucoccidiida
Família: Plasmodiidae
Gênero: Plasmodium
Espécies: > 100 espécies
No homem: P. falciparum
P. vivax
P. malariae
P. ovale
Biologia do parasita
Formas evolutivas
No hospedeiro
vertebrado:
No hospedeiro
invertebrado:
Esporozoíta
Trofozoíta
Esquizonte
Merozoíta
Gametócitos
(microgametócito
e macrogametócito)
Microgameta/macrogameta
Zigoto *
Oocineto *
Oocisto *
Esporozoíta
* Estágios diplóides
Transmissão
Ocorre pela inoculação
das formas esporozoítas
de Plasmodium durante
a picada da fêmea do
mosquito do gênero
Anopheles
No Brasil, o inseto vetor é conhecido como: pernilongo, mosquito
prego e carapanã
Anopheles
Manchas
pretas na asa
Biologia do parasita
Formas infectivas:
esporozoítas
Formas hepáticas se
desenvolvem nas células do
fígado
Estágios invasivos de Plasmodium
oocineto (móvel)
• Células epiteliais do
estômago do mosquito
esporozoíta (móvel)
• Glândula salivar do
mosquito
• hepatócitos
merozoíta (imóvel)
• Eritrócitos/reticulócitos
Formas sangüíneas (dentro das hemácias)
Trofozoítas
trophozoites
P.falciparum
P.vivax
P.malariae
P.ovale
Esquizontes
schizonts
Gametócito
gametocytes
No homem:
Reprodução
assexuada
↓
Esquizogonia:
tecidual e
eritrocítica
No mosquito:
Reprodução
sexuada e
assexuada
Esporozoítas
Oocisto
Oocineto
Merozoítas
Esquizontes
Zigoto
Gametas
Trofozoítas
Gametócitos
Proteínas de esporozoítas envolvidas na
invasão de hepatócitos
Circumsporozoite Protein (CS)
Trombospondin-related adhesive protein (TRAP)
Receptores/ligantes para invasão do
eritrócito/reticulócito pelo merozoíta
P. falciparum *
P. vivax
P. knowlesi
Ligante no
merozoíta
EBA-175
DBP
Receptor no
hospedeiro
Glicoforinas
(ácido siálico)
Antígeno Duffy
* Pf pode usar diferentes ligantes/receptores para invasão
do eritrócito
Especificidade da invasão
Célula
vermelha
Duffy positivo
Duffy negativo *
P. vivax P. knowlesi P. falciparum
+
-
+
-
+
+
* Indivíduos Duffy negativos são completamente refratários
a infecção por P. vivax
Patogenia e Sintomatologia
Período de incubação
Varia de acordo com a espécie de Plasmodium
(em média 15 dias)
Acesso malárico (paroxismo)
1) calafrios e tremores, temperatura em elevação
2) febre alta, sensação de calor e cefaléia intensa
3) queda da temperatura, sudorese
Patogenia e Sintomatologia
Os acessos maláricos se repetem com intervalos
diferentes, de acordo com a espécie do plasmódio:
P. falciparum - com intervalos de 36 a 48 horas
(terçã maligna)
P. vivax - acessos em dias alternados, 48 em 48 horas
(terçã benigna);
P. malariae - os acessos se repetem a cada 72 horas
(febre quartã);
Patogenia e Sintomatologia
Malária grave por P. falciparum
ocorre em
adultos não imunes, crianças e gestantes
• Sequestro dos eritrócitos parasitados: adesão ao endotélio
vascular (citoaderência)
• Formação de rosetas: eritrócitos infectados c/ eritrócitos
não infectados
• Hiper-parasitemia: (>2-5% das hemácias parasitadas, +++
ou presença de esquizontes)
• Malária cerebral, insuficiência renal, edema pulmonar agudo,
anemia grave, icterícia acentuada, hipertermia, vômitos
Patogenia e Sintomatologia
Recaídas
Ocorre nas infecções por P. vivax e P. ovale → formas
hipnozoítas no fígado (permanecem em estado de latência
por períodos que variam de 1 mês a 1-2 anos)
Recrudescências
Parasitemia reaparece (acompanhada de sintomatologia),
após um período de “cura aparente” → resposta inadequada
ao tratamento (sobrevivência de formas eritrocíticas)
Comparação entre as malárias humanas
P. falciparum
P. vivax
P. malariae
P. ovale
Hipnozoítas
(Recaídas)
-
+
-
+
Malária grave
+
-
-
-
Tipo de
eritrócito que
infecta
Todas as
idades
Reticulócitos
Eritrócitos
maduros
Reticulócitos
Resposta imune
Mecanismos de eliminação do parasita
• Estágios extracelulares
• Esquizontes hepáticos
eficiência)
• Estágios sangüíneos
anticorpos
linfócitos T CD4 e CD8 (alta
anticorpos e linfócitos T CD4
Tratamento
Principais drogas antimaláricas
Esquizonticidas sangüíneos
Quinina, mefloquina, halofantrina, cloroquina, amodiaquina
digestão de produtos da hemoglobina
Derivados de artemisina
metabolismo das proteínas
Tetraciclina, doxiciclina e clindamicina
proteínas
síntese de
Esquizonticidas teciduais ou hipnozoiticidas
Primaquina
inibe a respiração mitocondrial do parasita
* também é gametocitocida
Tratamento
Esquema recomendado no Brasil:
P. vivax – cloroquina (para as formas sangüíneas)
e primaquina (para as formas hepáticas)
P. falciparum:
Malária não grave – associação quinina/doxiciclina
ou quinina/tetraciclina
Em casos graves - artesunato/mefloquina ou
quinina/clindamicina
Resistência à Cloroquina na maioria dos isolados
de P. falciparum
Estratégias
de
vacinação
Bloqueio da
infecção
Bloqueio da
transmissão
Redução da
morbidade/
mortalidade
Epidemiologia da malária no mundo
A malária é endêmica em 101 países
> 300 milhões de casos por ano
> 1 milhão de mortes por ano
200 crianças por hora (P. falciparum)
Epidemiologia da malária no Brasil
• No Brasil, ocorrem anualmente 300 a 500 mil
casos por ano
• P. vivax é a espécie prevalente no Brasil
(aproximadamente 80% dos casos)
• A grande maioria dos casos ocorre na Amazônia (>99%)
• Estados com maior número de casos de malária: Pará e
Amazonas.
Malária no Brasil (1970-2001)
Fonte: FUNASA – Ministério da Saúde
700
No casos x 1000
600
500
400
300
200
100
70
9
1
75
9
1
80
9
1
85
9
1
Anos
90
9
1
95
9
1
00
0
2
Diagnóstico laboratorial
Diagnóstico microscópico:
Preparo do esfregaço
Fino
Fixação
Coloração de Giemsa
Espesso (gota espessa)
Coloração de Giemsa (esfregaço
desemoglobinizado)
Coleta do material
Punção digital
Gota espessa
Esfregaço
sanguíneo
Diagnóstico laboratorial
Diagnóstico microscópico:
Gota espessa
exame de 100 campos microscópicos
método semi-quantitativo → “cruzes”
+ = 1 parasita/campo
++ = 2-20 parasitas/campo
+++ = 21-200 parasitas/campo
++++ = mais de 200 parasitas/campo
Características morfológicas dos parasitas em esfregaços sanguíneos
Estágio
P. falciparum
P. vivax
P. malariae
P. ovale
Células vermelhas
infectadas
Tamanho normal,
granulações de
Maurer e pigmento
malárico
Aumentadas, presença
de grânulos de
Schuffner
Tamanho normal ou
menores do que o
normal
Aumentadas, podem
ser ovais com fímbria,
presença de grânulos
de Schuffner
Estágio de anel
(trofozoíta jovem)
Pequeno e delicado,
freqüente 2 grânulos
na cromatina,
frequente 2 ou mais
anéis por célula
vermelha do sangue
Pouco aumentado, 1
ou 2 grânulos na
cromatina, podem ser
2 anéis por célula
vermelha
Compacto, 2 anéis
por célula vermelha
do sangue, raro
Compacto, 2 anéis
por célula vermelha
do sangue, raro
Trofozoíta
Tamanho moderado,
normalmente
compacto, pigmento
granular
Aumentado,
amebóide, pigmento
visto em bastões finos
Pequeno, compacto,
frequente, forma de
banda, pigmento
grosseiro
Pequeno, não
amebóide, pigmento
grosseiro
Esquizonte maduro
Raros em sangue
periférico, merozoítas
pequenos (8-16)
Grandes, merozoítas
grandes (12-24)
Pequenos,
merozoítas grandes
(6-12), pigmento
grosseiro
Menores do que
P. vivax, 6-12
merozoítas, pigmento
mais escuro do que
P. vivax
Gametócitos
Forma crescente,
núcleo único
Esféricos, compactos,
núcleo único, pigmento
difuso e grosseiro
Similares a P. vivax,
porém menores e
menos numerosos,
grânulos de Schuffner
ausentes
Similares a P. vivax,
porém menores
P. falciparum
Estágio de anel
(trofozoítas jovens)
Trofozoítas
maduros
(raros no sangue periférico)
P. falciparum
Esquizontes
(raros no sangue periférico)
Gametócitos
P. vivax
Estágio de anel
(trofozoítas jovens)
Trofozoítas
maduros
P. vivax
Esquizontes
Gametócitos
P. malariae
Estágio de anel
(trofozoítas jovens)
Trofozoítas
maduros
P. malariae
Esquizontes
Gametócitos
P. ovale
Estágio de anel
(trofozoítas jovens)
Trofozoítas
maduros
P. ovale
Esquizontes
Gametócitos
Diagnóstico microscópico:
Quantitative Buffy Coat (QBC) Test
« Plaquetas
Laranja de acridina
↓
Cora DNA e RNA
« Linfócitos/monócitos
« Granulócitos
Hemácias
parasitadas
« Hemácias
Diagnóstico microscópico: QBC
Diagnóstico laboratorial
• Testes rápidos de detecção de antígenos:
(imunocromatográficos):
ParaSight-F (PfHRP2), ICT Malaria (PfHRP2),
ICT Malaria Pf/Pv (pLDH), OpitMAL (pLDH),
Malar-Check Pf
• Testes para detecção de anticorpos:
Imunofluorescência indireta
ELISA
• PCR
ParaSight F (Becton & Dickinson)
PfHRP2 (Proteína 2 rica em histidina)
Fase sólida: anticorpo
monoclonal anti-PfHRP2
ou PfHRP2 (controle +)
Conjugado: anticorpo
policlonal anti-PfHRP2
marcado com rodamina
ICT Malaria P.f. (ICT Diagnostics)
Anticorpo marcado
com ouro coloidal
ICT Malaria P.f./P.v.
• Detecta a presença de PfHRPII e de um antígeno
gênero-específico pan-malárico presente em todas
as 4 espécies de Plasmodium humanos
• Não é capaz de diferenciar entre infecções causadas
por P. vivax/P. malariae/P. ovale
OptiMAL® Rapid Malaria Test
• Detecta isoformas da enzima lactato desidrogenase (pLDH)
• Uma isoforma é específica para P. falciparum e a outra ocorre
nas 4 espécies de plasmódios humanos
Diagnóstico por Imunofluorescência
Diagnóstico por PCR
!"
!##
"
$
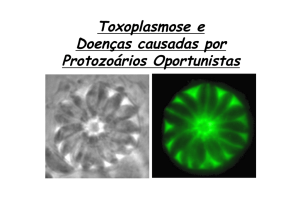
Toxoplasmose
Taxonomia
•
•
•
•
•
•
Filo: Apicomplexa
Classe: Sporozoa
Ordem: Eucoccidia
Família: Sarcocystidae
Gênero: Toxoplasma
Espécie: Toxoplasma gondii
Biologia do parasita
Formas infectantes: taquizoítas
• Forma livre ou trofozoíta
• Encontrado na fase aguda da
infecção
• Forma de arco (toxon=arco)
• Forma móvel, de multiplicação
rápida (tachis=rápido)
A.
B.
C.
Extracellular
Intracelular (cultura)
Intracelular (M.E.)
Biologia do parasita
Formas infectantes: bradizoítas
• Encontrado na fase crônica
da infecção (tecido muscular)
• Forma de multiplicação lenta
(brady=lento) dentro do cisto
A e B - Cistos teciduais
(cérebro de camundongo)
C - Cisto com 6 bradizoítas
(cultura de células)
Biologia do parasita
Formas infectantes: oocistos
Oocisto
imaturo
• Forma de resistência
(meio ambiente)
• Após esporulação o oocisto
contem 2 esporocistos com
4 esporozoítas cada
Oocisto
maduro
Ciclo biológico
Felídeos (hospedeiros definitivos):
Formas do ciclo sexuado → células do epitélio intestinal
Formas do ciclo assexuado → em outro locais do hospedeiro
Forma de resistência → no meio exterior junto com as fezes
Ciclo biológico
Homem e outros animais (hospedeiros intermediários):
Vários tecidos e células (exceto hemácias) → trofozoítas
dentro do vacúolo parasitóforo ou nas circulações
sanguínea/linfática
Líquidos orgânicos (saliva, leite, esperma, líquido peritoneal)
Transmissão
•
Ingestão de oocistos maduros (contendo esporozoítas)
eliminados pelas fezes de gatos ou de outros felídeos
•
Ingestão de cistos (contendo bradizoítas) presentes em carne
crua ou mal cozida (porco, carneiro)
•
Ingestão de leite cru (não pasteurizado) contendo taquizoítas
•
Transplante de orgãos ou transfusão sanguínea → taquizoítas
•
Transmissão placentária → taquizoítas
•
Inoculação acidental de taquizoítas
Ciclo biológico
Oocistos
Oocistos não
não
esporulados
esporulados
nas
nas fezes
fezes
HOSPEDEIRO
HOSPEDEIRO DEFINITIVO
DEFINITIVO
Taquizoítas
Taquizoítas transmitidos
transmitidos
através
através da
da placenta
placenta
Ingestão
Ingestão de
de cistos
cistos
junto
com
alimentos
junto com alimentos
contaminados
contaminados
Ingestão
Ingestão de
de
Ingestão
de
cistos
contendo
Ingestão de cistos contendo
oocistos
oocistos
bradizoítas
bradizoítas nos
nos tecidos
tecidos dos
dos hosp.
hosp.
intermediários
intermediários
Contaminação
Contaminação de
de
água
e
alimentos
água e alimentos
Ingestão
Ingestão de
de oocistos
oocistos
Oocistos
Oocistos
esporulados
esporulados
HOSPEDEIROS
HOSPEDEIROS INTERMEDIÁRIOS
INTERMEDIÁRIOS
Infecção
Infecção do
do feto
feto
Diagnóstico Parasitológico
• Detecção do parasita em lavado broncoalveolar
ou biópsia de linfonodos
• Isolamento do parasita por inoculação em
camundongos: 6 a 10 dias
pesquisa de taquizoítas
(líquido peritoneal, cisto no cérebro ou outros orgãos)
• Cultura em fibroblastos
• PCR
Taquizoítas coletados de líquido peritoneal de
camundongo inoculado com T. gondii
(Giemsa)
T. gondii
(Cisto contendo bradizoítas – tecido cerebral, HE)
Oocisto
não esporulado
Oocisto
esporulado
T. gondii (fezes de gato)