Escola Secundária Filipa de Vilhena
2010/2011
Curso: Gestão e Programação de Sistemas Informáticos
Física e Química
TESTE DE AVALIAÇÃO – Módulo Q1
Estrutura atómica. Tabela periódica. Ligação Química.
11ºAno
Turma I
22 de Fevereiro de 2011
Número: ___ Nome: ____________________________________
Classificação: ___________ Professor: ____________________
No final do enunciado, encontrarás um anexo com alguma informação relevante à sua realização.
Bom Trabalho!
1. Numa actividade realizada numa aula de Física e Química, fez-se reagir várias amostras de vários
elementos em água.
1.1. Um dos elementos que se fez reagir em água foi o sódio (Na). Indica qual dos seguintes elementos
pertence ao mesmo grupo do sódio:
A. Berílio (Be)
B. Alumínio (Al)
C. Lítio (Li)
D. Magnésio (Mg)
1.2. Estes elementos, ao reagirem com a água, efectuam uma troca de electrões. Classifica cada uma
das seguintes partículas como átomo ou ião, e indica a carga eléctrica:
a) Elemento sódio com 11 electrões: _______________ – carga eléctrica: _______
b) Elemento sódio com 10 electrões: _______________ – carga eléctrica: _______
c) Elemento berílio com 2 electrões: _______________ – carga eléctrica: ______
d) Elemento magnésio com 12 electrões: ___________ – carga eléctrica: _______
1.3. O sódio apresenta uma reactividade muito semelhante à do potássio. Indica quais as características
da estrutura de ambos que explicam esta semelhança.
1.4. Escreve a configuração electrónica das seguintes partículas:
a)
6
C
b)
10
Ne
c)
12
Mg²⁺
d)
9
F⁻
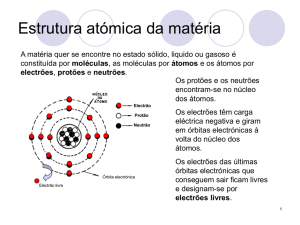
1.5. Na seguinte imagem encontra-se, esquematizado, um átomo de cálcio (Ca). Completa a legenda
com a informação em falta.
2. A organização da tabela periódica revela algumas propriedades interessantes dos elementos, e realça a
sua periodicidade.
2.1. Escolhe a opção que completa correctamente a seguinte afirmação: O raio atómico do elemento
potássio (K) é ...
A. … inferior ao do sódio (Na).
B. … inferior ao do cálcio (Ca).
C. … inferior ao do césio (Cs).
D. … igual ao do sódio (Na).
2.2. Explica a variação do raio atómico ao longo do grupo e ao longo do período.
2.3. A tabela periódica está também dividida por blocos. Indica se o bloco mais à direita, ao qual
pertencem elementos como o oxigénio (O), enxofre (S) e flúor (F), entre outros, é um bloco s, p, d ou
f. Recorre a dois elementos desse grupo, à tua escolha, para justificar a opção.
2.4. Um determinado elemento, no seu estado fundamental, apresenta a seguinte configuração
electrónica:
1s² 2s² 2p⁵
Localiza (indica o grupo e o período) este elemento na tabela periódica. Justifica a tua escolha com
base em dados da configuração electrónica.
2.5. A primeira energia de ionização do oxigénio (O) é de 1313 kJ /mol e a do cloro (Cl)é de 1251 kJ /
mol. Indica qual das opções deverá apresentar a energia de ionização do enxofre (S):
A. 1280 kJ / mol
B. 1472 kJ / mol
C. 1313 kJ / mol
D. 999 kJ / mol
3. O carbono-14 é um isótopo de carbono muito utilizado em métodos de datação radiométrica.
3.1. Indica quais as diferenças e semelhanças entre os isótopos carbono-14 e carbono-12.
3.2. Consultando a tabela periódica, observamos que a massa atómica relativa do carbono é 12,01, mas
a massa atómica relativa toma como referência a duodécima parte do átomo de carbono-12.
Explica o motivo pelo qual a massa tabelada é 12,01 e não apenas 12.
3.3. Classifica as seguintes afirmações como verdadeiras ou falsas:
A. ___ O silício (Si) pertence ao mesmo período do carbono.
B. ___ Os isótopos carbono-12 e carbono-14 têm a mesma massa atómica relativa.
C. ___ O oxigénio (O) pertence ao mesmo período do carbono.
D. ___ Podemos obter um isótopo de carbono variando o número de protões ou o número de
neutrões.
E. ___ O isótopo de carbono-14 e o isótopo de azoto-14 (¹⁴N) têm a mesma massa atómica
relativa.
3.4. Quando um átomo se transforma num ião positivo ou negativo, perde ou ganha electrões num
determinado número. Indica por que motivo não podemos considerar os iões isótopos, apesar de
variar o número de electrões.
4. É muito comum dois ou mais átomos estabelecerem ligações químicas para se tornarem moléculas,
sendo assim, no seu conjunto, mais estáveis.
4.1. Os átomos podem formar ligações de vários tipos, nomeadamente ligações covalentes simples,
duplas ou triplas. Escolhe a opção que completa correctamente a seguinte afirmação: A energia de
dissociação de uma ligação dupla é...
A. … superior à de uma ligação simples.
B. … inferior à de uma ligação simples.
C. … superior à de uma ligação tripla.
D. … superior à respectiva energia de ligação.
4.2. O comprimento de ligação da molécula de O2 é de 121 pm. Indica qual das seguintes opções
representará o comprimento de ligação na molécula de CO.
A. 112 pm
C. 121 pm
B. 567 pm
D. 243 pm
4.3. Caracteriza a ligação química na molécula de N2. Apresenta todos os passos de resolução.
4.4. Determina a geometria molecular na molécula de CH3Cl. Apresenta todos os passos de resolução,
justificando a geometria escolhida.
COTAÇÕES