Sociedade Brasileira de Química ( SBQ)
Reação de acoplamento de Suzuki-Miyaura de sais de potássio de
ariltrifluoroboratos com 5-iodo-1,3-dioxin-4-ona em meio aquoso
Adriano S. Vieira (PG)a, Mônica F. Z. J. Amaral (PG)a, Alexandre S. Guarezemini (PG)c e Hélio A.
Stefani (PQ)*,a,b
a
Faculdade de Ciências Farmacêuticas, Universidade de São Paulo, São Paulo, SP - Brasil.
b
Deparmento de Biofísica, Universidade Federal de São Paulo, São Paulo, SP – Brasil.
c
Instituto de Química, Universidade de São Paulo, São Paulo, SP – Brasil
*autor principal. E-mail: [email protected]
Palavras Chave: Suzuki-Miyaura, organotrifluoroboratos de potássio, 1,3-dioxin-4-ona.
Introdução
A reação de acoplamento cruzado entre haletos
orgânicos ou pseudo-haletos com organoboranas,
catalisada por paládio, sob condições básicas, é
conhecida por Suzuki-Miyaura e é um método
altamente versátil para a formação de ligações
carbono-carbono e que tolera a presença de vários
grupos funcionais.1 Os compostos organo boro têm
várias vantagens em relação aos outros
organometálicos,
incluindo
acessibilidade
e
facilidade de extração do produto, toxidade mínima
e outros fatores ambientais.2 Esforços para melhorar
as reações de Suzuki-Miyaura voltados ao
desenvolvimento de novos sistemas metal/ligante
que poderiam facilitar a reação de acoplamento
apontam
os
sais
de
potássio
de
organotrifluoroboratos
como
reagentes
promissores.3
atua
Nesta
metodologia
o
n-Bu4NOH
simultaneamente como base e como catalisador de
transferência de fase. Todos os produtos foram
isolados e caracterizados por espectroscopia de
ressonância magnética nuclear e espectrometria de
massas. Os produtos das reações de acoplamento
foram obtidos em bons rendimentos, entre (65 e
93%).
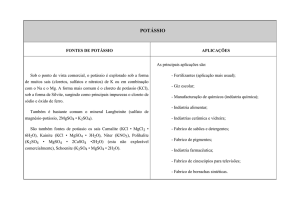
O
OCH 3
O
O
O
O
H 3C
O
H 3C
CH3
H 3C
H 3C
3a, 82%
Cl
O
H 3C
O
CH3
O
H 3C
3b, 93%
CH3
3c, 79%
CF3
O
O
H 3C
H 3C
SEt
O
O
O
O
CH 3
3d, 65%
H 3C
H 3C
O
H 3C
O
CH 3
3e, 72%
H 3C
CF3
O
CH 3
3f, 76%
Resultados e Discussão
Em continuação de nossos estudos da utilização
de sais de potássio de organotrifluoroboratos e
haletos orgânicos em reações de acoplamento
cruzado do tipo Suzuki-Miyaura, desenvolvemos
uma eficiente metodologia para preparar 5-aril-1,3dioxin-4-onas as quais são precursores diretos de
compostos α-aril-1,3-dicarbonílicos. Nos estudos da
otimização reacional várias condições foram
testadas variando-se o solvente, base e o
catalisador de paládio. O sistema catalítico mais
eficiente encontrado foi empregando n-Bu4NOH
(50%) (3.0 eq) como base, em meio aquoso,
Pd2(dba)3 (5 mol%) como catalisador e PhBF3K (1,2
eq). A melhor condição foi aquecimento a 80 oC
durante 2 horas até consumo total do material de
partida (Figura 1).
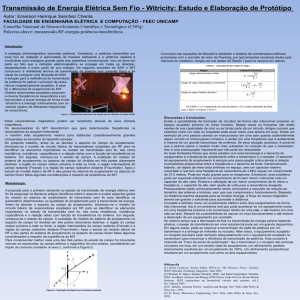
O
O
H 3C
O
H3 C
1
I
BF3 K
O
Pd 2(dba)3
O
+
CH 3
2a
n-Bu 4NOH, H 2O
80o C, 2 h
87%
H3 C
O
H 3C 3a
CH3
Figura 1. Reação de acoplamento em meio aquoso.
a
32 Reunião Anual da Sociedade Brasileira de Química
Figura 2. Produtos obtidos.
Conclusões
Explorou-se a reação de acoplamento do tipo
Suzuki-Miyaura
de
sais
de
potássio
de
ariltrifluoroboratos com 5-iodo-1,3-dioxin-4-ona na
presença de quantidades catalíticas de Pd2(dba)3
em
condições
suaves
e
meio
aquoso,
estabelecendo uma nova e eficiente rota para a
síntese de precursores de compostos 1,3dicarbonílicos.
Agradecimentos
Os autores agradecem a Fundação de Amparo à
Pesquisa do Estado de São Paulo (FAPESP), CNPq
e CAPES pelo apoio financeiro.
____________________
1
Metal-Catalyzed Cross-Coupling reactions; Diederich, F., Stang, P. J.,
Eds.; Wiley-VHC: Weinheim, Germani, 1998.
2
Matteson, D. S. Stereodirected Synthesis with Organoboranes;
Springer-Verlag: Berlin 1995.
3 (a)
Stefani, H. A.; Cella, R.; Vieira, A. S. Tetrahedron 2007, 63, 3623.
(b)
Darses, S.; Genêt, J. –P. Chem. Rev. 2008, 108, 288.